基于主成分分析法的 茶叶多糖提取工艺优化
黄 谦,朱明扬,罗林根,石 浩,吴少平
(1.岳阳市食品质量安全监督检验中心,湖南岳阳 414000; 2.湖南农业大学,湖南长沙 410000)
茶叶是世界三大饮料之一,我国茶资源丰富,饮茶历史悠久。饮茶带来的人体健康效应受到国内外众多研究人员的关注[1-2]。茶叶多糖是茶叶中的一种重要功能性成分,多糖具有抗氧化、抗衰老[3],增强免疫力[4]、防止动脉粥样硬化[5],降低血糖血压[6]等功效;同时茶叶多糖具有吸收快、代谢彻底、无残留等优点,几乎无毒副作用。目前国内外对茶叶多糖多采用热水直接浸提法,该方法操作简单、方便,但浸提效率以及得率都较低,不适应如今工业上大规模快速、高效的生产[7]。本文采用酶-水超声浸提法对茶叶多糖进行提取实验,此法相对于一般水提法,同样具有操作简单、对操作环境要求低、具有较高的实用性、安全环保等特点,同时还具有高产出和高效性[8]。由于茶叶中粗纤维含量高,对多糖的快速提取造成了一定的难度,通过酶液的添加可提前破坏细胞壁外围纤维,同时通过超声波助提加快提取速率[9]。本文首次运用主成分分析与正交试验相结合,对茶叶多糖提取工艺进行相关研究,实验选取影响茶叶多糖提取得率的10个提取因素进行主成分分析,以获得影响茶叶多糖提取得率的主成分,再结合正交试验设计筛选最佳的提取条件组合,对茶叶多糖提取工艺条件进行综合研究,为茶叶制品工业化利用和茶叶多糖的制备提供试验依据。
1 材料与方法
1.1 材料与仪器
毛尖茶(当年采摘绿茶) 购于湖南农业大学和润茶业科技有限公司,粉粹后过筛得茶叶粉末;木瓜蛋白酶(≥60万U/g) Sigma公司;有机溶剂石油醚、正丁醇、氯仿、无水乙醇、苯酚、8%浓硫酸、无水葡萄糖标准品等 分析纯,上海国药生产。
THZ-92B可调速控温摇床 上海浦东物理仪器厂;DR-1001旋转蒸发仪 郑州长城科工贸有限公司;202-1电热恒温干燥箱 长沙康隆仪器设备有限公司;ZW1105051705紫外可见分光光度计 上海光谱仪器有限公司;TG16台式高速离心机 长沙英泰仪器有限责任公司;KQ2200DB超声波仪 上海五相仪器仪表有限公司;DK-98-IIA电热恒温水浴锅 天津市泰斯特仪器有限公司。
1.2 试验方法
1.2.1 茶叶多糖的制备 茶叶在阴暗处、20~25 ℃、30%~70%相对湿度条件下的可控仓库中贮藏。取已贮藏1个月茶叶打粉、过30目筛,精确称取1.0 g茶叶粉末,蒸馏水作为提取溶剂,料液比为1∶15(g/mL),用最终浓度为1%木瓜蛋白酶反应1 h后,于50 ℃下分别超声(300 W)提取1次,提取时间0.5 h[10]。提取后抽滤,合并滤液,滤液浓缩至10 mL,最终浓度为50%乙醇沉淀,10 mL蒸馏水溶解,采用Sevag试剂清除蛋白。
1.2.2 茶叶多糖提取得率的测定 标准曲线的绘制:精密称取105 ℃干燥至恒重的葡萄糖标准品0.2508 g,置于250 mL容量瓶中,加蒸馏水溶解并稀释至刻度,配制成1 mg/mL的标准溶液,然后分别量取2.5、5.0、10、15、20 mL标准溶液置于100 mL容量瓶中稀释至刻度,配制成系列标准溶液。分别移取1 mL系列标准溶液于具塞试管中,再分别移取1 mL新配制的5%苯酚溶液和5 mL 98%的浓硫酸,用玻璃棒搅拌混匀,常温下放置20 min,沸水浴3 min,自来水冷冲洗试管冷却后,用蒸馏水补至10 mL,取1 mL测定吸光值A490 nm,以同体积蒸馏水为阴性对照。得回归方程:y=0.0092x+0.0076(R2=0.9996)。对上述制备的茶叶多糖稀释至一定体积后,用硫酸-苯酚法测定其含量及提取得率。
茶叶多糖提取得率(%)=Ci×n/m
式中:Ci:测定浓度(μg/mL),n:稀释倍数(10000),m:茶叶质量(10 g)。
1.2.3 多糖超声提取单因素实验 通过相关文献的查阅与了解[11],本文选取10个影响多糖提取得率的常见因素进行超声波提取实验。准确称取相同质量的茶叶粉末,改变其中的某一个单因素条件,其它固定因素水平同1.2.1,进行超声提取、测定多糖提取得率,考察每一个单因素对茶叶多糖提取得率的影响。
提取次数分别为1、2、3、4、5次。终浓度分别为1%、2%、3%、4%、5%木瓜蛋白酶反应1 h后提取,确定提取得率。酶反应时间分别为1.0、1.5、2.0、2.5、3 h。提取温度分别50、60、70、85、100 ℃。最终浓度分别为50%、65%、75%、80%、90%无水乙醇沉淀,确定提取得率。料液比分别为1∶10、1∶20、1∶30、1∶40、1∶50(g/mL)的条件下,确定提取得率。提取时间分别为0.5、1.0、1.5、2.0、2.5 h的条件下,确定提取得率。超声功率分别为300、500、700、1000、1500 W的条件下,确定提取得率。茶叶粉碎度分别在40、50、60、70、80目的条件下,确定提取得率。茶叶贮藏期分别为1、3、6、12、18个月确定提取得率。
1.2.4 正交试验设计 筛选主要因素指标和实验水平,通过单因素主成分分析结果得到四因素三水平正交试验设计列表1,以茶叶多糖的提取得率作为依据,确定最佳工艺条件。
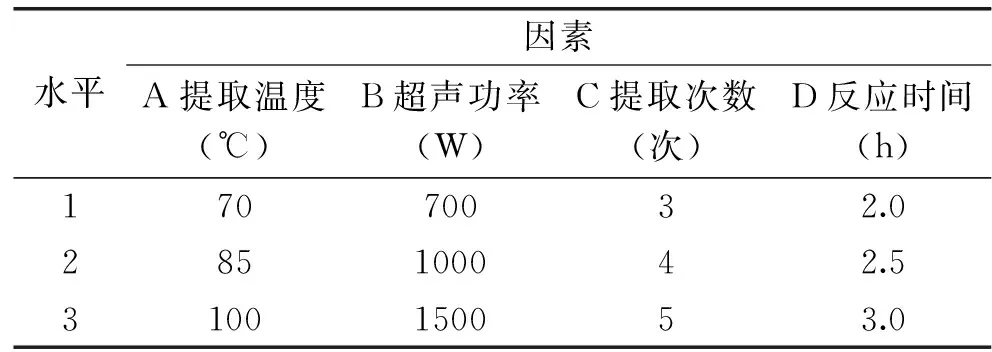
表1 正交试验设计Table 1 Orthogonal experimental design
1.2.5 数据处理 单因素实验结果运用SPSS 19.0软件进行主成分分析。数据采用Origin制图,ASS 9.0统计软件进行显著性分析,α=0.05为显著性水平,p<0.05表示差异有统计学意义。
2 结果与分析
2.1 单因素实验
2.1.1 超声功率的影响 茶叶多糖提取得率随着超声功率的升高出现升高的趋势,但超声功率超过1000 W时有所降低。如图1所示,在超声功率为300 W时,茶叶多糖提取得率仅为2.8%左右,当功率增加到1000 W时,茶叶多糖提取得率达到最大值,说明超声提取能极大地提高对天然植物功效成分的提取得率,且在前4个水平间多糖得率均具有显著性差异(p<0.05)。但当超声功率达到1500 W时茶叶多糖提取得率有所下降,很可能是过高的功率破坏了茶叶多糖的结构,从而导致得率下降[12]。因此,由于减少能量消耗及茶叶多糖提取得率方面的考虑,选择700~1000 W超声功率较为适宜。

图1 超声功率对多糖提取得率的影响Fig.1 Effect of ultrasonic power on polysaccharide extraction 注:图中不同字母表明差异性显著(p<0.05),下同。
2.1.2 料液比的影响 茶叶多糖提取得率随着料液比的升高有缓慢增加的趋势。如图2所示,采用1∶10提取时,得率较低,仅为2.8%。当料液比在1∶20~1∶30时,茶叶多糖提取得率迅速增加,当料液比为1∶40时,茶叶多糖提取得率几乎达到了最大值,相对于1∶10增加了42.5%,且在前4个水平间多糖得率均具有显著性差异(p<0.05)。提取液作为一种溶剂,溶剂量的增加可加大溶质的溶出量,但随着多糖溶出量的耗尽以至于多糖得率趋于平稳[13]。因此,选择料液比为1∶40 g/mL之间较为合适。
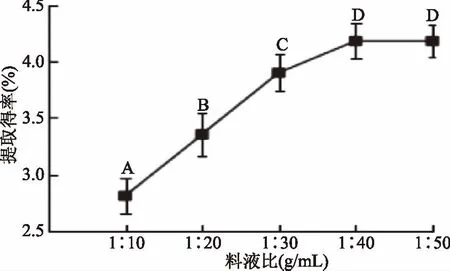
图2 料液比对提取得率的影响Fig.2 Effect of ratio of feed to liquid on extraction yield of polysaccharide
2.1.3 提取次数的影响 茶叶多糖提取得率随着提取次数的增加而增加。如图3所示,提取1次时,提取得率较低,仅为2.8%。当提取次数增加到2次时,相对于提取1次茶叶多糖的提取得率有较大幅度的增加,呈现显著差异(p<0.05),这可能是提取次数过少导致提取不完全,适当增加提取次数有利于茶叶多糖的完全溶解;但后期增加趋势缓慢,这和周杨[14]等的研究结果较为相似。因此,考虑到效率,选择超声提取2~3次较为适宜。

图3 提取次数对提取得率的影响Fig.3 Effect of extraction times on extraction yield of polysaccharide
2.1.4 提取时间的影响 茶叶多糖提取得率随着提取时间的增加而逐渐增加。如图4所示,当提取时间为0.5 h时,茶叶多糖提取得率较低。提取时间超过0.5 h后,多糖得率有较大程度的提高(提取时间在0.5~1.5 h之间时,各水平间p<0.05),提取时间的延长在很大程度上有利于提取得率的提高[15]。2.0 h的时提取时间可使多糖几乎完全溶出,达到了4.0%左右,因此,选择1.5~2.0 h较为适宜。
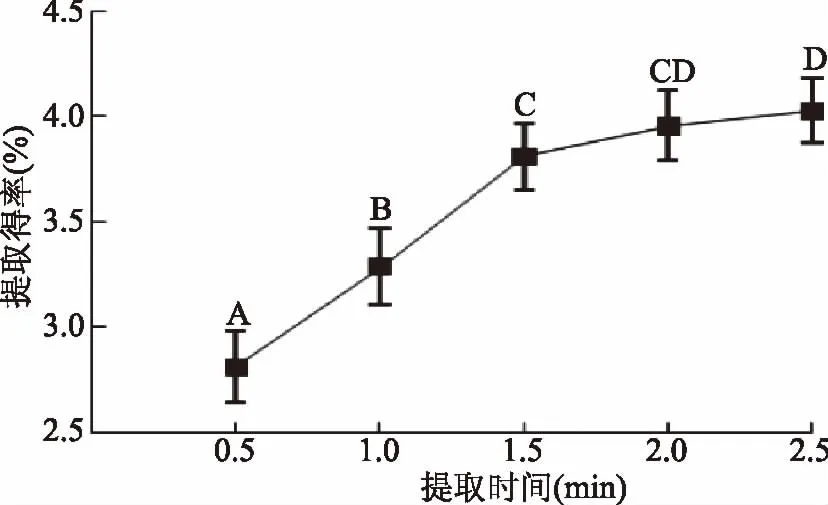
图4 提取时间对提取得率的影响Fig.4 Effect of extraction time on extraction yield of polysaccharide
2.1.5 提取温度的影响 茶叶多糖提取得率随着温度的升高有逐渐增加的趋势。如图5所示,采用提取温度为50 ℃时,得率较低,仅为2.8%。在提取温度为60~85 ℃时,茶叶多糖提取得率急剧升高(各水平间p<0.05),相对于50 ℃的茶叶多糖提取得率增加了53.2%,这是由于随着温度的升高加大了茶叶多糖水中的溶解度;当温度超过85 ℃时,茶叶多糖提取得率的增加量逐渐放缓,这是因为高温会破坏茶叶多糖的结构[16],因此,85 ℃较合适。
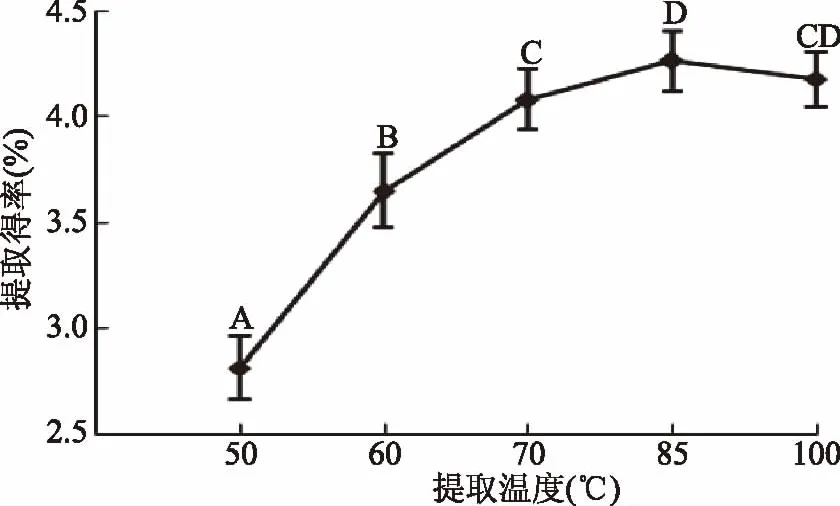
图5 提取温度对提取得率的影响Fig.5 Effect of extraction temperature on extraction yield of polysaccharide
2.1.6 粉碎度的影响 茶叶多糖提取得率随着粉碎度的增加有增加的趋势,但后期略微有所减低。如图6所示,茶叶粉末过30~50目时,所得粉末越细,多糖提取得率越高。茶叶过50目筛时,对茶叶多糖提取得率达到最大值,相对于过30目筛的茶叶,茶叶多糖提取得率增加了10%以上。随后多糖提取利率有缓慢降低的趋势,且不具有显著性差异(50~70目水平间p>0.05),可能是因为过小的颗粒导致其它成分的大量浸出从而阻碍多糖的提取[17],因此,选取50目颗粒大小的茶叶进行多糖的提取较为适宜。

图6 粉碎度对提取得率的影响Fig.6 Effect of powder degree on extraction yield of polysaccharide
2.1.7 乙醇浓度的影响 由于不同乙醇浓度的极性大小不同,茶叶多糖在不同乙醇浓度中的溶解度也不同[18],在50%~75%乙醇浓度范围内,茶叶多糖提取得率随乙醇浓度增加而增加,乙醇浓度大于75%时,则茶叶多糖提取得率逐渐减少,如图7所示,5种乙醇浓度中以75%浓度乙醇对茶叶多糖的沉淀效果最好,达到3.63%,相对于50%乙醇浓度,多糖的率具有极显著性差异(p<0.01),茶叶多糖提取得率增加了20%以上。
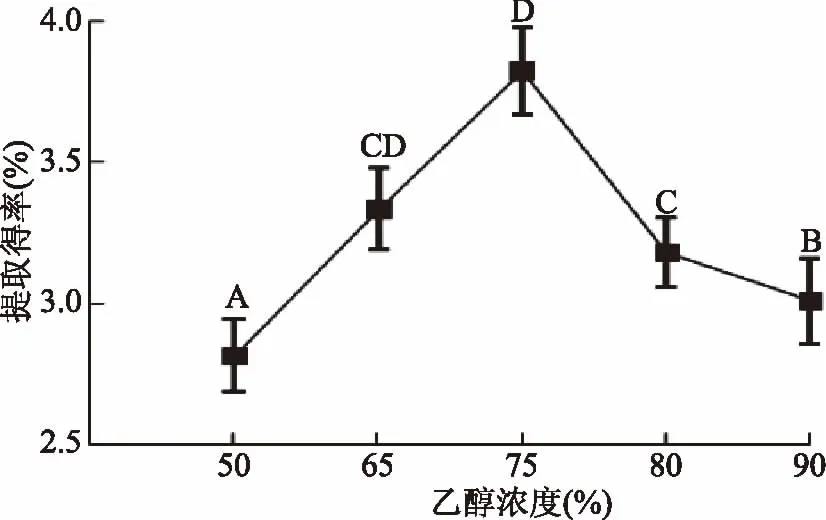
图7 乙醇浓度对提取得率的影响Fig.7 Effect of ethanol concentration on extraction yield of polysaccharide
2.1.8 贮藏期的影响 如图8所示,茶叶多糖提取得率随着茶叶贮藏期的延长,在第六个月时茶叶多糖提取得率达到最大值,之后茶叶多糖提取得率有下降趋势(p>0.05)。其原因可能是因为自身的呼吸消耗和微生物的消耗导致茶叶多糖减少[19]。因此,选择贮藏3~12个月的茶叶进行多糖的浸提效果较好。

图8 贮藏期对提取得率的影响Fig.8 Effect of storage time on extraction yield of polysaccharide
2.1.9 酶浓度的影响 茶叶多糖提取得率随着酶液浓度的增加有增加的趋势。如图9所示,低酶量时提取得率低,但随着酶量的增加,加大了与底物的结合面积,茶叶多糖提取得率明显提高,当酶量由1%增加到3%时,茶叶多糖提取得率有较大程度的提高(各水平间p<0.05),相对于1%酶量增加了34.6%,但由于酶量的饱和,后期随酶浓度的增加,茶叶多糖提取得率增加量趋于平稳[20]。考虑到实际生产的科学性,因此,选择4%左右的酶浓度较为合理。
2.1.10 酶反应时间的影响 茶叶多糖提取得率随着酶反应时间的增加有增加的趋势。如图10所示,在2.5 h酶反应时间内,随着时间的增加茶叶多糖提取得率有较大程度的升高,在这段时间内,底物与酶反应较为激烈,反应强度大;当酶反应时间达到2.5 h时,茶叶多糖提取得率有最大值,相对于酶反应1.0 h增加了46.7%;随酶反应时间的延长,反应较为彻底,茶叶多糖提取得率增加量趋于平稳[21]。考虑到生产效率等因素,超声提取2.5 h与2.0 h多糖得率具有显著性差异(p<0.05)。因此,选取2.5 h的酶反应时间较为合理。

图10 酶反应时间对提取得率的影响Fig.10 Effect of enzyme reaction time on extraction yield of polysaccharide
2.2 茶叶多糖提取单因素结果主成分分析
主成分分析有助于对多个单因素的综合考量,确定各因素在某一实验结果中所占据比例的大小,常用于各行业数据统计分析之中[22]。此次用于影响植物成分(茶叶多糖)提取得率方面的研究,以探讨各因素的关系与比重[23]。
2.2.1 主成分指标 选取在各单因素条件下茶叶多糖提取得率结果见表2。
2.2.2 数据标准化处理 利用SPSS 19.0进行多糖提取得率数据标准化分析,得标准化值,如表3所示。
表3 标准化值结果Table 3 The result of standard value
2.2.3 主要成分个数确定 通过SPSS软件共抽取了4个主成分,从表4可以看出,第一成分占据了88.947%的比重,第二个成分占据了10.270%的比重,其余占据的比重很小,已低于1%。
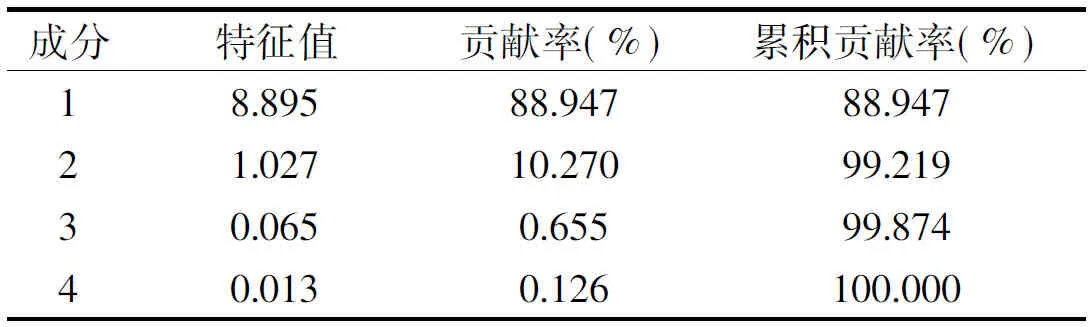
表4 特征值Table 4 The component matrix
从表5可以看出,第一主成分中,影响多糖提取得率相关性大小前四的单因素分别为:超声温度、提取次数、酶反应时间、超声功率,相关性越大对多糖提取得率的影响就越大。这4个单因素主要反映在实验处理的强度,实验强度越大,茶叶多糖提取得率越高。在第二主成分中溶剂浓度、粉碎度、贮藏期等相关性比较大。由于第一成分占据的比重最大,因此它对茶叶多糖提取得率的影响也就最大,其成分中各因素数字越大,对茶叶多糖提取得率的影响也就也大;因此选取上述第一主成分中主要因素进行正交试验。

表5 载荷矩阵Table 5 The load matrix
2.2.4 综合模型构建 采用SPSS软件对成分矩阵中相关数值进行数据规格化特征向量分析,得数据于表6。由于前两个主成分所占据比重很大,因此可由它们代替原有的10个单因素,构建成分与原来指标之间的表达式为:
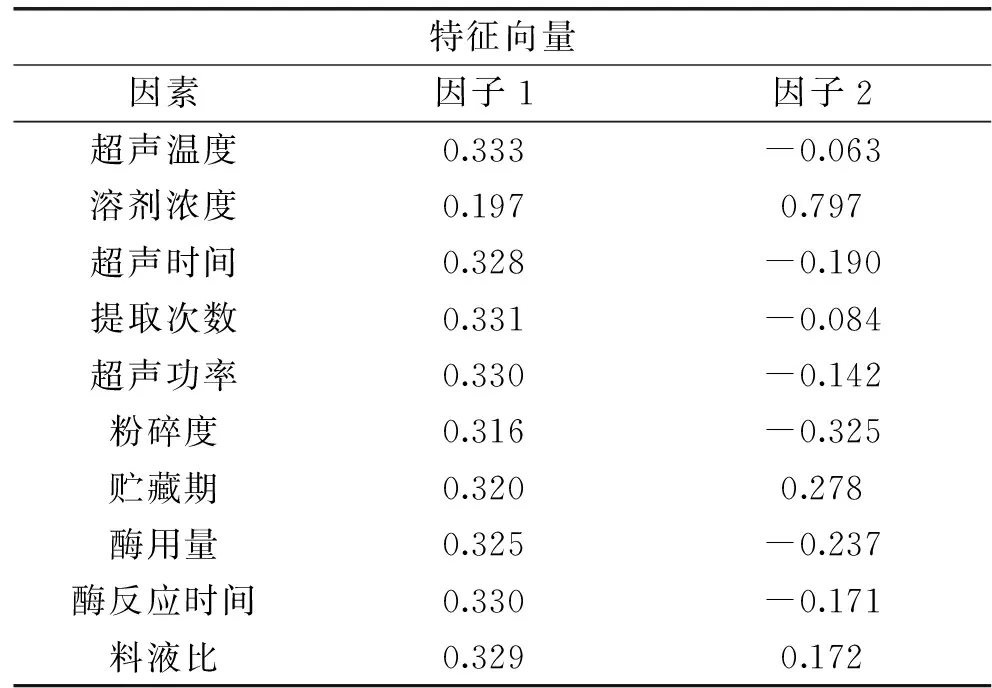
表6 规格化特征向量Table 6 The standardized eigenvector
f1=0.333X1+0.197X2+0.328X3+0.331X4+0.33X5+0.316X6+0.32X7+0.325X8+0.33X9+0.329X10
f2=-0.063X1+0.797X2-0.19X3-0.084X4-0.142X5-0.352X6+0.278X7-0.237X8-0.171X9+0.172X10
F=0.292X1+0.259X2+0.274X3+0.288X4+0.281X5+0.249X6+0.315X7+0.266X8+0.278X9+0.313X10

其中,A1和γ分别为成特征向量对应相关系数和特征值,X1~X10为标准化值,F为综合评价指标,计算得5个出综合评价值F,如表7所示。
由表7可知,成分f1呈现由升-降的趋势,这与综合评价值F大致相同。由于f1所占比重较大,在某种程度上已可以替代所有10个单因素。同时从主成分f1可以看出,影响茶叶多糖提取得率的因素随着各试验水平强度的加强,多糖提取得率也逐渐增加,当实验强度处于第4水平时,提取得率最高。成分f2在第3水平时多糖提取得率最高,由载荷矩阵可知,溶剂浓度的正相关值较高,达到了0.808,其次是贮藏期为0.278,这与茶叶多糖提取得率值的实际情况相符合。通过f1和f2得到综合评价值F,在第3~5试验水平的条件下,茶叶多糖的提取得率均有可能得到最大值,因此选择这3个水平的实验强度用于后续正交试验的分析。

表7 综合评价变量及F值Table 7 The variables of comprehensive evaluation and Fvalue
2.3 正交试验结果与验证
2.3.1 正交试验 选取表1中的试验条件及因素水平,同时其它各单因素选取较优条件。其正交试验结果见表8。正交试验最佳组合为A2B2C2D3,即85 ℃提取温度、1000 W超声功率、提取4次、酶反应3 h。考虑到茶叶多糖工业化生产的可行性和便捷操作性,选择提取次数3次较宜。
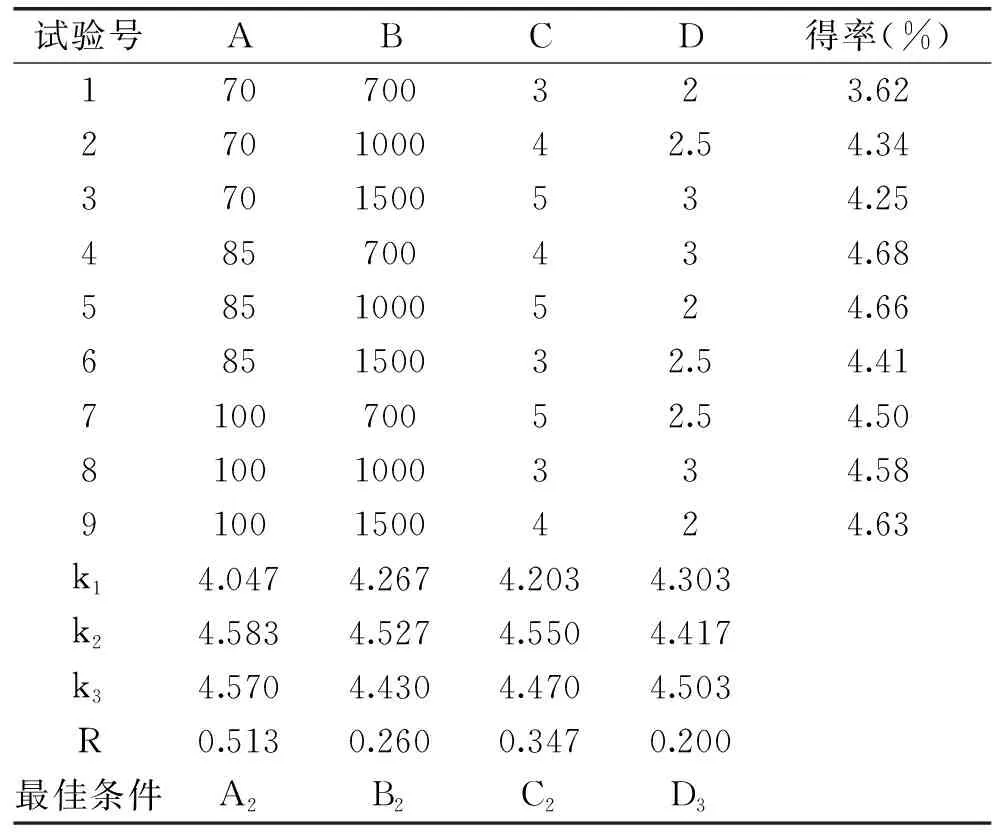
表8 正交试验结果Table 8 The results of orthogonal experiment
2.3.2 验证实验 采用上述所得工艺条件,结合其余六个较优单因素实验条件(6个月贮藏期、50目茶叶粉末、1∶40 g/mL料液比、4.0%酶浓度、2 h超声时间、75%乙醇沉淀)进行5次平行验证,最终得到茶叶多糖的平均提取得率为(5.01%±0.08%)。
3 结论
本文在10个单因素实验结果的基础上,通过主成分分析得出超声温度、超声时间、酶反应时间、料液比相对于其它单因素对茶叶多糖提取得率有较大的相关性,这说明各单因素对茶叶多糖提取得率的影响具有一定的差异性。同时得到茶叶多糖提取得率综合评价变量及F值,以此判定得出3、4、5阶段的实验强度对茶叶多糖的提取具有较大的影响,从而在很大程度上明确了各单因素不同实验强度对茶叶多糖提取得率的影响。主成分分析法相对单因素和正交试验来说,一方面了解各单因素对茶叶多糖提取得率的影响,另一方面避免了正交试验中对单因素选择的不科学性,得到影响茶叶多糖提取得率的最佳提取工艺A2B2C2D3,即酶反应3.0 h后于85 ℃下、1000 W超声提取,提取4次。对工艺的验证,此时多糖得率为(5.01%±0.08%)。利用酶-水超声提取技术、主成分分析和正交试验相结合很好地兼顾了茶叶多糖提取的时间和较高的得率,试验结论在一定程度上为后期茶叶多糖大规模工业化生产提供了依据。本实验通过10个单因素实验初步了解影响茶叶多糖提取得率的因素,但还可进一步深入研究。

