大豆过氧化物酶的提取与分离纯化研究
刘 力
(武汉华测检测技术有限公司食品实验室,湖北 武汉 430223)
1 引言
大豆过氧化物酶(POD)是从豆壳或大豆胚芽中提取的一种活性很高的过氧化物酶,是由单一肽链和卟琳构成的血红素蛋白,脱辅基蛋白分子需与血红素结合能构成全酶[1]。分子量为37000D,300多个氨基酸残基组成,等电点为3.9,是酸性蛋白质[2]。大豆POD酶由两个结构域组成,中间是血红素辅基,Kamal[3]等推出由77%的α-螺旋、16%的β-折叠和β-转角及其它结构组成其结构域。大豆过氧化物酶和辣根过氧化物酶的结构及作用机理有许多相似之处,都属于植物过氧化物酶超家族的Ⅲ类酶[4]。它们具有相似的三维折叠模式,氨基酸序列有57%的同源性,两者都含有1个色氨酸,2个Ca2+,4个二硫键和8个多糖。现在,对辣根过氧化物酶的研究较成熟,大豆过氧化物酶的研究甚少。
目前,国内对大豆过氧化物酶的研究还局限在提取分离方面,对酶的固定化和应用方面研究甚少。而国外的研究已经深入到酶的基因改造和分子修饰方面,对应用方面的研究也较多,主要在工业“三废”处理方面[14]。
2 材料与方法
2.1 实验材料与试剂
大豆(市售) 武汉市农产品大市场;愈创木酚溶液(分析纯) 天津市凯通化学试剂有限公司;BSA牛血清白蛋白(分析纯) 天津市凯通化学试剂有限公司;壳聚糖(分析纯) 天津市凯通化学试剂有限公司,其他试剂无特殊说明均为分析纯。
2.2 实验仪器
垂直平板电泳槽:上海亚荣生化仪器厂;热水合反应釜:上海青蒲沪西仪器厂;722E型紫外可见分光光度计 上海光谱仪器有限公司;756P型紫外可见分光光度计(配有sp756P紫外光谱工作站), 上海光谱仪器有限公司;KQ3200E型超声波清洗器:昆山市超声仪器有限公司。
3 实验方法
3.1 分析方法
3.1.1 酶活性的测定
本试验采用愈创木酚法测定过氧化物酶的活性。其原理是在有双氧水存在的条件下,以愈创木酚为底物,加入过氧化物酶后会将愈创木酚氧化成一种茶褐色物质,该物质在470 nrn处有最大吸收,通过测定茶褐色物质生成的量可以确定酶的活性,具体反应方程式如图1。
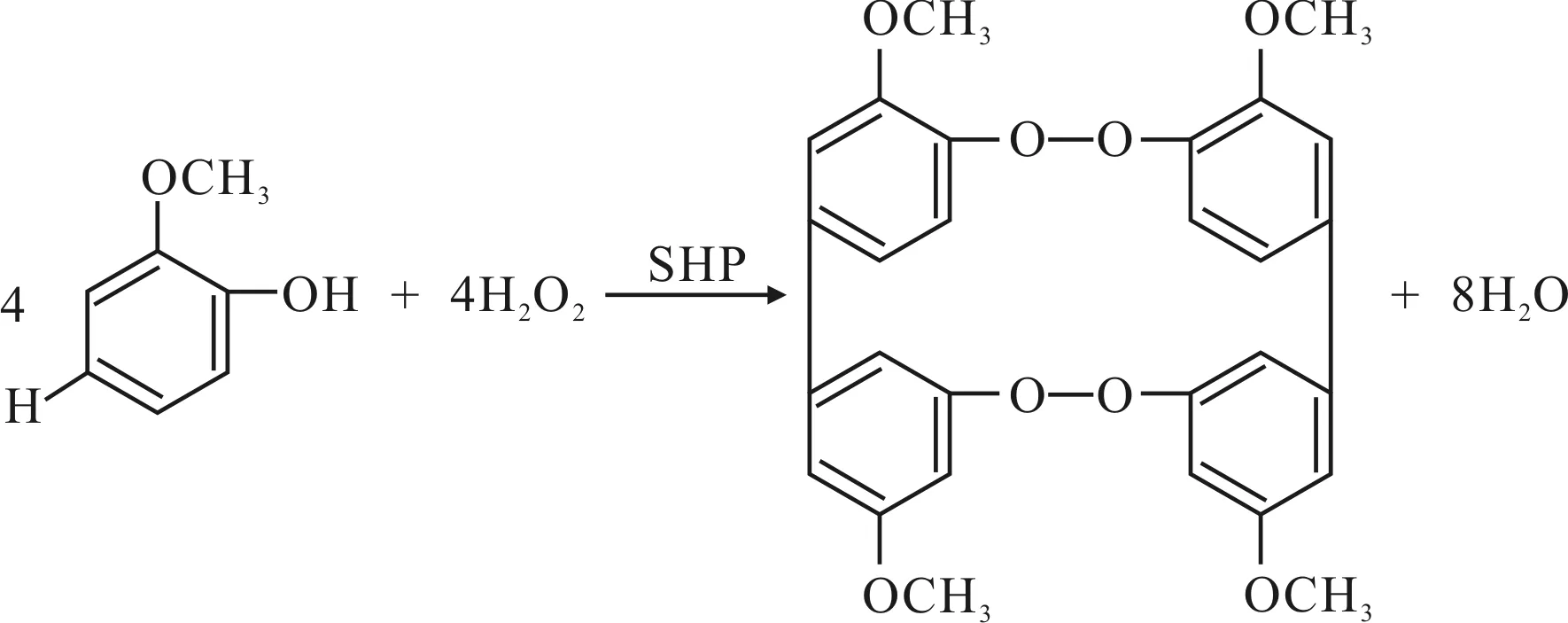
图1 愈创木酚法测酶活反应原理
酶的活力用酶的活力单位(Units)来表示。酶的活力单位是以每分钟转化1 μmol底物定义为1个活力单位。
在测定酶的活力前需要配制反应混合液。配制反应混合液需加入愈创木酚与3%过氧化氢(v/v=1∶1)3 mL,在加入50 μL酶液启动反应,用反应混合液不加酶作为空白对照,混合后摇匀,立即计时,在470 nm处测其吸光度值,读取第一个吸光值,60 s后读取第二个吸光值,有时反应速度比较快,或反应体系变化比较快,就采用每20 s读一次。按照下式计算酶的活性。
酶活力(U/mL)=

若要计算总酶活力只要再乘以酶液总体积就可以得到。
3.1.2 酶比活力的测定
酶的比活力(Units/mg)是指酶的活力值与酶蛋白含量(mg)的比值。酶的比活力可以用来表示酶的纯度。对于同一种酶比活力值越高其纯度越高。本试验采用考马斯亮蓝法测定酶的蛋白含量。
测定蛋白质还需绘制标准曲线,以牛血清蛋白为标准品来测定。将牛血清蛋白配制成0.1 mg/mL的标准溶液,分别用移液管移取0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL并置于6支试管中,然后向试管中依次加入1.0 mL、0.8 mL、0.6 mL、0.4 mL、0.2 mL、0.0 mL的蒸馏水,摇匀。后向每支试管中加入配制好的考马斯亮蓝G-250溶液5.0 mL,摇匀,静置15 min。第一个试管中空白溶液作为对照,在595 nm处测定其吸光度值,以蛋白浓度为横坐标,吸光度值为纵坐标,做出标准曲线。
取1 mL的待测酶液,加入5.0 mL考马斯亮蓝溶液后摇匀,静置15 min,在595 nm处测其吸光度值,根据标准曲线求得蛋白质的浓度,然后计算出蛋白的含量,最后求得酶的比活力。
3.1.4 酶Rz值的测定
酶的纯度可以用Rz值来表示,Rz值越高,酶纯度越高。通常Rz值达到2左右即表示高纯度酶。
Rz的计算公式:
式中:A403为血红素辅基的吸收值,A275为蛋白质的吸收值。
3.1.4 酶的结合效率
酶结合效率又称酶的固定化率,是指酶与载体结合的百分率,酶结合效率的计算一般由用于固定化的总酶活力减去未结合的酶活力所得的差值,在除以用于固定化的总酶活力得到:

未结合的酶活力,包括固定化后滤出固定化酶后的滤液以及洗涤固定化酶的洗涤液中所含的酶活力的总和。
充分混匀。分别移取上述苯酚标准溶液0.0 mL、1.0 mL、2.0 mL、3.0 mL、4.0 mL、5.0 mL于试管中,补水至10.00 mL,摇匀后,在最大吸收波长λ的条件下,以水为空白对照测其吸光度。以苯酚标准溶液浓度C(μg/mL)为横坐标,吸光度A为纵坐标绘制标准曲线。
3.2 过氧化物酶的提取、分离与纯化
3.2.1 过氧化物酶的提取
3.2.1.1 预处理
将市售黄豆按1∶1(v/v)的比例加蒸馏水,浸泡4~6h待黄豆充分溶胀后剥下大豆胚芽与种皮,沥干水分。将大豆胚芽4℃下冰箱保存,豆壳置于自然条件下风干或50 ℃烘箱下烘干,粉碎,过50目筛,得豆壳干粉。
3.2.1.2 提取流程
准确称取大豆胚芽10.00 g加入200 mL 4 ℃的0.2 M PBS缓冲液(pH=6.0),组织匀浆,超声功率为750 W,时间为41 min,提取温度为15 ℃,于4 ℃下8000 r/min离心15 min,收集上清液得酶粗提液A。
准确称取豆壳10.00 g加入200 mL的0.2 M PBS缓冲液(pH=6.0),超声功率为750 W,时间为41 min,提取温度为15 ℃,于4 ℃下8000 rpm离心15 min,收集上清液得酶粗提液B。
3.2.1.3 大豆不同部位POD酶含量比较
取上述两种不同部位提取的酶粗提液A、B,测定其酶活力、比活力、蛋白质浓度与Rz值。
3.2.2 过氧化物酶的分离与纯化
3.2.2.1 硫酸铵沉淀
在不断搅拌下每升上清液中慢慢加入240 g硫酸铵粉末(0.3~0.4饱和度),在1~2 h内加完后置冰箱中过夜,次日将上清液用虹吸管移出,下面混浊液用3000 r/min离心15 min,弃沉淀合并上清液,按每升上清液加256 g硫酸铵粉末(0.8饱和度)边加边搅拌,大约在1 h内加完,当硫酸铵全部溶解后置冰箱内于4 ℃下过夜,次日用虹吸管吸出上清液,沉淀部分用3000 r/min离心20 min,保留沉淀,悬浮于150 mL蒸馏水中,(使沉淀全部溶解为止),分装于透析袋(规格:分子量大于10000,下同),内4 ℃透析48 h以后有沉淀析出,4000 r/min离心15 min,得上清液。测定其酶活力、比活力、蛋白质浓度与Rz值。
3.2.2.2 丙酮沉淀
将上清液倒入烧杯中冰浴,加入-15 ℃的丙酮,4000 r/min离心15 min,得上清液,再加入0.8倍体积的-15 ℃的丙酮,离心后收集沉淀并溶于少量蒸馏水中,透析除去丙酮。测定其酶活力、比活力、蛋白质浓度与Rz值。
3.2.2.3 硫酸锌除杂
将沉淀稀释,滴加1 mol/L的硫酸锌溶液,离心后上清液透析除盐。测定其酶活力、比活力、蛋白质浓度与Rz值。
3.3.3 酶络合物电泳分析(SDS-PAGE)
将纯化后的POD酶进行SDS-聚丙烯酰胺凝胶电泳,考马斯亮蓝染色以确定POD酶的相对纯度。
4 结果与讨论
4.1 牛血清蛋蛋白质标准曲线的绘制
根据表的结果,绘制标准曲线如图2所示。
由图2可知,蛋白质含量测定的标准曲线方程为:y=0.0429x+0.0067,R2=0.9991,蛋白浓度在0 μg/mL~ 18 μg/mL的范围内线性关系良好。
4.2 不同部位提取的过氧化物酶
4.2.1 对酶比活力与Rz值的影响
采用超声辅助法提取大豆过氧化物酶,按照方法3.1.1检测酶特征指标,其中,豆壳POD的蛋白含量为38.68 mg,酶的活力为4476.42 U/mL,酶的比活力约为115.73 U/mg,此时豆壳POD的Rz值为0.15;大豆胚芽POD的蛋白含量为25.18 mg,酶的活力为7609.92 U/mL,酶的比活力约为302.27 U/mg,此时大豆胚芽POD的Rz值为0.19。

图2 牛血清白蛋白标准曲线
4.2.2 过氧化物酶含量比较
经超声辅助法提取大豆不同部位过氧化物酶,并对其POD多种特性指标进行比较,结果如表1所示,豆壳中POD酶活力仅为大豆胚芽中POD酶的58%,而同比大豆胚芽中蛋白含量比豆壳中蛋白含量下降12 mg/mL左右。此时,大豆胚芽中POD酶的比活力是豆壳中POD酶的比活力的2.61倍。
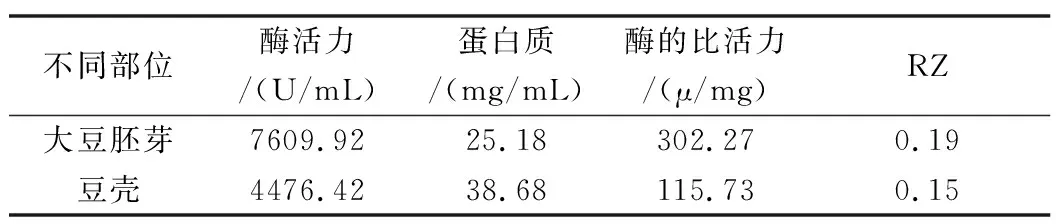
表1 大豆不同部位过氧化物酶特性指标比较
分析原因,可能是由于豆壳暴露在外,其POD失活较为迅速,而大豆胚芽位于种皮内部POD酶活力高,且大豆胚芽生长活力旺盛蛋白含量较豆壳略低,因此,较豆壳而言大豆胚芽为过氧化物酶提取的最佳原料。
4.3 POD酶分离纯化倍数的计算
纯化过程中纯化倍数如表2所示
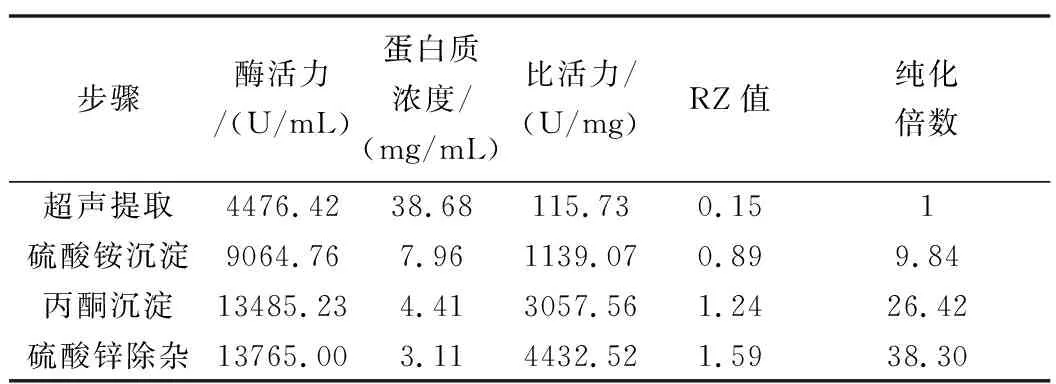
表2 酶纯化各步骤的参数计算
由表2可得,当仅用超声波提取得到的大豆过氧化物酶,其酶活力U/mL为4476.42 U/mL,比活力为:115.73 U/mg,,蛋白质浓度为:36.68 mg/mL ,RZ值为:0.15,纯化倍数为:1.00。而经过逐级纯化,其值逐渐发生变化,最终随着RZ值不断提高,纯化倍数也得到提高。
4.4 电泳分析结果
分别对大豆过氧化物酶、分子量标准样品、抗体和酶结合物严物进行电泳分析,得到结果如图3。

图3 SDS-PAGE电泳图
从图3 SDS-PAGE电泳图,可看出大豆POD酶在65~95 kb的地方出现明显的条带,可推断出大豆POD酶分子量大约在65kb和95kb之间。由于酶本身和酶与酶的结合物存在于酶提取液中,且可溶于50%饱和度的硫酸铵及其丙酮,因此在进行硫酸铵沉淀与丙酮沉淀中而将其去除,且在进行硫酸锌除杂的过程中,出去的是一些不溶于硫酸铵及其丙酮的杂蛋白。因此在反应产物电泳条带中没有出现杂条带,只出现了硫酸锌除杂后的条带,将其与Marker进行比较,可推断出分子质量,根据分子质量查相关书籍[16],可得出该酶是过氧化物酶。
5 结论
采用超声辅助法提取大豆不同部位的过氧化物酶,工艺条件为:超声功率750 W,提取温度15 ℃,提取时间41 min,同时对比豆壳与大豆胚芽中POD酶特性指标:豆壳中POD酶活力仅为大豆胚芽中POD酶的58%,而同比大豆胚芽中蛋白含量比豆壳中蛋白含量下降12 mg/mL左右。此时,大豆胚芽中POD酶的比活力是豆壳中POD酶的比活力的2.61倍。因此,较豆壳而言大豆胚芽为过氧化物酶提取的最佳原料。进一步对大豆过氧化物酶的分离纯化方法,采用硫酸铵分级沉淀、丙酮分级沉淀和硫酸锌除杂等方法,并对其提取工艺条件进行优化,结果如下:经硫酸铵沉淀、丙酮沉淀和硫酸锌除杂后,大豆POD酶活力13765.00 U/mL,蛋白质浓度3.11 mg/mL,酶的比活力4432.52 U/mg,Rz值1.59,且纯化倍数达38.30。同时,经SDS-PAGE电泳分析后,可推断出该大豆POD酶的分子量大约在65~95 kb之间,且只出现了一个条带,可看出纯化效果较好。

