利用4种方法对猪肉、牛肉、羊肉DNA进行提取比较*
杨 成 李 晶 徐 悦 郭露露 沈晓芳*
(江南大学食品学院,江苏无锡 214122)
肉类真实性鉴别是经济利益驱动型惨假(Economically Motivated Adulteration,EMA) 研究的主要内容之一。例如,自2013年欧洲“马肉丑闻”事件、中国“假羊肉”事件后,经济日报等媒体相继曝光了河间多个乡镇黑作坊将骡子肉、马肉、猪肉加工后冒充驴肉出售。然而,仅依靠视觉、嗅觉、触觉等感官手段鉴别肉的真伪,具有主观差异性、可靠性和科学性不高。
随着分子生物学技术的快速发展,研究者开始从分子水平对动物性成分进行鉴定。目前,对肉类成分的生物性鉴别方法主要包括基于蛋白的检测方法,如免疫学方法、酶联免疫法和生物质谱技术等;以及基于核酸的方法,主要包括利用PCR等技术对肉源性成分鉴别的方法。DNA检测法可为利用分子生物学技术对肉制品的种源、掺假性检测提供帮助。DNA检测的关键在于快速、简洁提取DNA。目前,动物源DNA的提取方法较少,主要有SDS法、CTAB法、异硫氰酸胍法、试剂盒法等。本文利用SDS法、CTAB法、改良氯化钠法和试剂盒法对猪肉、牛肉、羊肉中DNA进行提取,并对提取结果进行比较,为后续利用分子生物学技术开展深加工肉制品中动物源成分鉴别工作提供技术依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品材料
新鲜猪肉、牛肉、羊肉,采购于某大型超市。
1.1.2 试剂
SDS裂解液;醋酸钾溶液;NaCl;氯仿-异戊醇,体积比24∶1;无水乙醇;TE缓冲液;CTAB裂解液,源叶生物技术有限公司;Tris-饱和酚,源叶生物技术有限公司;β-巯基乙醇;EDTA;异丙醇,阿拉丁;蛋白酶K,质量浓度20mg/mL,阿拉丁;DNA提取试剂盒,Tiangen。
1.2 仪器与设备
涡旋混匀器,IKA VORTEX2;Centrifuge5810R型台式离心机,eppendorf;UV-3600 Plus型紫外可见分光光度计,SHIMADZU;T18 digital均质机,IKA。
1.3 DNA提取方法
1.3.1 样品前处理
称取10 g样品,加入4mLTE缓冲液混合后,在均质机中粉碎匀浆,-20℃保存,备用。
1.3.2 SDS法
参考高丹丹,陈燕等的研究,并进行适当修改。取0.5 g样品于15mL离心管中,加入7mL裂解液,并加入40μL 20mg/mL蛋白酶K;65℃下消化3 h~5 h至无明显组织块;加入700μL醋酸钾溶液,混匀,冰浴15min后,12 000 r/min、4℃、离心10min;取上清至新离心管中,加入等体积Tris-饱和酚,充分混匀,静置10min后,12 000 r/min、4℃、离心10min;取上清液至新离心管中,加0.5倍体积氯仿-异戊醇(体积比24∶1),充分混合后,12 000 r/min、4℃、离心10 min;重复上述步骤至两相中间无明显的变性蛋白质为止。将上清液转移至新的离心管中,加入两倍体积-20℃预冷的无水乙醇,轻轻摇晃至有絮状沉淀析出,12 000 r/min离心10min,弃去上清液;加入600μL体积浓度70%乙醇洗涤沉淀,12 000 r/min离心3 min,弃去上清液,重复上述步骤1~2次后,室温下静置使乙醇完全挥发;将DNA沉淀溶解于500μLTE缓冲溶液中,-20℃保存。
1.3.3 改良氯化钠法
参考 Burhanettin Yalɕ1nkaya.etal,并进行适当修改。取0.5 g样品于15mL离心管中,加入1mL TE缓冲液,8mL lysis缓冲液和0.8mL质量分数20%的SDS,置于涡旋混匀器上混合均匀;加入40μL 20mg/mL的蛋白酶K,混匀后65℃水浴1 h,加入6mL 5mol/L的NaCl溶液,于涡旋混匀器上混匀30 s,10 000 r/min离心30min,然后将其上清液转移至新的离心管中,加入等体积的异丙醇,上下颠倒混匀后,16 000 r/min离心20min,弃去上清液,将DNA沉淀溶解于1 mL TE缓冲溶液中,-20℃保存。
1.3.4 CTAB法
参考GB/T 21101-2005,并进行适当修改。取0.5 g样品于15 mL离心管中,12 000 r/min离心1min,弃去上清液,加入7mLCTAB裂解液和50μL β-巯基乙醇,60℃水浴30min;10 000 r/min离心15min,吸取上清液至新离心管中,加等体积的氯仿-异戊醇(体积比24∶1),12 000 r/min离心5min;重复上述步骤至两相中间无明显变性蛋白质出现。取上清液至新离心管中,加2.5倍体积的无水乙醇,混匀后冰浴20 min;12 000 r/min离心15 min,弃去上清液;体积浓度70%乙醇洗涤沉淀,12 000 r/min离心5min,弃上清,室温晾干;将DNA沉淀溶解于500μLTE缓冲溶液中,-20℃保存。
1.3.5 试剂盒提取法
按照试剂盒说明书操作进行。
2 结果与分析
2.1 4种方法提取样品DNA的浓度与纯度
用紫外分光光度法鉴定DNA的浓度与纯度:取10μL的DNA提取液稀释300倍,依次测定试验样品在230 nm、260 nm、280 nm波长下的吸光值,通过OD260/280计算各样品中的DNA纯度并计算DNA的浓度。DNA浓度计算公式如下:
DNA质量浓度(μg/mL)=50μg/mL×OD260×稀释数倍
OD260/280值在1.8以下表示有蛋白质污染,在2.0以上表示有RNA污染,在1.8左右表示DNA纯度较高。OD260/230在2.0以下表示可能有碳水化合物如糖类、盐类或有机溶剂等小分子污染物,若OD260/230高于2.0则说明无明显小分子污染。
2.1.1 4种方法提取样品DNA的纯度比较
4种方法提取样品DNA的纯度比较如下页图1。
由图1可知,对于牛肉、羊肉和猪肉,采用SDS法提取得到的DNA纯度相对于其他3种方法均相对较高,改良氯化钠法次之,CTAB法最差。使用SDS法时3种样品的OD260/280均在1.8-2.0范围内,且OD260/230均大于2.0;使用改良氯化钠法时3种样品的OD260/280均在1.8-2.0范围内,但从OD260/230来看,除羊肉外,另外两种样品受小分子物质污染略微严重;采用试剂盒法和CTAB法时所提DNA受蛋白质和RNA的影响均不大,但小分子物质的污染较严重。综上所述,用SDS法和改良氯化钠法提取的基因组DNA纯度均较高。
2.1.2 4种方法提取样品DNA的浓度比较
4种方法提取样品DNA的浓度比较如图2。
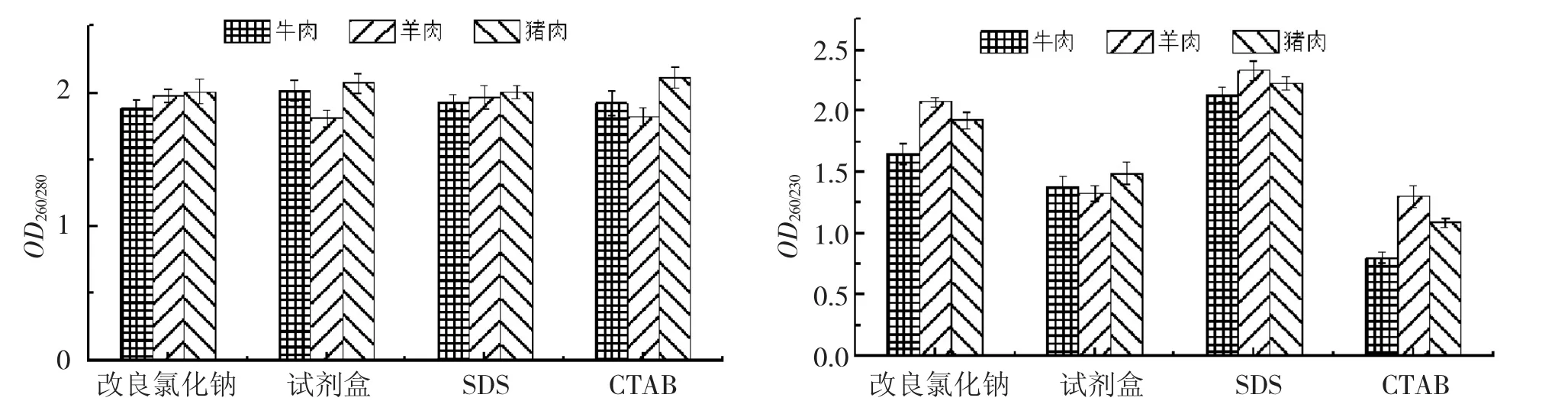
图1 改良氯化钠法、试剂盒法、SDS法和CTAB法提取牛肉、羊肉和猪肉DNA纯度的比较
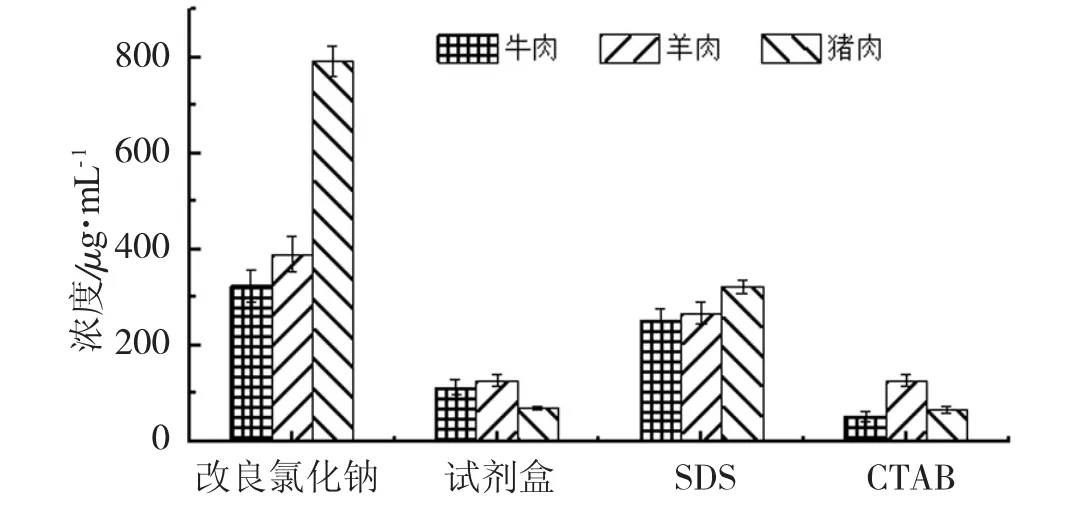
图2 改良氯化钠法、试剂盒法、SDS法和CTAB法提取牛肉、羊肉和猪肉DNA浓度的比较
由图2可知,改良氯化钠法提取得到的DNA浓度明显高于其他方法,SDS法次之,CTAB法效果最差。这主要是由于SDS(十二烷基硫酸钠)是一种阴离子去污剂,其可溶解膜蛋白而破坏细胞膜,使蛋白质变性而沉淀下来,且SDS可与小分子物质结合成复合物,EDTA可抑制DNA酶的活性,再加入氯化钠后,高浓度的盐可使蛋白质变性沉淀而析出,因此DNA得率较高。
2.1.3 4种提取方法所用时间
4种提取方法所用时间见表1。

表1 4种方法所用时间 min
2.2 琼脂糖凝胶电泳检测
图3为采用4种方法对牛肉的基因组DNA完整性琼脂糖凝胶电泳结果。其中,1~3为CTAB法;4~6为试剂盒法;7~9为 SDS法;10~12为改良氯化钠法。

图3 4种方法和CTAB法提取牛肉DNA的琼脂凝胶检测结果图
由图3可以得出,4种方法提取到的DNA都呈明亮均一的条带,泳道较为干净,没有拖尾现象,即均未发生降解,表明提取得到的基因组DNA完整性良好,且改良氯化钠法、SDS法提取的牛肉制品的基因组DNA条带更为清晰明亮,更完整。
3 结论
通过对4种方法提取得到DNA的纯度、浓度以及所用时间进行比较,发现对于猪肉、牛肉、羊肉这3种样品,不同提取方法得到的DNA浓度、纯度均存在比较明显的差异。采用改良氯化钠法和SDS法提取得到的DNA纯度均相对较高,但相比于改良氯化钠法,SDS法用时长;试剂盒法操作简单,但提取得到的浓度相对较低,且易受小分子物质的污染;CTAB法用时最短,但提取得到的DNA浓度和纯度均低于其他3种方法。

