胺鲜酯浸种对苗期糜子形态和叶片生理特性的影响
张盼盼,王小林,郭亚宁,严加坤,冯佰利,张雄*
(1.榆林学院生命科学学院,陕西 榆林 719000;2.西北农林科技大学农学院,陕西 杨凌 712100)
糜子(Panicummiliaceum)是起源于我国最古老的作物,具有生育期短、抗逆性强、耐贮藏等特点[1-2],是我国年降水量少、无霜期短的北方地区的主要粮食作物,也是我国北方家畜、家禽的主要饲草和饲料[3]。糜子籽粒、秕粒和秕糠混合磨成粉,是北方糜子产区畜禽的主要精饲料;糜草是内蒙古、陕北和晋西北大家畜的主要越冬饲草[4]。糜子营养丰富,在平衡膳食、促进人体健康方面具有独特的作用。但是目前在国内糜子栽培中还存在许多问题,例如生产水平提高缓慢,产量低而不稳,产品品质不高等,极大地限制了糜子主产区农业和畜牧业的发展,因此关于糜子高产栽培技术的研究显得尤为重要。
植物生长调节剂是一类与植物激素具有相似生理和生物学效应的物质,广泛地被应用于农业生产中[5],为保证粮食稳产、高产和作物高效栽培起到重要的作用[6]。胺鲜酯(diethyl aminoethyl hexanoate,DTA-6)是一类新型、广谱性植物生长促进剂,具有用量少、成本低、见效快、低毒、低残留、高效和安全等特性[7-9]。DTA-6还能提高植物体内过氧化物酶的活性和硝酸还原酶的活性[10],促进植物氮碳代谢,增加叶片叶绿素含量从而提高光合速率[11]。已有研究表明,DTA-6可显著提高玉米(Zeamays)、大豆(Glycinemax)等作物叶片光合作用,促进干物质积累[12-13]。冯亚楠[14]研究指出,浓度为25、50、100 mg·L-1的DTA-6浸种均可以增加垦农4和合丰25号大豆品种根干重、茎干重和子叶干重,其中50 mg·L-1DTA-6的调控效果最佳。张明才等[15]研究表明 DTA-6可显著增加花生(Arachishypogea)荚果和籽仁产量,表现在单株干物质增加,饱荚数、饱荚重和籽仁重显著提高,秕荚数显著减少;DTA-6对籽仁中含油量具有促进作用,而对游离氨基酸、蛋白质含量有降低的趋势;同时DTA-6提高了花生的根系活力和根系伤流量以及根系的吸收和合成能力,提高了花生的结瘤性和固氮能力。可见前人在DTA-6对作物形态和生理方面开展了大量的研究,然而,关于DTA-6对苗期糜子形态和叶片生理特性的研究尚未见相关报道。鉴于此,本试验以粘丰5号为供试材料,采用盆栽方式,在播种前分别以10、50、250 mg·L-13个浓度的DTA-6浸种,清水浸种作为对照(CK),分析不同浓度下的DTA-6对苗期糜子形态和叶片生理特性的影响,从而明确DTA-6对苗期糜子叶片光合特性的调控效应,为DTA-6应用于糜子高产高效栽培提供理论依据。
1 材料与方法
1.1 供试材料
供试糜子品种为黑龙江省主栽品种粘丰5号,由国家杂粮工程技术研究中心提供。50000 mg·L-1DTA-6母液由黑龙江八一农垦大学植物生长与化学调控实验室提供。
1.2 试验设计
试验于2015年7-8月在黑龙江省大庆市黑龙江八一农垦大学北操场玻璃温室大棚内进行。采用砂培育苗方式,用清水将江砂冲洗干净,晾至不滴水时装入黑色营养钵(高30 cm,直径30 cm),将处理好的种子打孔点播。盆栽试验设4个处理分别为:CK (清水)、D10(10 mg·L-1DTA-6)、D50(50 mg·L-1DTA-6)、D250(250 mg·L-1DTA-6),浸种前需准备4个锥形瓶,每个锥形瓶加入饱满一致的粘丰5号种子350粒,并将处理液分别加入4个锥形瓶中,每瓶加处理液50 mL,放置于黑暗条件下,然后置于恒温培养箱24 h,期间晃动锥形瓶2~3次,种子取出后阴干,进行点播,播种日期为7月12日,播深3 cm。每盆30粒,于出苗每盆定植20株,并排两行,采用完全随机试验设计,重复4次,共种植16盆,出苗定植后开始浇1/2 Hogland营养液,以后每3 d浇灌一次。于8月9日(分蘖期)开始各项指标的测定。
1.3 测定项目及方法
1.3.1株高和茎粗的测定 从每个处理中选取长势一致的5株糜子,用钢尺测量植株基部地面处至生长点的长度,即为株高(cm);同时,以游标卡尺(精密度 0.02 mm)测量主茎基部距地面1 cm处的直径,即为茎粗(mm)。
1.3.2幼苗干物质的测定 首先将营养钵放入装有水的大盆中,然后剪破营养钵,将糜子植株自距地面1 cm处剪取地上部分,然后将盆倒扣,清洗出糜子植株,从中选取长势一致的5株,带回实验室,将每株植株分解为叶、茎(带叶鞘)和地下部分,装入标有编号的牛皮纸袋中,在105 ℃下杀青30 min后,80 ℃下烘干至恒重。采用公式:根冠比=糜子地下部分干重/地上部分(叶和茎)干重。
1.3.3单株绿叶面积的测定 采用比叶重法,用孔径6 mm的单孔打孔器分别从距叶梢和叶柄2 cm处开始顺次打孔,每片叶片共打孔1次,并注意要避开中心叶脉和已经枯萎的叶片部位,计数打下的圆形叶片并装入纸袋烘干(75 ℃下烘48 h)、称重(W1,单位:g);并将打孔后的叶片装入纸袋烘干、称重(W2,单位:g)。每个处理测定5株,计算公式为:
单株叶面积(cm2)=(W1+W2)×打孔数×πr2×10-2/W1
式中:r为打孔器的半径,此处为3 mm。
1.3.4光合特性的测定 于上午9:00-11:00,选择生长一致的糜子顶部往下第2片完全展开叶,采用美国CID公司的CID 340便携式光合测定仪测定叶片的净光合速率Pn、气孔导度Gs、蒸腾速率Tr及胞间CO2浓度Ci。每个处理测定4株。测定时,温度恒定在28~35 ℃,大气CO2浓度保持在430~530 ppm,相对湿度为70%~80%,光合有效辐射为800~1600 μmol·m-2·s-1。
1.3.5叶片碳水化合物含量的测定 于上午8:00取样,在每个处理中剪取主茎倒二叶5片,擦净叶片上的尘土和污物,迅速放于装有液氮的冰壶中,带回实验室,贮存于-40 ℃超低温冰柜中,待取样结束后,统一测定。蔗糖、果糖含量测定参照张志良[16]的方法,可溶性糖和淀粉含量测定参照王晶英[17]的方法。
1.4 数据分析
采用Microsoft Excel 2010进行数据录入、整理,采用SPSS 19.0(IBM,2010)对数据进行方差分析及多重比较,采用Origin 9.0进行作图。
2 结果与分析
2.1 不同浓度DTA-6浸种对糜子株高和茎粗的影响
由图1可以看出,不同处理下分蘖期糜子幼苗株高表现不同,表现为D250>D50>D10>CK,与CK相比,D10、D50、D250分别提高5.41%、28.08%、50.64%;方差分析表明,D50、D250与CK之间的差异均达显著水平(P<0.05),说明高浓度对株高促进作用明显;D250与D50之间存在显著差异,D10与CK之间无显著差异,说明DTA-6浓度较低时,对株高促进效果不明显。
不同处理下糜子分蘖期幼苗茎粗D50处理下的为最大;与CK相比, DTA-6浸种对糜子幼苗茎粗都有一定的提高作用,D10、D50、D250处理下糜子幼苗茎粗分别较CK提高17.50%、54.18%、31.47%;方差分析表明,D10与CK无显著差异,说明低浓度促进效果不明显;其中D50、D250与CK之间均存在显著差异(P<0.05)。
2.2 不同浓度DTA-6浸种对糜子幼苗各器官干重和根冠比的影响
如表1所示,与CK相比,DTA-6处理对糜子幼苗叶干重、茎干重和根干重均有促进效果,并且随着浓度的升高,增加幅度越高。叶干重在D10、D50、D250处理下分别较CK增加了0.06、0.56、0.99 g·株-1,茎干重分别增加了0.04、0.42、0.54 g·株-1,根干重分别增加0.03、0.09、0.09 g·株-1。方差分析表明,D50、D250处理下的叶干重、茎干重、根干重均与CK之间的差异达显著水平(P<0.05)。糜子幼苗根冠比在不同处理下以D10为最大,其次为CK,最后为D50和D250,即随着DTA-6浓度的增大,糜子根冠比呈降低趋势。方差分析表明,CK与D10之间无显著差异,说明低浓度时DTA-6对根冠比虽然有增加效果,但不显著;与CK相比,D50和D250分别降低10%、20%,说明高浓度的DTA-6降低糜子根冠比。
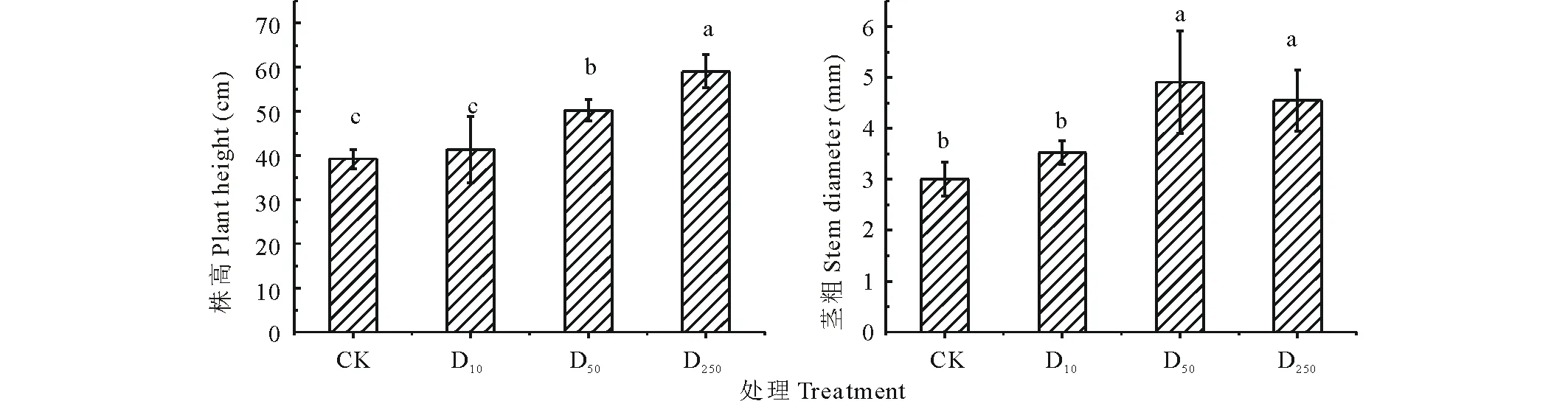
图1 不同浓度DTA-6浸种对糜子幼苗株高和茎粗的影响Fig.1 Effects of different concentration DTA-6 on plant height and stem diameter in proso millet seedings 不同小写字母表示不同处理差异显著(P<0.05),误差棒表示标准差。CK、D10、D50、D250分别代表清水、10、50、250 mg·L-1 DTA-6。下同。Different letters indicate a significant difference at P<0.05 among different treatments; Error bars mean±SD. CK: water; D10: 10 mg·L-1 DTA-6; D50: 50 mg·L-1 DTA-6; D250: 250 mg·L-1 DTA-6. The same below.

处理Treatment叶干重Leaf dry weight (g·plant-1) 茎干重Stem dry weight (g·plant-1)根干重Root dry weight (g·plant-1)根冠比Root/shoot ratioCK0.36±0.05c0.35±0.02c0.07±0.01b0.10±0.01abD100.42±0.03c0.39±0.03c0.10±0.01b0.12±0.01aD500.92±0.04b0.77±0.05b0.15±0.03a0.09±0.02bcD2501.35±0.29a0.93±0.02a0.16±0.02a0.07±0.01c
注:表中数据为平均数±标准差。同列不同字母表示差异显著(P<0.05)。下同。
Note: The date is expressed as mean±SD. Different small letters in the same column indicate significant differences at theP<0.05 level. The same below.
2.3 不同浓度DTA-6浸种对糜子单株绿叶面积的影响

图2 不同浓度DTA-6浸种对糜子幼苗 单株绿叶面积的影响Fig.2 Effects of different concentration DTA-6 on leaf area per plant in proso millet seedings
由图2可知,不同浓度DTA-6处理下的糜子单株绿叶面积表现不同。随着DTA-6浓度的增长,糜子单株绿叶面积不断增长,在D250处理下糜子的单株绿叶面积最大,并且不同浓度DTA-6处理的糜子单株绿叶面积与CK之间均存在显著差异(P<0.05)。D250处理下的糜子单株绿叶面积较CK、D10、D50高71.78%、67.64%、27.14%。
2.4 不同浓度DTA-6浸种对糜子叶片光合特性的影响
由图3可知,不同浓度DTA-6处理糜子幼苗叶片净光合速率表现不同,其中D10处理糜子叶片净光合速率较CK略有降低,而D50、D250糜子叶片净光合速率较CK均有增加作用,并且D50处理糜子叶片净光合速率与CK、D10、D250处理之间存在显著差异(P<0.05)。D50处理下的糜子净光合速率分别较CK、D10、D250高17.97%、19.15%、12.49%。糜子叶片蒸腾速率在不同处理下表现为D250>D10>D50>CK,说明DTA-6能够提高糜子叶片蒸腾速率,但各处理间差异不显著。糜子叶片气孔导度和胞间CO2浓度在不同处理下表现相同,均为D250>D50>D10>CK;3种浓度DTA-6处理叶片气孔导度均与CK之间存在显著差异(P<0.05),胞间CO2浓度在D10与CK之间无显著差异,在D50、D250与CK之间均存在显著差异(P<0.05)。

图3 不同浓度DTA-6浸种对糜子幼苗叶片光合特性的影响Fig.3 Effects of different concentration DTA-6 on leaf photosynthetic characteristics in proso millet seedings

图4 不同浓度DTA-6浸种对糜子幼苗叶片碳水化合物含量的影响Fig.4 Effects of different concentration DTA-6 on leaf carbohydrate content in proso millet seedings
2.5 不同浓度DTA-6浸种对糜子叶片碳水化合物积累的影响
如图4所示,3种浓度DTA-6浸种处理下糜子叶片蔗糖含量均高于CK,并且与CK之间差异均达显著水平(P<0.05);D50处理下叶片蔗糖含量显著高于D10、D250;叶片蔗糖含量在CK处理下分别较D10、D50、D250低34.19%、43.18%、28.86%。可溶性糖含量和果糖含量在各处理下表现为CK最大,其次为D250、D50,最后为D10;方差分析表明,CK下的可溶性糖含量与D10、D50之间均存在显著差异(P<0.05),而CK下的果糖含量与D10、D50、D250之间均存在显著差异(P<0.05)。糜子叶片淀粉含量在不同处理下表现为D10>D250>CK>D50,除D10与D50之间的差异达显著水平外(P<0.05),其他各处理之间无显著性差异。
3 讨论
株高和茎粗是衡量植株株型的两个最基本指标,株高适度、茎秆粗壮有利于维持高效的养料供应和抗逆性,防止倒伏。高源等[18]研究指出,喷施DTA-6均可增加不同种植密度下夏玉米茎秆粗度。本研究表明,糜子种子经DTA-6浸种处理后,株高增加,茎秆增粗;在试验设置浓度范围内,作用效果随着DTA-6浓度的增加基本呈增加趋势,株高在250 mg·L-1处理下最大,茎粗在50 mg·L-1处理下最大。
生物量在一定程度上可以反映幼苗素质的好坏。本研究表明,DTA-6浸种处理可以增加糜子幼苗叶干重、茎干重和地下干重,并且随着浓度的增加,效果越显著,这与冯亚楠[14]在大豆的研究结果一致。孔祥森[19]研究表明,1.0~20.0 mg·L-1DTA-6浸泡水稻(Oryzasativa)种子24 h能够增加播后15 d水稻幼苗的根冠比。本研究也指出,糜子幼苗根冠比在10 mg·L-1DTA-6处理下高于对照,而在50~250 mg·L-1DTA-6下显著低于对照,说明DTA-6浓度较高时对地上部干重增加效果优于地下部干重。
化学调控不仅能够实现对作物的外部形态特征进行调控,同时可以影响作物的内部生理特性[20]。绿叶是光合作用的载体,单位面积上绿叶面积的多少是植物光能利用效率的重要标志[21]。本研究结果表明,随着DTA-6浸种浓度的增高,苗期糜子单株绿叶面积也随之增高,说明DTA-6在一定程度上能够扩大源器官进行光合作用的面积。3种浓度DTA-6浸种均能够提高糜子叶片光合特性,这与Qi等[22]在玉米、大豆幼苗上的研究结果一致,进一步研究表明50 mg·L-1DTA-6处理下糜子叶片净光合速率显著高于其他处理,叶片蒸腾速率在各处理间差异不显著;而叶片气孔导度和胞间CO2浓度均随着DTA-6浓度的升高而增加,即在250 mg·L-1DTA-6处理下达到最高;当DTA-6浸种浓度为10~50 mg·L-1时,糜子叶片净光合速率与气孔导度、胞间CO2浓度呈正相关关系,浓度为50~250 mg·L-1时,则呈负相关关系,说明DTA-6浸种浓度在一定范围内引起糜子叶片光合作用的增强可能是因为气孔张开程度扩大,有利于CO2浓度增大,能够为光合作用提供充足的原料。
碳水化合物是植物的基础代谢之一[23]。在植物体内,蔗糖是碳水化合物运输的主要形式,并且是光合作用的最初产物之一,在叶片中蔗糖含量的多少可以反映叶片对光合产物的合成能力[24],本研究指出,DTA-6浸种处理增加了糜子叶片蔗糖含量,均与CK之间达显著水平,其中以50 mg·L-1DTA-6处理下的最高,这与叶片净光合速率变化相一致。蔗糖水解后可生成果糖和葡萄糖[25]。本研究表明,DTA-6处理的糜子叶片可溶性糖含量和果糖含量显著低于CK,说明糜子叶片蔗糖的分解较少用于自身物质合成,更多的蔗糖用于外运,从而促进糜子根系和茎秆的生长。淀粉是主要的能量贮存物质,其合成依赖于蔗糖的供应,在作物植株发育过程中可转变为可溶性糖,对以后的生殖有积极作用[26]。刘春娟等[10]研究表明,叶面喷施DTA-6可促进大豆叶片中淀粉积累,而本研究中糜子叶片淀粉含量在3个浓度DTA-6中表现不一致,10、250 mg·L-1DTA-6提高了叶片淀粉含量,50 mg·L-1DTA-6降低了叶片淀粉含量,认为造成这种差异的原因在于不同浓度DTA-6对糜子叶片中蔗糖磷酸合成酶和淀粉酶调控效果不同[27]。关于DTA-6浸种对糜子叶片糖代谢相关酶的影响有待于进一步研究。
4 结论
不同浓度DTA-6浸种能够有效调控糜子叶片光合特性,提高叶片蔗糖含量,从而促进糜子植株健壮生长。在生产实践中,推荐以50 mg·L-1DTA-6对糜子进行浸种处理。

