Cu催化剂的络合完全液相制备及催化性能研究
喻仕瑞,黄 伟
(1.茅台学院,贵州 仁怀 564500;2.太原理工大学煤科学与技术省部共建重点实验室,山西 太原 030024)
文献[1,2]报道了多相催化剂在制备过程中添加络合剂,性能改良较好。Cu2+的价电子层有9个d电子,占据着5个d轨道,4s和4p为4个空轨道,可供配位络合成键。dsp2杂化的4个空轨道可与不同的配位原子如N和O原子的孤对电子形成N-Cu或O-Cu配位键。Orel等[3]报道用多元醇制备不同形貌的Cu2O;Ning等[4]用草酸制备CuZnAl催化剂,提高了催化剂表面积、催化剂颗粒较小,得到了高活性和高甲醇选择性的催化剂;Barroso等[5]用柠檬酸制备CuZnAl催化剂具有热稳定性好的结构,ZnO的形态从晶体转换成无定形态;Ji等[6]用没食子酸作络合剂得到催化剂活性高,比表面积大。本文选用不同有机酸络合制备CuZnAl催化剂前躯体,采用液相热处理制备催化剂,并对CO加氢、物相、表面性质及其催化性能的关系进行考察。
1 实验部分
1.1 原材料
没食子酸 (Pyrogallic Acid),异名:焦倍酸、连苯三酚、焦倍酚;化学名:1,2,3-三羟基苯;分子式(Formula):C6H6O3;与铜、金、铁等生成络合物;柠檬酸(Citric acid),分子量:192.12,分子式为 C6H8O7,化学式:HOOCCH2C(OH)(COOH)CH2COOH。柠檬酸与Cu2+和Zn2+的络合常数分别为 1018与1011.4;L-酒石酸,英文名称 L(+)-Tartaric acid;别名 2,3-Dihydroxy butanedioic acid;分子式:C4H6O6,是一种柔性多齿配体;乙二胺四乙酸简称EDTA,分子式:C10H16N2O8,有六个配位原子,与Cu2+形成络合物。
1.2 催化剂制备
将分析天平称量好的已磨细的异丙醇铝(AIP)溶于80℃含有表面活性剂 (质量为AIP的2.3%)的蒸馏水中,置于500mL三口烧瓶中在80℃水解1.5h。然后升温到95℃,加入体积分数2%硝酸溶液(m(HNO3):m(H2O)=1:1),在 95℃回流搅拌 2h,得到铝溶胶。将溶解好的58.7g Cu(NO3)2·3H2O和36.2g Zn(NO3)2·6H2O的乙醇溶液加入0.018mol络合剂,搅拌溶解12h,缓慢滴加到铝溶胶中,继续在95℃回流搅拌8h。而后把CuZnAl溶胶置入烧杯,放置室温老化10天,形成具有一定骨架的凝胶。将凝胶搅拌、均匀分散在300mL医用液体石蜡中,加入0.5%质量分数的乳化剂。石蜡悬浮液在常压、N2气氛和机械搅拌下,以5℃/min程序升温到预设计温度,热分解温度下保持8h,之后冷却即得到浆状Cu基催化剂。为方便表达,络合完全液相法催化剂用英文首字母代表:没食子酸作络合剂用C-PA;柠檬酸用C-CA;酒石酸用C-TA;二胺四乙酸用CEDTA。
1.3 催化剂性能测试
催化性能评价在500mL浆态反应釜中进行,以CO与H2为原料,产物中的气体经在线色谱分析,冷凝器中液体产物由针型阀进入常压气液分离器收集,定时计量分析。
1.4 催化剂表征
催化剂抽提洗净、干燥、在玛瑙中研磨成粉末。XRD在日本理学Rigakud/Max-2500型衍射仪上进行;H2-TPR在天津先权TP-5000型多用吸附仪上进行,用20mg Ag2O还原耗氢量作外标定量基准;NH3-TPD在TP-5000型多用吸附仪进行,配备HIDEN QIC-20型质谱检测器,采集m/z比为17的NH3脱附曲线,外标法用0.5mL NH3作基准定量;CO2-TPD表征程序与NH3-TPD相同,采集m/z比为44的CO2脱附曲线,外标法用0.5 mL CO2作基准进行定量。
2 结果与讨论
2.1 催化性能测试
图1~6给出了络合液相法制备催化剂的产物分布与活性随反应时间的变化关系。CuZnAl催化剂选择性通常甲醇最高,乙醇小于1%,而络合液相法CuZnAl催化剂最大0的不同是乙醇选择性提高,其中C-PA乙醇选择性最高达11.1%,烃类选择性低,CO转化率高达45.0%,稳定性好;C-TA乙醇选择性较好,为4.7%,CO转化率仅为10.9%,易失活;CCA与C-EDTA乙醇选择性都低,烃类选择性高。这些差异源自各种络合剂的官能团不一样,络合剂中的羟基(-OH)与羧基(-COOH)对于络合反应十分重要,羟基与羧基中的双氧键容易形成较强的氢键(-O-H-O),且羧基中羟基上的氢容易脱去,脱氢后的羟基氧与金属离子形成络合物(-O-M-),造成催化剂组分间相互作用有别,进而影响表面性质和催化性能。
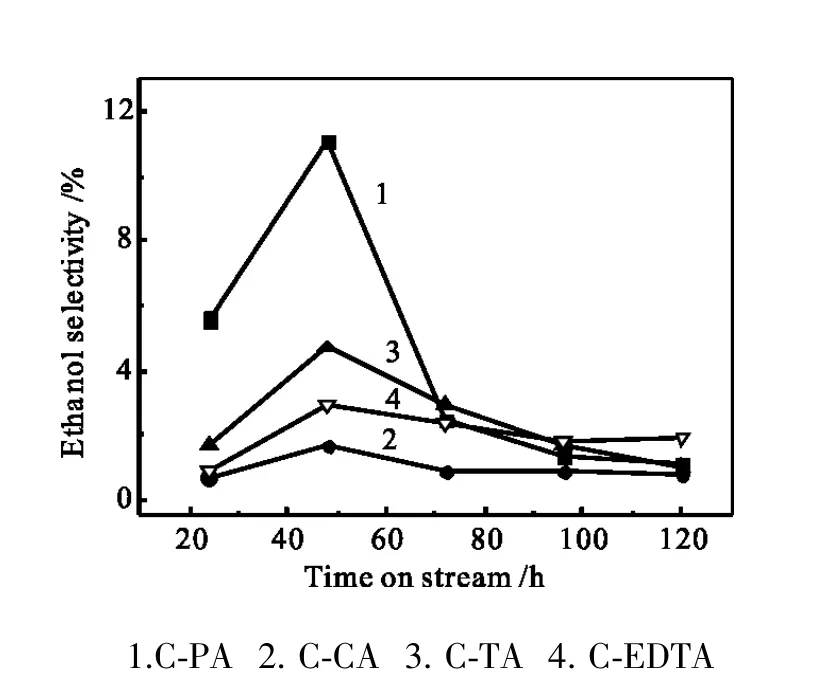
图1 乙醇选择性随反应时间的变化Fig.1 Ethanol selectivity vs reaction time
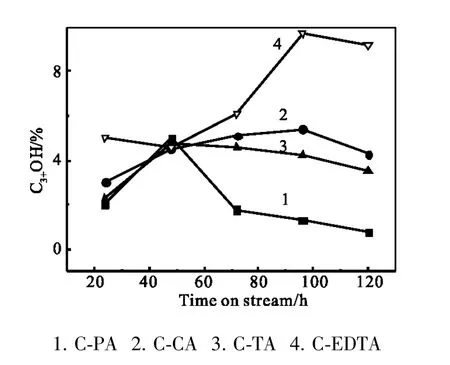
图2 C3+OH选择性随反应时间的变化Fig.2 C3+OH selectivity vs reaction time
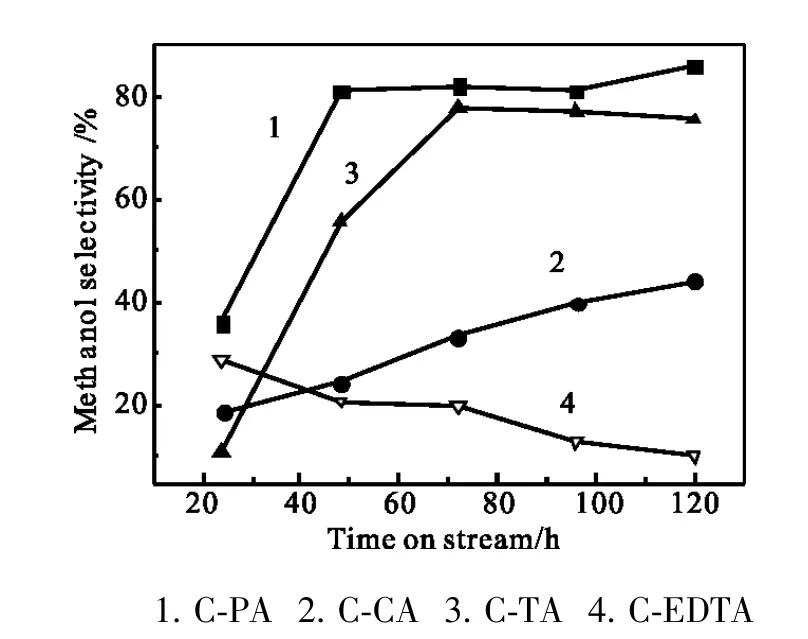
图3 甲醇选择性随反应时间的变化Fig.3 Methanol selectivity vs reaction time
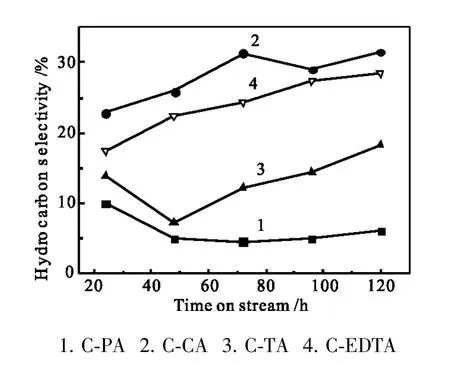
图4 烃选择性随反应时间的变化Fig.4 Hydrocarbon selectivity vs reaction time
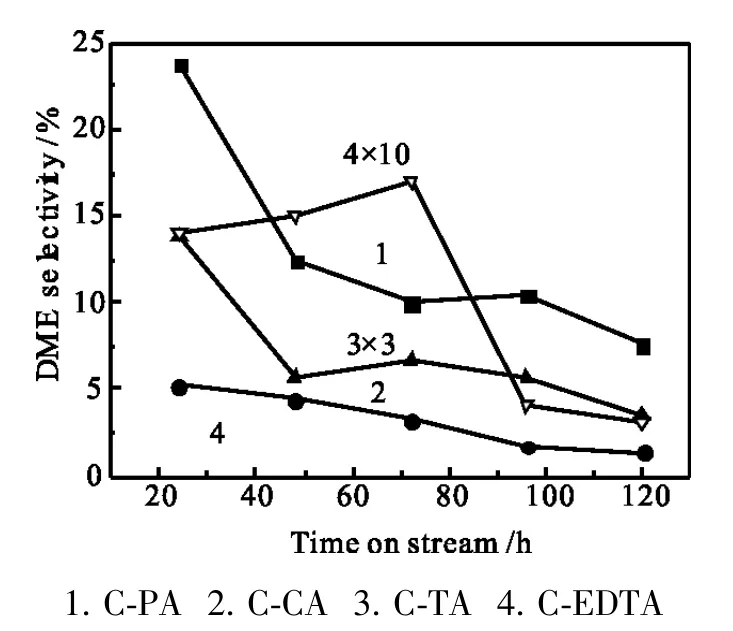
图5 二甲醚选择性随反应时间的变化Fig.5 DME selectivity vs reaction time
2.2 XRD表征
图7中XRD衍射峰揭示了催化剂中物相种类。C-PA只有Cu2O的衍射峰,且较弥散;ZnO无定形态存在;其它三个催化剂则是Cu0、ZnO和Cu2O物相共存。XRD衍射峰用谢乐方程计算晶体粒径大小,结果见表1。结合催化产物分析,小颗粒Cu2O存在利于乙醇形成,抑制烃选择性。C-PA经过诱导期后乙醇选性高达11.1%,但较快下降到1.0%;而对应的甲醇选择性则从36.0%升到85.9%。为认识产物变化与催化剂物相变化,将反应前后C-PA进行XRD对比图谱列在图8,对应尺寸计算见表1。图表显示,反应前主体物相仅有Cu2O峰,晶粒为12.6nm,反应后C-PA无Cu2O衍射峰,取而代之的是金属Cu0,粒径为25.0nm,ZnO相由反应前的无定形转变成晶体ZnO,晶粒为19.1nm。

图6 CO转化率随反应时间的变化Fig.6 CO conversion vs reaction time
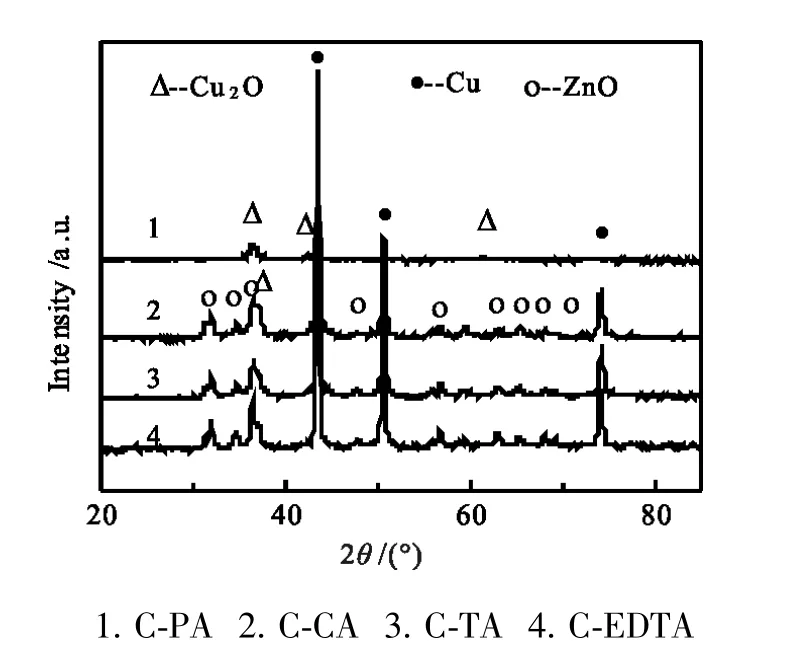
图7 不同催化剂的XRD谱图Fig.7 XRD patterns of different catalysts
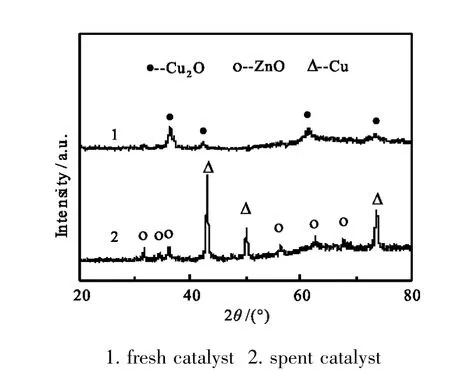
图8 C-PA反应前后XRD谱图Fig.8 XRD patterns of C-PA catalyst

表1 谢乐方程晶体粒径大小 单位:nmTable 1 Crystal sizes of different catalysts(nm)
2.3 TPR表征
催化剂TPR谱如图9,反应前催化剂还原峰温从246到296℃不等,还原峰耗氢量见表2。其中CPA还原峰为双峰,在高于CO加氢反应温度的387℃处有1个凸起的小峰;耗氢量为1.1×10-4mol。结合产物分布,表明乙醇形成与铜氧化物有关,CPA氢耗量显示有部分金属铜存在。因此推测,CO加氢反应存在有难还原铜氧化物与Cu0协同作用,可生成乙醇;结合XRD分析,这一铜氧化物很可能是Cu+化合物。因为铜处于元素周期表的ⅠB族的过渡金属原子,外层电子构型为3d104s1,次外层(n-1)d轨道虽然刚填满电子,但不太稳定。(n-1)d轨道与ns和np轨道能级接近,(n-1)d轨道上的电子可参与成键或失去,容易组成含d、s、p轨道的杂化轨道。因此,铜络合能力较强,能与许多配体形成络合物。Cu(II)简单配合物,大多情况下不如相应的Cu(I)配合物稳定[7-9]。

图9 不同有机酸络合剂催化剂TPR谱图Fig.9 TPR profiles of different catalysts

图10 C-PA反应前后的TPR谱图Fig.10 TPR profiles of fresh and spent C-PA
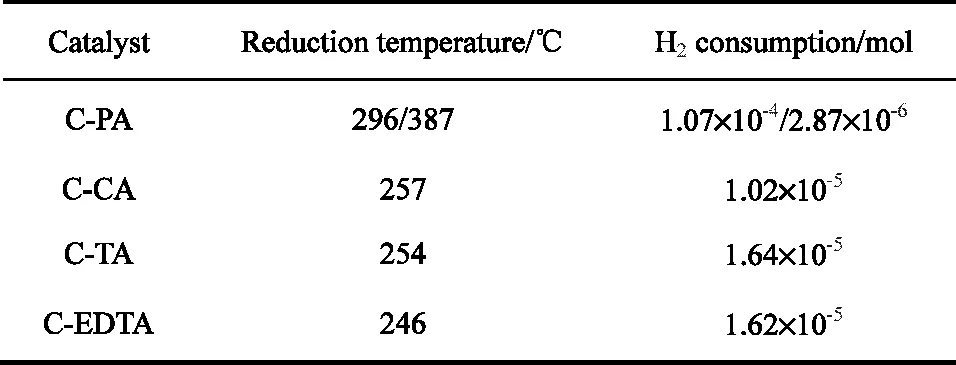
表2 催化剂H2-TPR耗氢量Table 2 H2consumption of catalysts in H2-TPR

表3 C-PA催化剂H2-TPR耗氢量表Table 3 H2consumption of C-PA in H2-TPR
为进一步理解C-PA在反应过程中的变化,对反应后的C-PA作了TPR表征,结果见图10,耗氢量见表3。反应前后的TPR显示,反应前双峰的还原峰温较反应后的高,特别是反应前还原峰温在387℃的铜氧化物在CO加氢反应中也被还原了,这说明催化剂在合成气气氛中不稳定,组分结构与晶相结构发生了改变,而这一改变正好对应于乙醇选择性的急剧改变,即从起始的11.1%快速降到1.0%,对应的是甲醇选择性从36.0%上升到85.9%。由此认为,难以还原的Cu+氧化物对乙醇合成是必要的,活性中心很有可能为Cu+-Cu0,甲醇活性中心为Cu0。
2.4 NH3-TPD表征
NH3-TPD曲线如图11所示,对应的酸量见表4。从图表可以看出C-PA有3个明显的峰,其中峰位在163℃,对应于弱酸位的峰面积大,弱酸量为1.69×10-9mol;其它三个催化剂都只有2个脱附峰,其中C-CA、C-TA和C-EDTA的弱酸量分别为2.52×10-10、9.61×10-11和 7.48×10-11mol,比 C-PA 小很多,CPA的DME选择性高达13.4%,CuZnAl催化剂表面弱酸位是DME的活性位[10],DME选择性与弱酸量呈顺变关系,与文献[10]研究一致。另外,C-PA的中强酸位的峰温分别在381℃和451℃,其它三个催化剂的脱附峰温则在476℃,酸强度较C-PA的稍强,说明金属氧化物组分间或者与载体之间作用情况不一样。这可能与络合剂的络合能力与络合物的热稳定性有关。由于与C-PA中金属离子相连接的是与苯环相连的-OH,而其它三个催化剂是羧基上的-OH和侧链上的-OH,这三类羟基的作用力是不一样的,而且乙二胺四乙酸还受N原子的影响,使得Cu2+络合过程中与其它金属(离子)的结合有差异,形成四面体或八面体结构。不同环境下的空间结构、成键键长、键能和键角是有差别的,导致其结合能不同,导致对金属之间的结合力与电子效应也不相同,进而影响催化剂表面酸性。
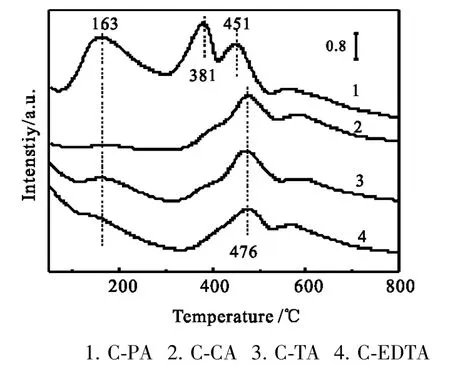
图11 催化剂的NH3-TPD谱图Fig.11 NH3-TPD spectra of different catalysts

图12 催化剂的CO2-TPD谱图Fig.12 CO2-TPD spectra of different catalysts

表4 催化剂的酸量对比表Table 4 Acid amounts of catalysts
2.5 CO2-TPD表征
催化剂的CO2-TPD表征结果见图12和表5,图表给出了各个催化剂表面碱性强弱与数量。从图中可看出,所有催化剂样品都有2个CO2脱附峰,分别位于约400℃和457℃,对应中强碱性位。碱性位数量大小按吸附的CO2的物质的量排序为C-PA>C-TA>C-EDTA>C-CA。结合催化产物分布看,与乙醇的选择性大小排序一致,而与烃选择性排序相反,说明碱性促进乙醇形成,抑制烃产生。因为碱性位很大部分产生于催化剂表面的金属氧化物数量与电子效应,与TPR表征中可还原金属氧化物多少是一致的。

表5 催化剂的碱量Table 5 Base amounts of catalysts
另外,考虑到催化剂表面碱性和酸性对产物有影响,为综合考察其碱量与酸量对催化产物乙醇选择性之影响,用碱量与酸量之比值(见表6)作为考察因素,对乙醇选择性作图13,得到相关系数很高的一条回归直线。可以看出乙醇选择性与对应的碱量和酸量都有关系,并且与它们的比值成正相关性。由于碱性条件一方面对酰基物种有稳定作用,可提高乙醇选择性,降低烃类和其它醇选择性;另一方面可促进醇醛缩合反应生成乙醇,降低了甲醇选择性,从而提高乙醇选择性。
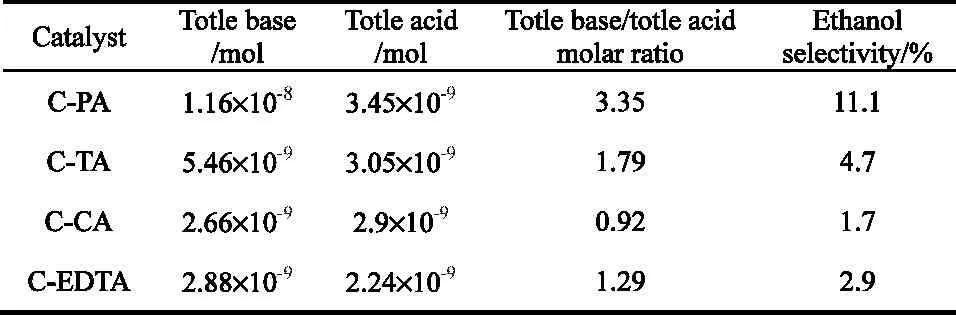
表6 碱酸量比对催化剂乙醇选择性的影响Table 6 Effect of the ratios of base to acid in catalysts on ethanol selectivity
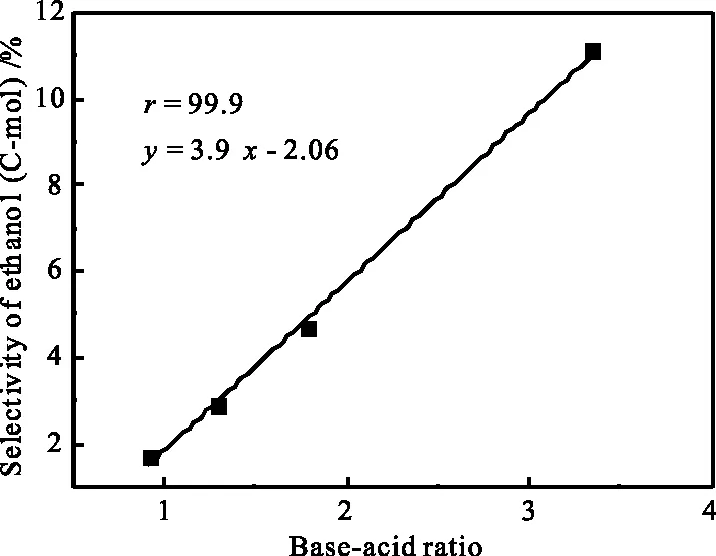
图13 碱-酸比与乙醇选择性的关系Fig.13 Ethanol selectivity vs base-acid ratio
3 结论
络合完全液相法制备CuZnAl催化剂可改变传统CuZnAl催化剂的催化性能,具备一定的碳链增长能力。没食子酸改性CuZnAl催化剂有较高乙醇选择性,产物醇多烃少;表征显示表面总碱量与总酸量之比与乙醇选择性呈正相关,即碱酸比越大,乙醇选择性越高;同时揭示乙醇形成与Cu+-Cu0共存有关,为进一步研发低成本乙醇催化剂开辟了新途径。

