混饲对吡喹酮在草鱼体内药动学和生物利用度的影响
胥 宁,杨移斌,刘永涛,董 靖,杨秋红,艾晓辉
(1.中国水产科学研究院长江水产研究所,武汉 430223; 2.淡水水产健康养殖湖北省协同创新中心,武汉 430223)
吡喹酮是一种广谱抗寄生虫药物,广泛应用于人类和动物医学领域。在水产养殖中,吡喹酮主要对抗吸虫[1]、棘头虫[2]、绦虫[3]和其他类寄生虫。随着养殖规模的不断扩大,用药量也随之增加。
在水产临床应用中,大多数药物主要是通过拌饲给与水产动物,但是食物对药物的代谢动力学和生物利用度影响研究还较为少见。在人类和畜牧动物中,有很多药物与食物同时服用,对药物的吸收、分布、排泄和代谢具有显著的影响。在伏立康唑的研究中发现,药物与食物同时服用使药物的最高浓度 (Cmax)和药时曲线下面积 (AUC),分别降低了22%和35%,生物利用度(F)降低了22%,而且明显延迟了吸收时间[4]。哌醋甲酯在与食物混合服用时,药动学数据也发生了明显的改变。快速释放的剂型的Cmax和AUC分别增加了23%和15%,慢速释放剂型的Cmax和AUC分别增加了17%和14%[5]。一种葡萄糖神经酰胺合成酶随食物服用之后,Cmax增加了36%,AUC降低了14%,达峰时间延迟了2 h[6]。卤方特瑞与脂肪食物混服之后,Cmax从184 μg/L增加到了1 218 μg/L,AUC从3.9 mg·h/L增加到了11.3 mg·h/L[7]。以上文献显示在混饲条件下,食物会改变肠道生理环境影响药物的吸收、代谢和排泄,药物的Cmax、 AUC、吸收速率和分布半衰期等参数受到了直接影响,致使药物在动物体内有效浓度的变化,会导致药物的药效降低或升高,更有甚者会造成中毒和治疗的失败。因此,混饲条件下药物代谢动力学的研究,直接关系到治疗的成功和失败,对药物使用效率和安全使用具有重要的意义。
目前大多数水产药的药动学研究并没有比较口服原药和混饲药物之间的区别[8,9]。本研究选取吡喹酮和草鱼为研究对象,采用口灌原形药物和口灌原形药物与饲料混合物,比较二者的药代动力学参数的改变,为吡喹酮临床应用提供理论基础。
1 材料与方法
1.1 试验仪器
ACQUITY UPLC 超高效液相色谱 ( 美国Waters公司)配荧光检测Empower2 色谱工作站;电子天平(Mettler-TOLEDO AE-240,梅特勒-托利多公司);高速冷冻离心机(20PR2520,日本日立);漩涡混合仪(上海康华生化仪器制造公司);氮吹仪(KD200,巩义予华有限公司)。
1.2 药物与试剂
吡喹酮标准品(纯度大于99%,购自德国Dr.Ehrenstorfer公司),吡喹酮原料药(纯度大于98%,购自艾博科技有限公司)。乙腈、甲酸(纯度88%)、乙酸乙酯和正己烷均为色谱纯(购自美国J.T.Baker公司);肝素钠(购自上海惠兴生化试剂有限公司)。
吡喹酮原形药物口灌液的配制:精确称取10 mg吡喹酮原料药,首先用适量的二甲亚砜进行溶解(体积小于1%),然后用生理盐水调整到5 mg/mL。
吡喹酮与饲料混合物的配制:精确称取10 mg吡喹酮原料药,首先用适量的二甲亚砜进行溶解(体积小于1%),加入粉碎的饲料10 g,然后用生理盐水调整到5 mg/mL。
吡喹酮注射液的配制:精确称取5 mg吡喹酮原料药,首先用适量的二甲亚砜进行溶解(体积小于1%),然后用生理盐水调整到2 mg/mL。
1.3 试验动物
草鱼, 300尾,体重(300.0±25.2)g,由中国水产科学研究院长江水产研究所基地提供,试验前在5个水族箱内(100 cm×60 cm×80 cm)暂养一周,饲喂不加抗菌药物的草鱼全价饲料。试验用水为曝气48 h自来水,连续充氧,保持水中溶氧大于5.0 mg/L,pH为7.5~8.0,温度(21.0±1.3)℃。
1.4 样品采集
口灌吡喹酮原药组:草鱼84尾,试验前禁饲24 h,以20 mg/kg灌胃给药,灌胃之后观察5 min,将回吐药物的鱼弃去,其他鱼灌胃之后补足。给药后于5 min、10 min、30 min、1、2、 4、6、8、12、16、24、48、72、96 h进行血液的采集,每个时间点采集6尾鱼。血液采集之后1 500g离心,取上层血清,-20 ℃保存。
口灌吡喹酮和饲料混合物(饲料配方为:米糠40%、麸皮38%、豆饼10%、鱼粉10%和酵母粉2%)的实验组实验操作与上同。
静脉注射组:试验前禁饲24 h,草鱼84尾,以5 mg/kg尾静脉注射给药,给药之后按压止血1 min,如果止血之后还是出血不止,弃掉此鱼,换鱼进行给药。给药后于5 min、10 min、30 min、1、2、 4、6、8、12、16、24、48、72、96 h进行血液的采集,每个时间点采集6尾鱼。血液采集之后1 500g离心,取上层血清,-20 ℃保存。
1.5 样品处理
在室温下,将冷冻样品自然解冻。准确吸取血液1 mL于10 mL离心管中,依次加入4 mL乙酸乙酯,旋涡混合1 min,2 000g离心5 min。取上清液于另一10 mL离心管中。剩余残渣再加入4 mL乙酸乙酯,重复提取一遍,合并上清液。45 ℃氮气吹干,1 mL乙腈/水(35∶65,含0.1%甲酸)复溶,加入1 mL正己烷,旋涡混合30 s去脂,5 500g离心5 min,弃掉正己烷层,用1 mL注射器吸取样品过0.22 μm尼龙膜放入1.5 mL样品瓶中,待测定。
1.6 标准曲线、精密度和准确度的测定
标准曲线的制定:配制吡喹酮的质量浓度均为20、50、500、2000和8 000 μg/L,进行UPLC分析。分别以药物峰面积为纵坐标(Y),药物浓度为横坐标(X)绘制标准曲线。
精密度和准确度的测定:设定高中低三个药物浓度(50、100、1 000 μg/L),进行基质添加,然后用1.5.2方法处理之后,进行测定计算回收率。基质添加样品分为5批,连续5 d测定计算精密度。
1.7 色谱条件
色谱柱:ACQUITY UPLC BEH C18 column (1.7 μm,2.1 × 100 mm)
流动相:乙腈/水(0.1%甲酸)(35∶65,v/v),流速0.3 mL/min,柱温30 ℃。
荧光检测器,发射激发波长265 nm,发射波长280 nm。
1.8 数据处理
标准曲线,药物经时曲线图采用MicrosoftExcel2010软件绘制;药代动力学参数的拟合和计算,采用3P97软件进行处理。生物利用度的计算公式为:
AUCp.o.:口灌给药后药时曲线下面积;Dosep.o.:口灌时给药剂量
AUCiv:静注给药后药时曲线下面积;Dosep.o.:静注时给药剂量
2 结果
2.1 标准曲线、准确度和精密度
吡喹酮出峰时间在6.45 min在血液中的定量限为20 μg/L(见图1)。在20~8 000 μg/L内呈现出良好的线性,r=0.999,方程为y=101.67x-433.75。各个组织中高中低三个质量浓度,吡喹酮的平均回收率在78.9%~86.2%之间,日内和日间变异系数均小于10%。
2.2 吡喹酮在草鱼体内药动学参数
口灌吡喹酮原形药物:血药浓度曲线符合一级吸收二室开放模型。在给药之后,实测0.5 h达到浓度最高点为2 141.0 μg/L,随后血药浓度快速下降。其药动学参数吸收速率常数(K)、吸收半衰期(t1/2K)、分布半衰期(t1/2)、消除半衰期(t1/2β)、表观分布容积(Vd)和药时曲线下面积(AUC)分别为6.5 h-1、0.1 h、1.2 h、18.1 h、2.49 L/kg 和 19 885.8 μg.h/L。生物利用度(F)为47.0%(见表1,图2)。
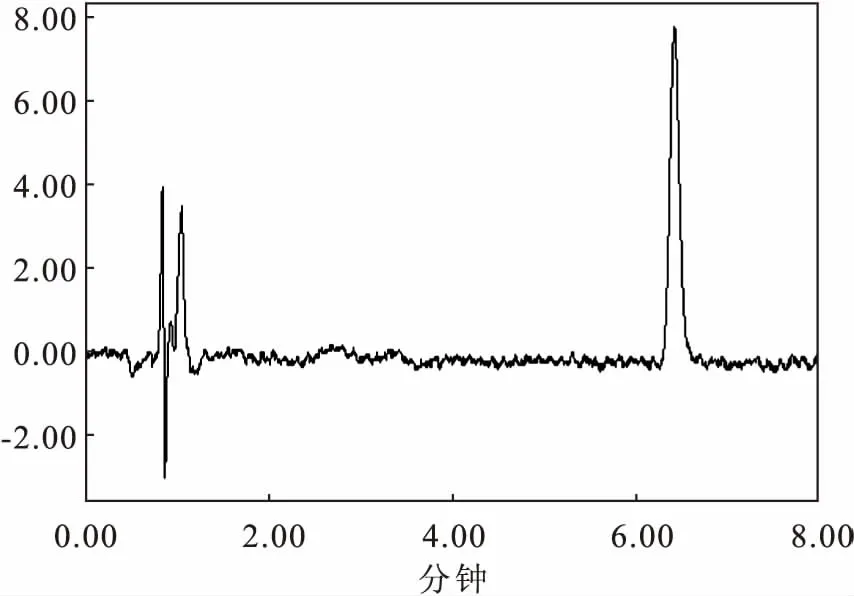
图1 空白血液中添加标准品吡喹酮(1 μg/mL)的色谱图Fig.1 Chromatogram of standard praziquantel (1μg/mL) added in blank blood
口灌吡喹酮和饲料的混合物:血药浓度曲线符合一级吸收二室开放模型。在给药之后,实测1 h达到浓度最高点为2167.0 μg/L,随后血药浓度快速下降,与口灌原形药物比较较平缓。其药动学参数K、t1/2K、t1/2、t1/2β、Vd和AUC分别为分别为2.19 h、0.3 h、0.4 h、8.6 h、0.01 L/kg和14671.7 μg.h/L。F为34.7%(见表1,图2)。
静注吡喹酮:血药浓度曲线符合无吸收一室开放模型。其药动学参数消除速率常数(Ke)、消除半衰期(t1/2Ke)、Vd和AUC分别为0.47 h-1、1.5 h、0.001 L/h和10 570.4 μg·h/L(见表1,图2)。
3 讨论
本研究在口灌吡喹酮原药和口灌吡喹酮及饲料混合物所得血药浓度均符合一级吸收二室开放模型,静注所得血药浓度符合无吸收一室开放模型。在淡水和盐水的饲养条件下,草鱼(Ctenopharyngodonidellus)口灌10 mg/kg吡喹酮,水温(22±1)℃,药动学参数也符合一级吸收二室开放模型[10]。Tubbs 等[11]却发现,无鳔石首鱼(Seriolalalandi)口灌吡喹酮40 mg/kg,水温为18~19 ℃条件下,血药浓度符合非房室模型。文献显示,药动学房室的拟合受到水温、环境盐度、鱼的种类和大小等因素的影响[12]。
在口灌吡喹酮及饲料混合物和口灌吡喹酮原药之后,Tmax和Cmax分别为1 h 和 2 167.0 μg/L,0.5 h 和 2 141.0 μg/L。口灌吡喹酮及饲料混合物,吡喹酮的达峰时间明显延长,但是达峰浓度相差并不大。Xie等[10]报道,在口灌吡喹酮原药10 mg/kg的条件下,达峰时间为0.5 h,在淡水中的峰浓度为910 μg/L,在盐水中峰浓度明显低于前者为760 μg/L。Tubbs等[11]报道,在给药40 mg/kg的条件下,吡喹酮的峰浓度为12 730 μg/L(口灌溶液)和10 620 μg/L(口灌药物饲料混合物)。研究结果表明,给药量的大小直接影响峰浓度,给与饲料混合物达峰时间会延迟。在本研究中,口灌药物饲料混合物吸收速率常数是口灌吡喹酮原药的三分之一。这一现象表明饲料和药物同时服用,影响了吡喹酮的吸收,使吸收速率常数变小。二者分布半衰期分别为0.4 h和1.2 h,同样佐证了这一点。口灌药物饲料混合物消除半衰期为8.6 h,显著小于口灌原药(18.1 h)。在Xie等[10]的报道中,消除半衰期较长,为71.2 h(淡水中)和56.5 h(盐水中)。在无鳔石首鱼的报道中明显较短为6.6 h和7.9 h[11]。这个参数差异较大,可能与实验温度、鱼类品种有较大的关系。在哺乳动物中,消除半衰期明显短于鱼类。例如在猪体中,静注10 mg/kg吡喹酮时消除半衰期为1.5 h,口服50 mg/kg时为1.07 h[13]。在牛体中,静注10 mg/kg时消除半衰期也明显短于鱼类,但在口服30 mg/kg时却接近本次研究[14]。鱼类和哺乳动物之间的差异,可能是由于二者代谢酶的差异造成的。

表1 不同给药方式下吡喹酮的药动学参数Tab.1 Pharmacokinetic parameters of PZQ after different administrations
注:- 不存在;A:为药时曲线对数图上在横轴的截距;B:为药时曲线对数图上在纵轴的截距;a:为分布速率常数;β:为消除速率常数;Ke:一室模型消除速率常数;Ka:一室模型分布速率常数; t1/2α:二室模型吸收半衰期;t1/2β:二室模型消除半衰期;t1/2 Ke:一室模型消除半衰期;t1/2 Ka:一室模型分布半衰期;K10:由中央室消除的一级速率常数;K12:由中央室向周边室转运的一级速率常数;K21:由周边室向中央室转运的一级速率常数;AUC0-t:药时曲线下面积;Tmax:达峰时间;Cmax:峰浓度;Vd:表观分布容积;F:生物利用度。

图2 不同给药方式下吡喹酮的血药浓度曲线Fig.2 Praziquantel concentration curve in plasma after different administrations
口灌吡喹酮饲料混合物的生物利用度是34.7%,口灌吡喹酮原药是47.0%,药时曲线下面积相应降低了26.2%。吡喹酮生物利用的研究只在少数鱼类体内进行过。在Tubbs等[11]研究中发现了一个奇怪的现象,口服吡喹酮与饲料的固体混合物,生物利用度反而超过了口服吡喹酮溶液。因此,混饲药物的吸收、代谢和排泄,受到食物影响较大。目前在鱼体中,饲料对药物的药动学影响研究,报道较少,但是在人体和动物体已经有了大量研究。目前研究表明,有许多食物吸收因素影响着药物的吸收和代谢。例如四环素类药物可以跟食物中的金属离子相结合,形成不容易吸收的离子络合物[15]。另外,食物可以改变胃的排空率、胃肠道内容物的pH值,肠道药物代谢酶的活性,肠道血液循环的血流以及血浆蛋白结合律,从而促进或降低药物的吸收[16]。芬苯达唑和食物一起口服,芬苯达唑的系统生物利用度显著增加[17]。服用甲苯咪唑的油悬液,其生物利用度也相应增加[18]。对于抗高血压和抗心律失常药物,给与没有禁食的患者,二者生物利用度也显著增加,这是由于此类药物改变了肠道血液循环血流速,药物的吸收速率和药物代谢酶的作用所导致的[19-21]。另外,有些药物受食物的影响之后,生物利用度会降低,如β-内酰胺类抗生素[22,23]、头孢类抗生素[24]、红霉素[25]和异烟肼[26]。这些药物受胃排空率、肠道内容物pH值和肠道血流速的影响较大。在本研究中吡喹酮受食物的影响后,生物利用度降低,可能是这些因素所导致。
本次研究表明口服和静注吡喹酮之后,快速分布消除。口服吡喹酮和饲料混合物与口服吡喹酮原药相比,生物利用度降低了12.3个百分点,其他药动学参数没有显著的变化。这些数据的获得将有利于吡喹酮的剂型改造和临床方案的确定。

