甲酸乙酯-乙醇二元体系等压汽液相平衡研究
张棋茜,蒋文伟,罗 芩,杨 琴
(1.四川大学 化学工程学院,四川 成都 610065; 2.成都惠恩精细化工有限责任公司,四川 成都 610041)
甲酸乙酯是重要的化工基础原料之一,具有十分广阔的应用.甲酸乙酯可以作为硝酸纤维素和醋酸纤维素的优良溶剂,同时也作为有机合成的中间体被用在医药生产上.此外,甲酸乙酯还应用于配制食品、香烟、谷类、香精[1].
目前,甲酸乙酯的合成方法主要是甲酸和乙醇在硫酸作为催化剂存在下加热进行酯化反应.由于甲酸乙酯不稳定,容易发生水解,因此酯化反应过程是一个可逆过程.为了提高产率,通常采用乙醇过量的方法,这就需要采用精馏技术对甲酸乙酯进行分离提纯[2].因此,研究甲酸乙酯-乙醇体系的汽液相平衡数据对于甲酸乙酯的分离工艺设计及优化有着重大意义.文献[3]只提供了甲酸乙酯和乙醇体系的共沸温度,张士旭等[4]利用修正的UNIFAC模型对甲酸乙酯和乙醇进行了常压(101.325 kPa)下的汽液相估算,但是目前甲酸乙酯-乙醇体系的相关汽液相平衡实验数据还相当缺乏.针对该研究现状,本文对甲酸乙酯-乙醇体系的汽液相平衡进行研究,获得准确可靠的汽液相平衡数据及相关模型参数,为甲酸乙酯-乙醇体系的精馏分离过程提供数据基础.
1 实验部分
1.1 实验仪器及试剂
实验仪器:上海精科GC122气相色谱仪,FID检测器;N2000色谱工作站,浙江大学智达信息工程有限公司;改进的ROSE汽液平衡釜,成都凌云玻璃仪器厂加工;精密温度计(50~100 ℃,精度为0.1 ℃).
实验试剂:无水乙醇,分析纯,成都科龙化工试剂厂;甲酸乙酯,分析纯,成都科龙化工试剂厂;正丙醇,分析纯,成都科龙化工试剂厂.
1.2 实验分析方法
用GC122气相色谱仪对甲酸乙酯-乙醇样品进行分析.分析条件:氢离子火焰检测器(FID),色谱柱为SE-30型石英毛细管柱,柱长30 m,直径0.32 mm;膜厚1 μm,分流比100∶1,进样量为0.2 μL;柱温40 ℃,气化室温度120 ℃,检测器温度120 ℃.样品测定采用内标法,在选定的气象色谱条件下分析样品,以正丙醇为内标物,测得甲酸乙酯与正丙醇的面积比(Ai/As),然后作出Ai/As-mi/ms工作曲线,如图1所示.

图1 甲酸乙酯校正因子图Fig.1 Ethyl formate correction factor
该工作曲线的方程为:
y=0.6303x+0.1062(R2=0.994{
1.3 实验装置的校核
为了验证实验装置测定出的汽液相平衡数据的可靠性,用乙醇-水体系对平衡釜进行校核.精确配置不同浓度的乙醇-水混合溶液,用阿贝折光仪测定各乙醇-水溶液样品的折光率,绘制出标准曲线.如图2所示.

图2 25 ℃时乙醇-水折光率曲线图Fig.2 The refractive index curve of Ethanol-Water at 25 ℃
由图2可以看出,乙醇-水体系折光率在乙醇摩尔分数小于0.5之前有规律上升,0.5之后缓慢下降.分段拟合出折光率曲线方程为:
x≤0.5;y=-0.187x2+0.150 3x+
1.333 2(R2=0.993 3)
x>0.5;y=-0.031 3x2+0.038 8x+
1.353 2(R2=0.994 2)
上式中:x为乙醇摩尔分数,y为折光率.
为了与文献值[5]进行对比,选定于100 kPa下对乙醇-水体系进行汽液相平衡数据的测定,结果如图3所示.实验结果与文献值较为吻合,表明了此平衡釜对测定汽液平衡数据的可靠性.

图3 乙醇-水体系100 kPa汽液平衡数据实验值与文献值对比Fig.3 Comparison of VLE data of ethanol-water at 100 kPa from experiments and literature
1.4 实验数据的测定
对实验装置进行气密性检测,保证实验装置具有良好的气密性,并根据当时实验室内的气压计算出对应系统补偿压力.通过电接点压力自动调节器对压力进行补偿,使体系始终保持恒压.将配置好的甲酸乙酯-乙醇溶液加入到干燥的平衡釜内,接通冷却水,打开水浴锅.将温度调控到比共沸温度略低一点的温度值,缓慢加热,观察釜内状态、和冷凝管的冷凝状态.在没有冷凝液滴生成的情况下,缓慢提高水浴温度,当釜内溶液开始沸腾时,冷凝管开始缓慢出现液滴时,打开回流阀门,让冷凝液回流液充分循环.当温度维持稳定不变,且冷凝液流稳定,温度与压力保持5 min甚至更长时间不变,认为汽液相平衡已经建立.记录下平衡温度,同时提取液相口和汽相口液体样.立即用气相色谱仪进行组分分析,每个样品分析3次,求取平均值.
2 结果与讨论
2.1 测定结果
实验所测定的甲酸乙酯-乙醇相平衡数据见表1.
表1 95.8 kPa下甲酸乙酯(1)-乙醇(2)二元体系的平衡数据与关联结果
Tab.1 VLE data and the regressive results of ethyl formate(1)-ethanol(2) at 95.8 kPa

Ti,exp/℃x1,expy1,expγ1γ2NRTL 模型Wilson 模型ΔT/℃Δy1ΔT/℃Δy176.800———10.010.00000.020.000074.80.02360.16493.06581.00040.18-0.03690.05-0.029972.10.07310.31522.93391.0032-0.410.0022-0.610.009969.60.12310.43782.68821.0087-0.720.0067-0.880.010167.40.16870.50882.47941.0159-0.730.0185-0.810.018366.40.18670.51962.31551.0194-0.530.0345-0.560.032665.20.20490.55762.25721.0231-0.110.0209-0.110.018064.60.21660.61482.20171.02570.02-0.02180.04-0.025462.90.25860.62892.16671.03650.180.00910.280.003761.80.30330.68032.04811.0510-0.13-0.00390.05-0.010359.50.40060.71751.93171.0938-0.330.0211-0.080.0146580.44670.74681.71291.11990.170.01440.410.008757.60.47630.77561.62471.14060.01-0.00180.25-0.006756.60.56990.79241.56951.2268-0.440.0156-0.260.0129550.64980.84421.41111.33220.09-0.01130.17-0.011754.20.7420.8571.29761.5251-0.070.0032-0.080.004553.60.80440.8771.18181.7269-0.050.0033-0.110.005153.20.90470.92081.11582.3039-0.390.0027-0.470.003052.70.93960.94141.03372.65080.010.0037-0.150.003152.60.95370.95321.01492.82720.010.0023-0.080.001452.70.96590.96421.00922.99700.010.0013-0.170.000352.8111.0051———0.000.000-0.070.000Avg.abs0.210.01070.260.0105
注:ΔT=Tcal-Texp;Δy=ycal-yexp;Tcal为热力学模型计算的温度值,Texp为实验测定的温度值;ycal为热力学模型计算的甲酸乙酯汽相质量分数,ycal为实验测定的甲酸乙酯汽相质量分数.
在95.8kPa条件下,属于低压范围,可以将甲酸乙酯体系气相视为理想气体.汽液相平衡公式简化为[6-7]
(1)

甲酸乙酯、乙醇饱和蒸汽压用Antoine方程计算:
(2)
甲酸乙酯和乙醇的Antoine常数[7-8]在表2给出.

表2Antoine方程参数值Tab.2ParametersofAntoineequation
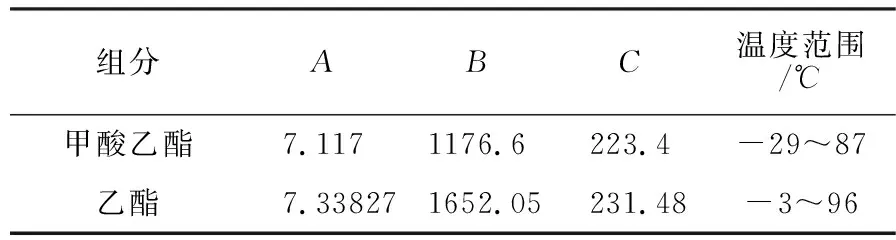
组分ABC温度范围/℃甲酸乙酯7.1171176.6223.4-29~87乙酯7.338271652.05231.48-3~96

图4 lnγ1/γ2 -x1 曲线图Fig.4 Curve of lnγ1/γ2 -x1
2.2 热力学一致性检验
实验测得数据是否可靠,可从其是否符合热力学一致性来检验,基本依据是Gibbs-Duhem方程[7].对于二元恒压体系,G-D方程为
(3)
其中:HE为二元体系的超额焓,R为通用气体常数.对恒压方程进行积分有
(4)
由于式(4)HE对于一般极性和非极性体系都不可以忽略,积分很难.所以对于二元恒压的汽液相平衡,通常采用Herington的半经验方法进行热力学一致性检测[9].
检验方法如下:以lnγ1/γ2对于x1作图,计算出
D=|(SA-SB{/(SA+SB{|×100
(5)
再计算出
(6)
式中SA,SB分别是曲线与横坐标上下的面积代数和,Tmax,Tmin分别为2组分的沸点.判断标准为:若D-J<10,则认为数据符合热力学一致性.用Herington面积检验法对所测得的甲酸乙酯-乙醇二元体系在95.8KPa下的汽液相平衡数据进行热力学一致性检验,如图4所示.计算结果D-J=8.1595<10,表明数据通过热力学一致性检验.
2.3 汽液平衡数据的关联
用AspenPlusV8.4软件对所测得的汽液相平衡数据进行关联,回归出Wilson模型[10]和NRTL[11]模型的aij,aji,bij,bji参数.Aspen中的Wilson模型和NRTL模型的参数表达形式相比于普遍文献有所改动[12].具体如下:
Wilson模型:
(7)
lnΛij=aij+bij/T+cijlnT+dijT
(8)
其中:aij≠aji,bij≠bji,cij≠cji,dij≠dji.
NRTL模型:
(9)
Gij=exp(-αijτij{
(10)
τij=aij+bij/T+eijlnT+fijT
(11)
αij=cij+dij(T-273.15)
(12)
其中:τ=0,G=1,α=0.3;aij≠aji,bij≠bji,cij≠cji,dij≠dji.
NRTL模型的非随机参数αij在Aspen的NRTL模型中是通过cij表示.根据文献[13]分类,选择NRTL模型的非随机参数cij为0.3.
经过回归计算,得出各模型的参数见表3.
表3Wilson和NRTL模型参数Tab.3ParametersoftheWilsonandNRTLmodels

模型a12a21b12b21NRTL1.257260.639002-99.0678-115.423Wilson-8.045349.673072497.34-3464.62
实验测得的汽液相平衡数据与Wilson模型和NRTL模型关联后计算的数据见表1,拟合出的T-x-y相图如图5、图6所示.Wilson模型和NRTL模型关联计算出的平均温度绝对偏差分别为0.25 ℃和0.21 ℃;汽相组成平均绝对偏差分别为0.0105和0.0107.结果表明,实验测得数据与Wilson、NRTL模型关联的数据吻合度较好,实验数据是可靠的.

图5 甲酸乙酯(1)+乙醇(2) T-x-y 图(Wilson模型)Fig.5 T-x-y plot of the ethyl formate(1)+ethanol(2) System (Wison model)

图6 甲酸乙酯(1)+乙醇(2) T-x-y 图(NRTL模型)Fig.6 T-x-y plot of the ethyl formate(1)+ethanol(2) System (NRTL model)
3 结论
(1)用改进的汽液相平衡釜测定了95.8kPa压力下的甲酸乙酯-乙醇体系的汽液相平衡数据,数据通过了热力学一致性检验.
(2)用Wilson模型和NRTL模型对所测的实验数据进行了关联,模型预测出的结果数据与实验测得的数据能较好的吻合,满足了精度要求,为甲酸乙酯-乙醇体系的分离过程提供了可靠的热力学基础数据.

