Aiolos基因rs9909593、rs9635726及rs12150079位点多态性与贵州汉族系统性红斑狼疮临床表型的相关性
杨 莹,杨 英,陈晓红,陈 林,梁翰月,罗 丽,贾常莎,袁 伟
(1.遵义医学院附属医院 皮肤科,贵州 遵义 563099;2.遵义医学院第二附属医院 皮肤科,贵州 遵义 563006; 3.遵义市第一人民医院,贵州 遵义 563002)
目前认为系统性红斑狼疮(Systemic lupus erythematosus,SLE)是由遗传与环境等多种因素相互作用引起的一种多基因疾病,其病因和发病机制尚不明确。多项研究发现,Aiolos基因可能是SLE的易感基因,我们结合近年来通过全基因组关联分析,IKZF1基因的rs2366293、rs1456896及Aiolos基因的rs9913957、rs8076347、rs8079075、rs907091、rs12150079[1-4]等位点在不同人群中被发现与SLE具有相关性。我们在此基础上进一步探讨Aiolos基因rs9909593、rs9635726及rs12150079位点多态性与贵州汉族系统性红斑狼疮临床表型的相关性。
1 对象与方法
1.1 研究对象 SLE病例组213例,来自我院就诊的门诊和住院病人,其中女性为197例,男性16例,年龄8~68岁,平均(32.93±12.15)岁,所有纳入研究对象均符合1997年美国风湿病学会修订的SLE分类和诊断标准[5],并对具备完整临床资料的213例患者进行分层分析。187例正常对照为同一时期在我院体检的正常健康人群,年龄、性别构成与病例组均无统计学差异(P>0.05),且其一、二、三级亲属中均无SLE患者。所有纳入对象均为贵州汉族人,患者之间、对照之间及患者与对照之间均无亲缘关系,无近期感染,其他免疫性疾病。本研究经本院伦理委员会审核批准,全部研究对象知情同意后采集标本。
1.2 资料与样本收集 本研究的调查表包括一般情况(姓名、性别、就诊年龄、家庭住址、联系电话、文化程度和婚姻状况等)、发病年龄、家族史、发病与怀孕及生育的时间关系、受累部位、主要临床表型:蝶形红斑、盘状红斑、光敏感、血液系统异常、肾脏病变、血沉、补体C3/C4、抗核抗体、抗ds-DNA抗体、抗Sm抗体、抗RNP抗体、抗SSB抗体、抗SSA抗体、血尿、蛋白尿、管型尿和24 h尿蛋白等符合SLE诊断标准。研究对象均知情同意后,采集外周静脉血2 mL置于真空抗凝管中,-80 ℃冰箱保存备用。
1.3 研究方法
1.3.1 基因组DNA的提取和标准化 根据Magen DNA提取试剂盒按照产品说明书提取样本基因组DNA,经检测其浓度后,标准化至50 ng/μL,置-80 ℃冰箱中备用。
1.3.2 Snapshot基因分型
1.3.2.1 PCR扩增引物及 Snapshot引物 在位点两侧设计PCR引物,运用primer5.0设计引物,由北京六合华大基因公司合成(见表1~2)。

表1 PCR 扩增引物

表2 SNaPshot单碱基延伸引物
1.3.2.2 多重PCR PCR反应体积为30 μL,包括10×DNA聚合酶缓冲液3 μL,dNTP 2 μL,基因组DNA2 μL,Taq DNA聚合酶0.2 μL,引物混合1 μL,H2O 20.8 μL。多重PCR扩增条件为96 ℃预变性2 min,96 ℃变性20 s,54 ℃退火10 s,72 ℃延伸30 s,反应35个循环,再次72 ℃延伸2 min,4 ℃保存。
1.3.2.3 Snapshot反应 采用美国ABI公司生产的ABI PRISM SNaPshot Muhiplex Kit进行。反应体系为5μL,其中PCR产物为3μL,SNaPshot Mix 0.5μL,延伸引物混合1 μL;反应条件为95 ℃预变性2 min,95 ℃变性10 s,50 ℃退火5 s,60 ℃延伸30 s,反应35个循环,12 ℃保存。
1.3.2.4 采用Snapshot技术在ABI 3730XL 型DNA 测序仪上对3个SNPs进行分型(由北京六合华大基因科技有限公司完成),基因分型由机器自动读取并做人工核定,为保证分型的准确度,随机挑选8例样本进行双向测序,均未发现分型错误。所选3个位点的分型成功率为98%。
1.4 统计学处理 将资料整理好应用SPSS 17.0软件进行分析,采用χ2检验比较病例-病例、病例组-对照组的等位基因频率(minor allele frequency,MAF)差异,计算P值、优势比(odds ratio,OR)及其95%可信区间(95%confidence interval,95%CI)。对病例资料按照临床表型整理分层,先对病例-病例进行分析(如有蝶形红斑和无蝶形红斑患者之间)以确定Aiolos rs9909593、rs9635726及rs12150079位点是否与各表型相关;然后进行亚表型-对照分析(如有蝶形红斑/无蝶形红斑与健康对照组之间)以明确这些位点与SLE各临床表型的关系。连锁不平衡和单体型分析采用SHEsis 在线软件进行处理,P<0.05为差异或关联性有统计学意义。
2 结果
2.1 SLE患者的临床资料及实验室检查 纳入研究的SLE患者较为常见临床症状有蝶形红斑143例(67.1%)、盘状红斑9例(4.2%)、肾脏病变116例(54.5%)、光敏106例(49.8%)、血液系统异常58例(27.2%);实验室检查:抗核抗体阳性(ANA)198例(93%)、低补体(C3/C4)171例(80.3%)、抗SSA抗体阳性149例(70%)、抗SSB抗体阳性42例(19.7%)、抗RNP抗体阳性112例(52.6%)、抗Sm抗体阳性79例(37.1%)、抗核小体抗体阳性76例(35.7%)抗ds-DNA抗体阳性65例(30.5%)、血沉增快67例(48.2%)。
2.2 Aiolos基因三个SNP位点等位基因分布频率与临床表型、实验室检查比较 病例-病例分析结果示:rs9909593、rs9635726及rs12150079位点等位基因频率与SLE各临床表型均无相关性(P均>0.05)。亚表型-对照分析表明,rs9909593、rs9635726及rs12150079位点等位基因频率与SLE各表型均无相关性(P均>0.05),见表3~4。

表3 SLE患者Aiolos基因三个SNP位点与临床表型比较
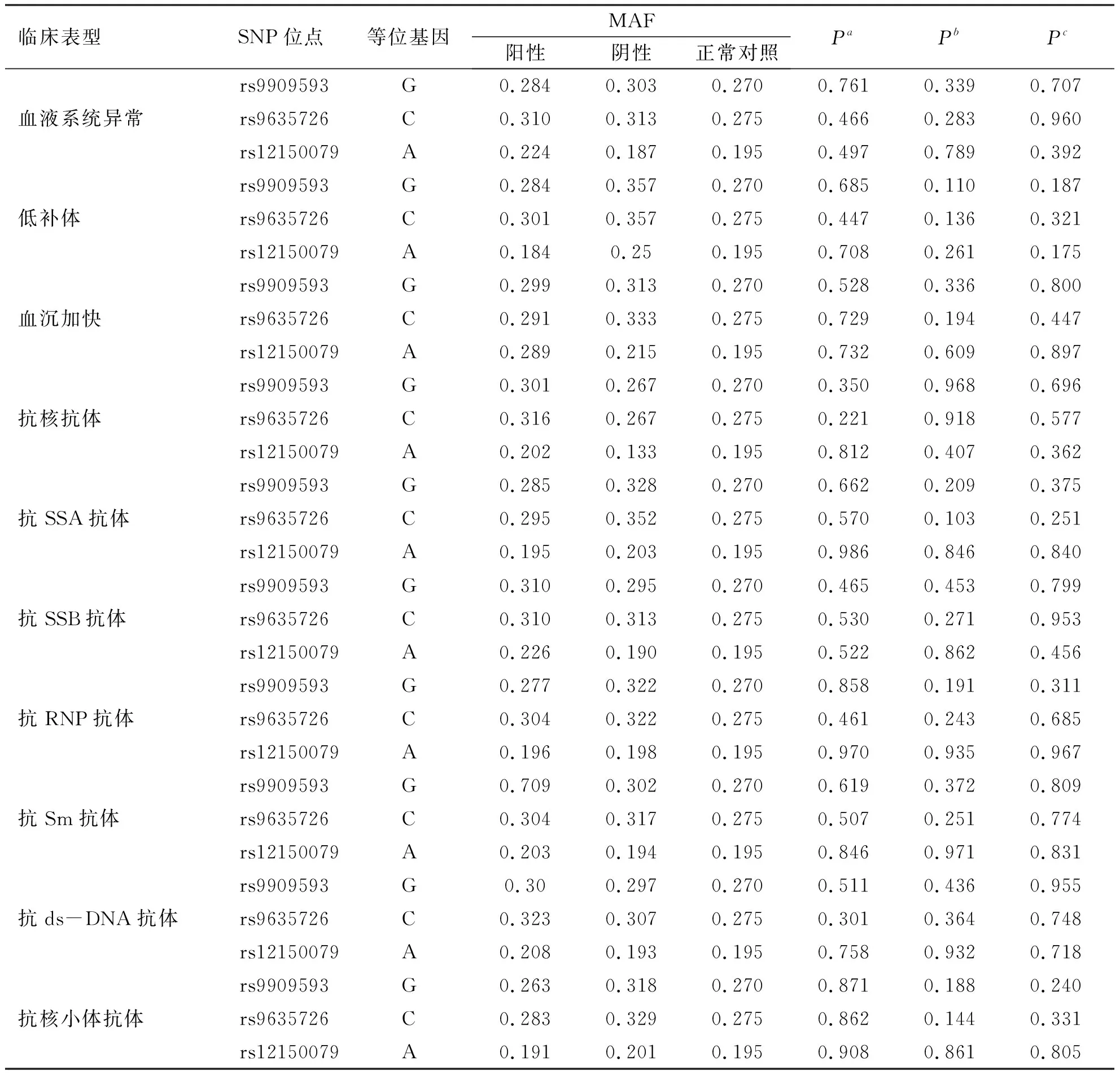
表4 SLE患者Aiolos基因三个SNP位点与实验室检查比较
2.3 Aiolos基因三个SNP位点连锁不平衡检验及单体型分析 对rs9909593、rs9635726、rs12150079这3个SNP 进行两两间连锁不平衡检验,rs9909 593与rs12150079(D'=1,r2=0.613)、rs9635726与rs12150079存在完全连锁不平衡(D'=1,r2=0.584),rs9635726与rs9909593存在强连锁不平衡(D'=0.877,r2=0.733)见表5。本研究采用SHEsis在线软件进行单体型种类和单体型频率的估计,以最低频率的阈值,即单体型频率<0.03的不纳入分析范围的标准,Aiolos基因rs12150079、rs9635726、rs9909593共3个位点可构建5种单体型(ACG、GCA、GCG、GTA、GTG),在病例-病例分析(如比较有蝶形红斑的SLE患者和无蝶形红斑的SLE患者之间的分布无显著性差异(P均>0.05);在亚表型-对照分析(如比较有蝶形红斑的SLE患者/无蝶形红斑的SLE患者与正常对照之间的分布无显著性差异(P均>0.05),各单体型与SLE发病均无关,见表6~7。
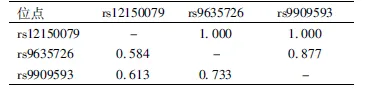
表5 Aiolos基因3个SNP位点连锁不平衡分析(r2/D′)
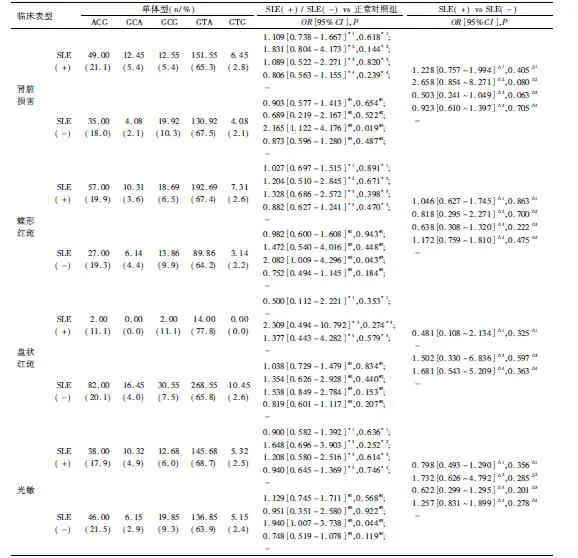
表6 Aiolos基因各单体型分布频率在病例-病例,病例-对照临床表型关联分析
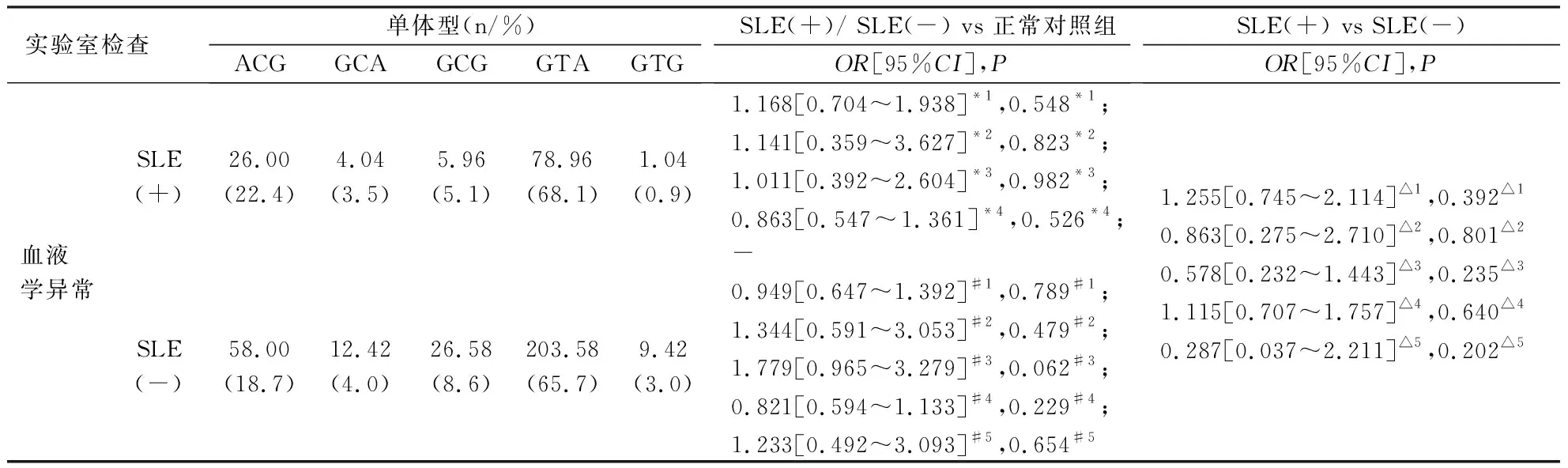
表7 Aiolos基因各单体型分布频率在病例-病例及病例-对照实验室检查关联分析

续表 Aiolos基因各单体型分布频率在病例-病例及病例-对照实验室检查关联分析

续表 Aiolos基因各单体型分布频率在病例-病例及病例-对照实验室检查关联分析
3 讨论
SLE是一种累及全身多系统、多器官、临床表现复杂的自身免疫性疾病,以多种自身抗体产生、补体激活、免疫复合物沉积,进而导致组织和器官的损伤为基本特征。SLE病死率较高,患者生存质量差。迄今为止,其发病机制尚未完全阐明,但多数学者认为遗传因素、环境因素及激素水平共同作用导致的免疫紊乱是SLE可能的发病原因。近年来对SLE的全基因组关联分析(GWAS)研究发现了许多与SLE有关的易感基因,该研究除了为发现SLE易感基因提供了直接证据外,同时为从基因组水平认识SLE的发病机制提供了重要线索。此外,大量的遗传学研究证明SLE与遗传有着密切的关系,SLE属于多个易感基因参与的多基因遗传病[6],SLE遗传发病机制中其发病率和患病率在不同地区、种族有很大差异,SLE在某些人群中的发病率明显高于其他人群,发病有家族聚集倾向,一级亲属的发病率明显高于正常人群,说明SLE是一种多基因的疾病,SLE不仅受潜在患病风险基因的影响,而且受外界环境因素和非遗传因素的影响,往往具有复杂多样的表型,且表型和基因型之间也存在复杂的关系。因此,SLE临床表型具有较大的异质性,基因型-表型分析可以有助于阐明易感基因位点是否与该疾病的临床表型相关,对于SLE的病因和发病途径可能会有新的发现。
Aiolos是一种锌指结构的转录因子,它属于IKaros基因家族,调节淋巴细胞的发育,控制B细胞的激活、成熟及细胞表面抗原受体的转换。近年来研究发现转录因子Aiolos在免疫细胞功能调节以及多种信号转导通路中起着重要作用[7-8]。越来越多的证据表明Aiolos基因在SLE 发病机制中有重要作用,与其他自身免疫病如类风湿关节炎等易感性也相关。美国近年的一项多种族GWAS研究[9]提示Aiolos基因中的rs8079075、rs9913957、 rs8076347 与欧洲SLE和非裔美国SLE均具有相关性,近期有研究[10-11]表明rs9909593、rs9635726这两个位点可能与中国长江以南汉族人群SLE的发病存在关联。我们早先对SLE患者Aiolos基因mRNA及蛋白表达研究发现,SLE患者Aiolos基因的mRNA及蛋白明显降低,且与SLE活动指数呈一定的相关性[12-13]。提示Aiolos基因的表达与SLE相关。而本次研究中亚表型-对照关联分析结果显示Aiolos基因的rs9909593、rs9635726及rs12150079位点在病例-对照、病例-病例分析中,各项亚临床表型组间等位基因频率分布差异均无统计学意义(P均>0.05),这三个位点与贵州地区汉族人群SLE的发病可能不存在关联,但由于本次研究选取SNP位点及研究对象数量较少;患者在接受调查时的病程不同,随着疾病的进展以及治疗过程的不同;遗传和环境因素相互作用可能会影响某些临床表型进而影响分析结果。还需要进一步对Aiolos其他多态性数据进行全面分析,从而深入的了解Aiolos基因与汉族人SLE临床表型的关系。

