我国北方地区鲤浮肿病毒的流行情况调查与监测分析
徐立蒲 王小亮 李 清 王立新 曹 欢 王 姝张 文 潘 勇 王静波
(1. 北京市水产技术推广站, 北京 100176; 2. 全国水产技术推广总站, 北京 100125)
鲤(Cyprinus carpioLinnaeus)是中国主要的淡水养殖品种之一。2015年, 鲤的养殖产量3.36×109kg,占淡水鱼类养殖总产量的12.4%。其中山东省、辽宁省、河南省和黑龙江省产量最高, 均在2×108kg以上。锦鲤(Cyprinus carpio var koi)为鲤的变种, 是中国重要的观赏鱼养殖品种之一[1]。近年来, 我国河南、河北、辽宁等多个省份养殖的鲤和锦鲤多次暴发一种被广大养殖者称为“鲤急性烂鳃病”的疾病。该病发病急、死亡率高, 已造成严重经济损失, 仅河南沿黄滩区每年的直接经济损失就高达5000万元以上[2]。根据已有报道, 该病的症状和发病特点与锦鲤疱疹病毒病(Koi Herpes Virus Disease,KHVD)[3]和鲤浮肿病(Carp Edema Virus Disease,CEVD)或称为锦鲤昏睡病(Koi Sleepy Disease, KSD)[4,5]都有相似之处。由于KHVD自2002年在我国首次发现后一直为我国鲤科鱼类主要病毒类疾病, 故该病发生以来一直认为是KHVD, 但多次样品检测结果呈KHV阴性。于2016年在确诊我国发生了CEVD[6—8]之后, 因为KHVD和CEVD两病症状的相似, 引起渔业主管部门高度重视, 我们经实验室检测和对河南沿黄滩区养殖的鲤(包括锦鲤)暴发的该病调查[9], 证实该病的主要病原为CEV。
鉴于近年该病暴发日益严重的现状, 为更多了解CEVD在我国流行现状和流行特点, 本文在暴发该病的我国北方地区5省市开展重点调查, 同时在9省市的鲤和锦鲤养殖场进行CEV的随机监测, 了解CEVD的流行现状和流行特点, 为疫病防控提供技术支撑。
1 材料与方法
1.1 材料
样品来源样品来源有2种, 一是重点调查采样, 在河北、河南、辽宁、北京、内蒙古自治区的26个正在发生或曾经发生(指发病已经停止至少15d, 但有烂鳃症状)疑似CEVD的养殖场取样。每个养殖场取3—10尾有烂鳃、凹眼等典型症状的鱼,即为1个样品, 采集时均记录水温、品种、鱼规格等信息。样品信息见表1。二是随机监测, 依托国家水生动物疫病监测计划的鲤春病毒血症病毒(Spring Viraemia of Carp Virus, SVCV)和锦鲤疱疹病毒(Koi Herpes Virus, KHV)的监测项目。2017年4—9月, 抽取了黑龙江、辽宁、内蒙古自治区、北京、山西、陕西、宁夏回族自治区、新疆维吾尔自治区和河南共9个省的97家鲤和锦鲤养殖场样品。每个养殖场随机取150尾活鱼为1个样品, 样品鱼多数未出现疾病症状。采样时水温13—27℃。将样品按省市来源、采样日期、采样水温(20℃以下还是20℃以上)、品种、样品鱼规格(12 cm以下还是12 cm以上)等进行分类, 样品信息见表2—表5。
仪器与试剂PCR仪为ABI Veriti型梯度PCR仪, 荧光PCR为AB 7500型。2×Master PCR Mix试剂购自北京百泰克生物技术有限公司, DNA抽提试剂盒为德国QIAGEN公司生产, nest PCR以及qPCR所用引物、探针等均购自生工生物工程(上海)股份有限公司。
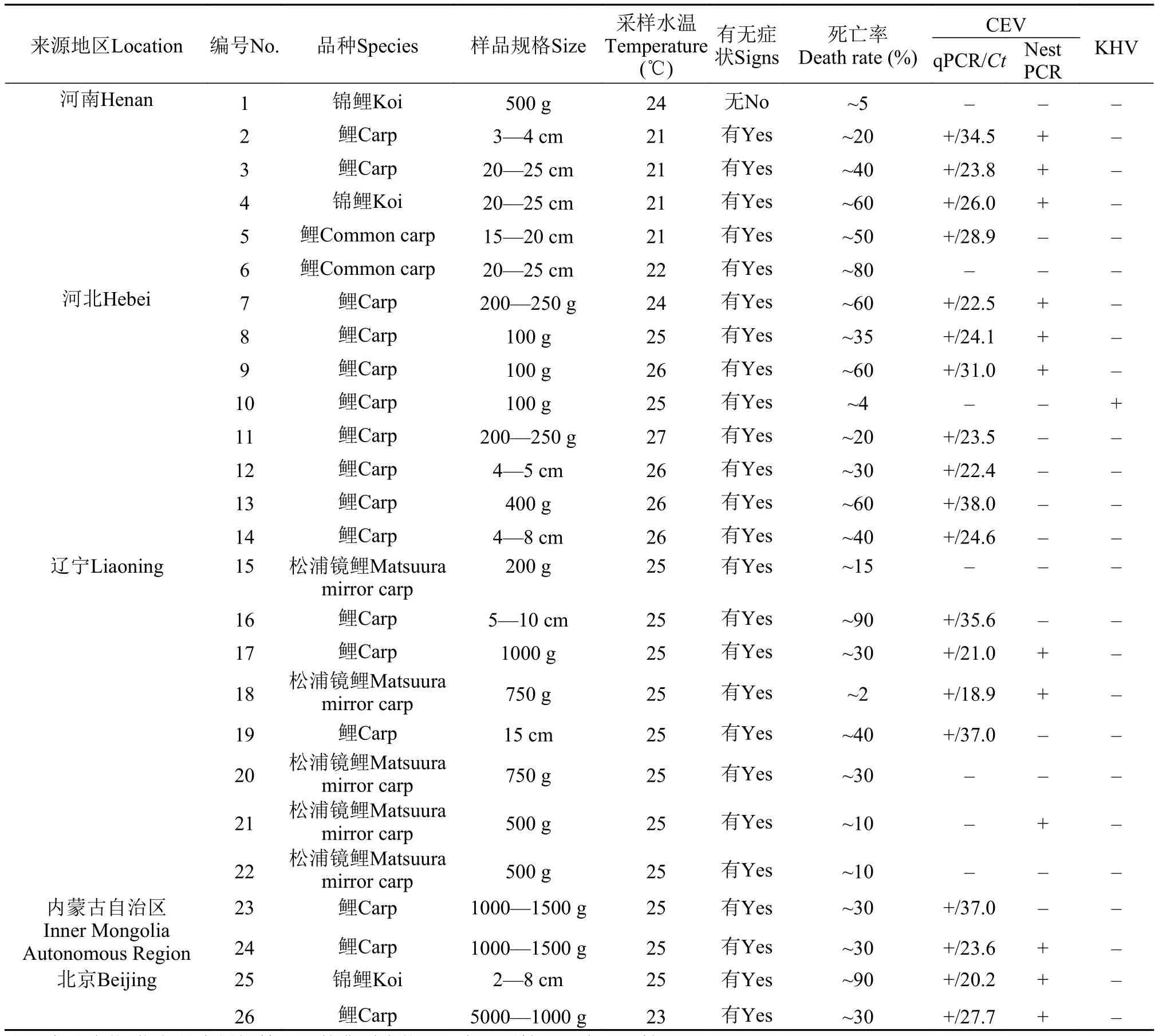
表1 重点调查的“鲤急性烂鳃病”样品的基本信息及CEV和KHV检测结果Tab. 1 Basic information and testing results of CEV and KHV for investigating samples suspected “acute gill-rot disease of carp”
1.2 方法
样品处理样品处理参考KHV检测标准[11]。重点调查采集的样品:取鱼鳃、肝、脑、脾、肾,混合后研磨, 为保护病毒, 按1∶5加入含10%胎牛血清的M199细胞培养液, 冻融1次以释放病毒。随机监测采集的样品:取每尾鱼的鳃、肝、脑、脾、肾, 为提高病毒检出率每10—15尾鱼的组织混成1个小样, 混合后研磨, 按1∶5加含10%胎牛血清的M199细胞培养液, 冻融1次以释放病毒。样品均采用DNA抽提试剂盒抽提核酸, 备用。
CEV检测方法重点调查采集的样品采用Oyamatsu等[12]建立的nest PCR方法和英国环境、渔业水产养殖研究中心(Center for Environment,Fisheries and Aquaculture Science, CEFAS)[13]建立的qPCR方法进行CEV检测; 同时采用行业标准《SC/T 7212.1-2011鲤疱疹病毒检测方法 第1部分:锦鲤疱疹病毒》进行KHV检测[11]。随机监测的样品使用CEFAS[13]建立的qPCR方法进行CEV检测。
按以下方法进行结果判断:qPCR方法结果以Ct值小于等于35, 且出现扩增曲线, 判定为阳性; 大于35小于40, 有扩增曲线的判为可疑, 重复1次后结果仍一致的判为阳性; 大于35, 未出现扩增曲线的判为阴性。nest PCR方法以阳性、阴性、空白对照正常情况下, 扩增出目的条带判定为阳性。qPCR和nest PCR中任何一种检测方法为阳性, 则判定样品为CEV阳性。
CEV部分基因测序与分析将随机监测时CEV检测呈阳性的样品按CEFAS[13]建立的nest PCR方法进行528和478 bp基因片段扩增, 扩增产物送至生工生物工程(上海)股份有限公司进行测序。测序结果通过NCBI的BLAST检索系统进行同源性分析, 从中选取与所测序列同源性较高毒株序列,使用MEGA 4.0软件的邻位相连法(Neighbor-joining)构建进化树, 通过自举分析进行置信度检测, 自举数集1000次。
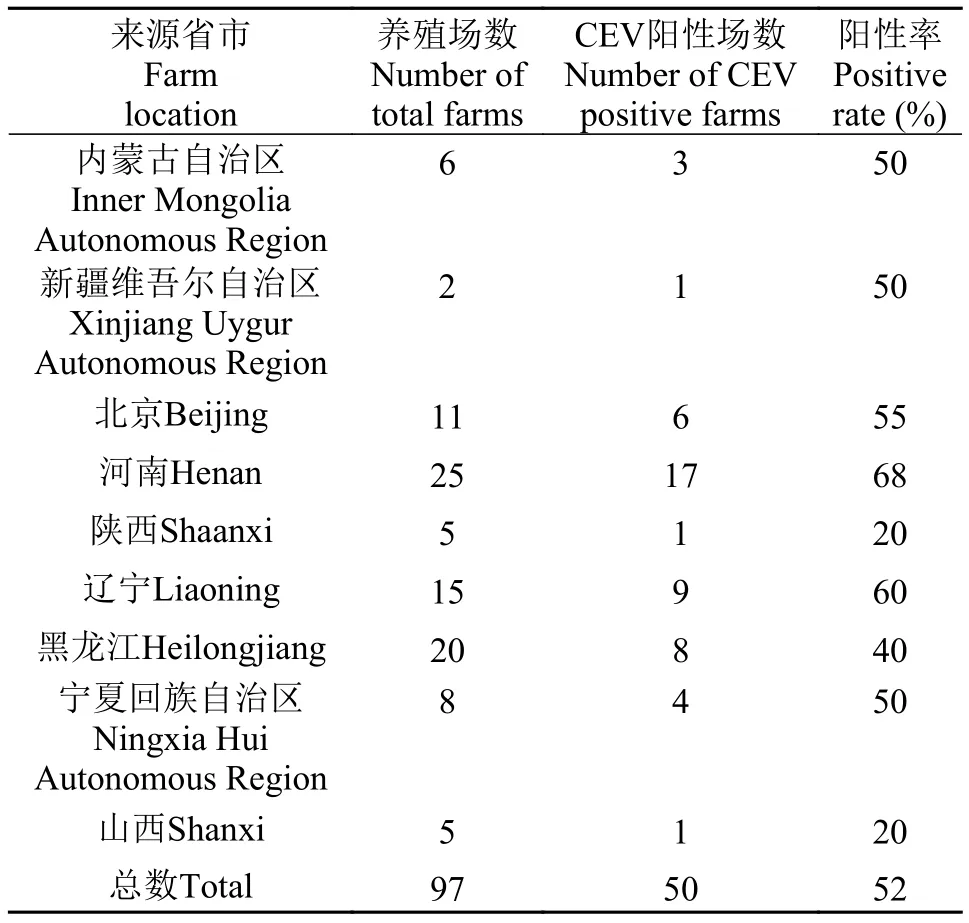
表2 不同地区的鲤或锦鲤养殖场CEV检出率Tab. 2 CEV-positive rates of carp or koi farms in different study regions
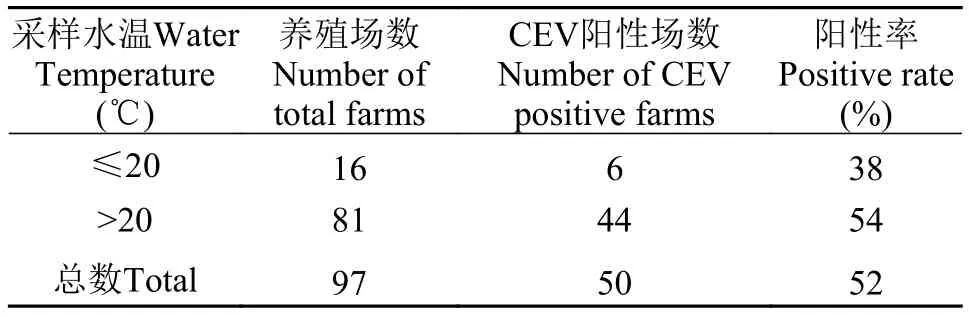
表3 不同采样水温的鲤或锦鲤养殖场CEV检出率Tab. 3 CEV-positive rates of carp or koi farms according to temperature of water samples
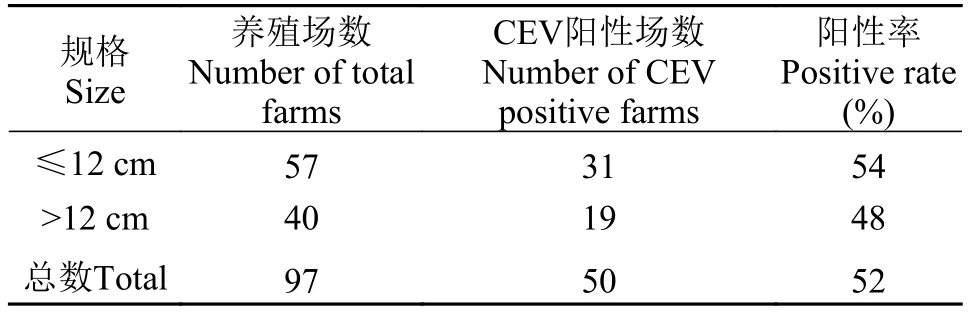
表4 不同样品规格的鲤或锦鲤养殖场CEV检出率Tab. 4 CEV-positive rates of carp or koi farms according to size of fish
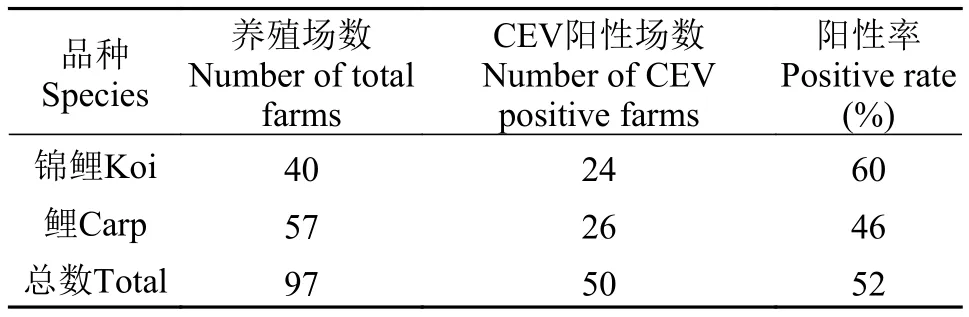
表5 鲤和锦鲤养殖场CEV检出率Tab. 5 CEV-positive rate of farms according to various species of common carps
2 结 果
2.1 重点调查的“鲤急性烂鳃病”养殖场的CEV和KHV检测结果
在河北、河南、辽宁、内蒙古自治区、北京等5个省市重点调查了26家正在发生或曾经发生过“鲤急性烂鳃病”的养殖场。22个正发病的养殖场中, 19个场检测为CEV阳性、KHV阴性; 1个养殖场为CEV阴性、KHV阳性; 另2个养殖场CEV、KHV均为阴性, 其中1个养殖场病鱼鳃丝上检测到大量孢子虫。4个曾发病的养殖场中, 1个检测为CEV阳性、KHV阴性; 3个养殖场CEV、KHV均为阴性; 检测结果详见表1。可见近年来河北、河南、辽宁、北京、内蒙古自治区等地区养殖的鲤或锦鲤暴发的“鲤急性烂鳃病”主要病因应为CEV感染, 还有少数病例为KHV感染或寄生虫感染等其他原因。
在重点调查发生CEVD的养殖场中, 规格3—40 cm的鲤、2—25 cm的锦鲤均会发病, 发病场养殖鱼类的死亡率多数在20%—50%, 个别养殖场死亡率60%以上。发生高死亡率的养殖场均是在发病过程中采取了滥用药物、大换水等刺激性措施。
2.2 CEV流行学监测特点
养殖场CEV的阳性率:在9个省市的97家鲤和锦鲤养殖场中, 50家养殖场检测结果为CEV阳性,阳性率52%。
地区分布:监测的黑龙江、辽宁、河南等9个省市的鲤和锦鲤养殖场, 都检出了CEV阳性。其中河南养殖场的CEV阳性率最高, 为68%, 随后是辽宁60%和北京55%。山西和陕西养殖场的CEV阳性率相对较低, 均为20% (表2)。将不同省市来源的CEV阳性养殖场的检出率进行方差分析, 结果地区对CEV的检出率的影响无显著差异(P>0.05)。将中东部地区(黑龙江、辽宁、北京和河南)的CEV阳性养殖场的检出率与西部(内蒙古自治区、山西、陕西、宁夏回族自治区和新疆维吾尔自治区)的检出率进行方差分析, 结果它们之间也无显著差异(P>0.05)。以上结果表明CEV至少已经在这9个省市的鲤和锦鲤养殖场中流行, 并且CEV的流行地区之间检出率无显著差异。
水温分布:监测的97家鲤和锦鲤养殖场中, 采样时水温在12—20℃的养殖场16家, 6家CEV检测为阳性, 阳性率38%; 采样时水温在20—27℃的养殖场81家, 44家CEV检测为阳性, 阳性率54%; 即CEV的感染水温至少包括12—27℃ (表3)。采样水温在20—27℃组的CEV的阳性率高于水温在12—20℃组, 但方差分析2组之间无显著差异(P>0.05), 提示在一定温度范围内, 水温对鲤和锦鲤的CEV检出率影响不显著。
规格分布:监测的97家鲤和锦鲤养殖场中, 样品鱼规格在1—12 cm的养殖场57家, 31家CEV检测为阳性, 阳性率54%; 样品鱼规格在12—30 cm的养殖场40家, 19家CEV检测为阳性, 阳性率48%; 即CEV感染鱼的规格至少包含体长1—30 cm (表4)。样品鱼规格1—12 cm组养殖场的CEV阳性检出率略高于样品鱼规格12—30 cm组, 但方差分析结果表明两组之间无显著差异(P>0.05), 提示我们规格对鲤和锦鲤的CEV感染率无显著影响。
品种分布:监测的97家鲤和锦鲤养殖场中,40家锦鲤养殖场, 24家CEV阳性, 阳性率60%; 57家鲤养殖场, 26家CEV阳性, 阳性率46% (表5)。锦鲤养殖场的CEV检出率高于鲤养殖场, 但方法分析表明两者之间无显著差异(P>0.05), 提示鲤和锦鲤的CEV感染率无显著差异。
流行的基因型:获得的北京、辽宁、河南等地的8个CEV毒株p4a基因部分序列, 构建无根进化树(图1)。分析表明, 8个序列均属于GenogroupⅡa型。其中河南毒株20170518-2、20170913-1和辽宁毒株20170706-1、20170706-2、20170706-3与英国毒株R083、P054 1.3和日本毒株CyPP-3关系较近。北京毒株20170505-1与英国毒株Q098、M141、R082 1.4、R004 1.2及波兰毒株687—2014、274—2014、518—2014关系较近。
3 讨 论
调查发现早在2003年河南等地就零星出现“鲤急性烂鳃病”病例, 2007—2013年病例逐年增多, 此后不同年份严重程度不一[2]。该病一般发生在5—7月及9月, 发病时间持续7—10d, 仅鲤和锦鲤发病。病鱼出现头部凹陷、发黑, 鳃丝发黑肿胀或烂鳃, 凹眼, 昏睡等症状。该病的发病特点和症状与已报道的KHVD和CEVD的特征最相符(表6); 但也可能是细菌性烂鳃病、寄生虫病或其他疾病。然而养殖者采用杀虫药、抗菌药、消毒药、换水等方式无法防治该病, 送检的病鱼也多数检测不到柱状黄杆菌和/或某种大量寄生虫, 因此基本可以排除后者。CEVD在我国确诊比KHVD晚十多年, 一直未被怀疑, 直到2016年CEVD在我国确诊[6—8], 开始怀疑CEV可能与该病有关。徐立蒲等[9]对河南暴发 “鲤急性烂鳃病” 的养殖场调查, 认为主要病因应为CEV感染。本研究在河北、河南、辽宁、北京、内蒙古自治区等5省市26家疑似发生“鲤急性烂鳃病”的养殖场调查, 发现CEV阳性率高达77%,而KHV仅为4%, 确认CEV感染是目前“鲤急性烂鳃病”的主要病因。
CEV和KHV均为DNA病毒, 均可感染鲤和锦鲤, 并引起烂鰓、凹眼等相似的症状。但二者也存在一些差异, 2种病发病水温有不同, 前者发病水温范围较广, 在7—27℃都有发病, 而后者发病水温在16—30℃。在发病鱼上多次观察到感染CEV的鱼鳃丝有肿胀现象, 鳃丝有时呈黑色, 剪破后流出的血液迅速凝结; 有昏睡症状, 发病小鱼还出现鱼体浮肿症状[14]; 而感染KHV的鱼还未见此类症状报道[18]。
20世纪70年代CEV首先在日本报道[19], 之后很长一段时间仅在日本流行。1999年以后, 美国、欧洲多国、印度、巴西、中国等陆续从发病的锦鲤和鲤上检出[6—8,13,14,20—26]。2013—2015年, Matras等[13]监测了波兰的36个鲤和锦鲤场, 17个CEV阳性场,阳性率达47%。本次的CEV随机监测发现, 监测的9省市中CEV阳性养殖场的比率从20%—68%不等,总体上CEV阳性养殖场的比率高达52%, 这与波兰情况相似。而影响鲤和锦鲤养殖的另外2种重要的病毒KHV和SVCV, 我国2016年专项监测显示阳性养殖场比率仅分别为1.8%和9.3%[27], 都远低于CEV的检出率。结合CEV感染是“鲤急性烂鳃病”的主要病因的结果, 提示CEV已成为对我国鲤和锦鲤养殖业危害最严重的病原。
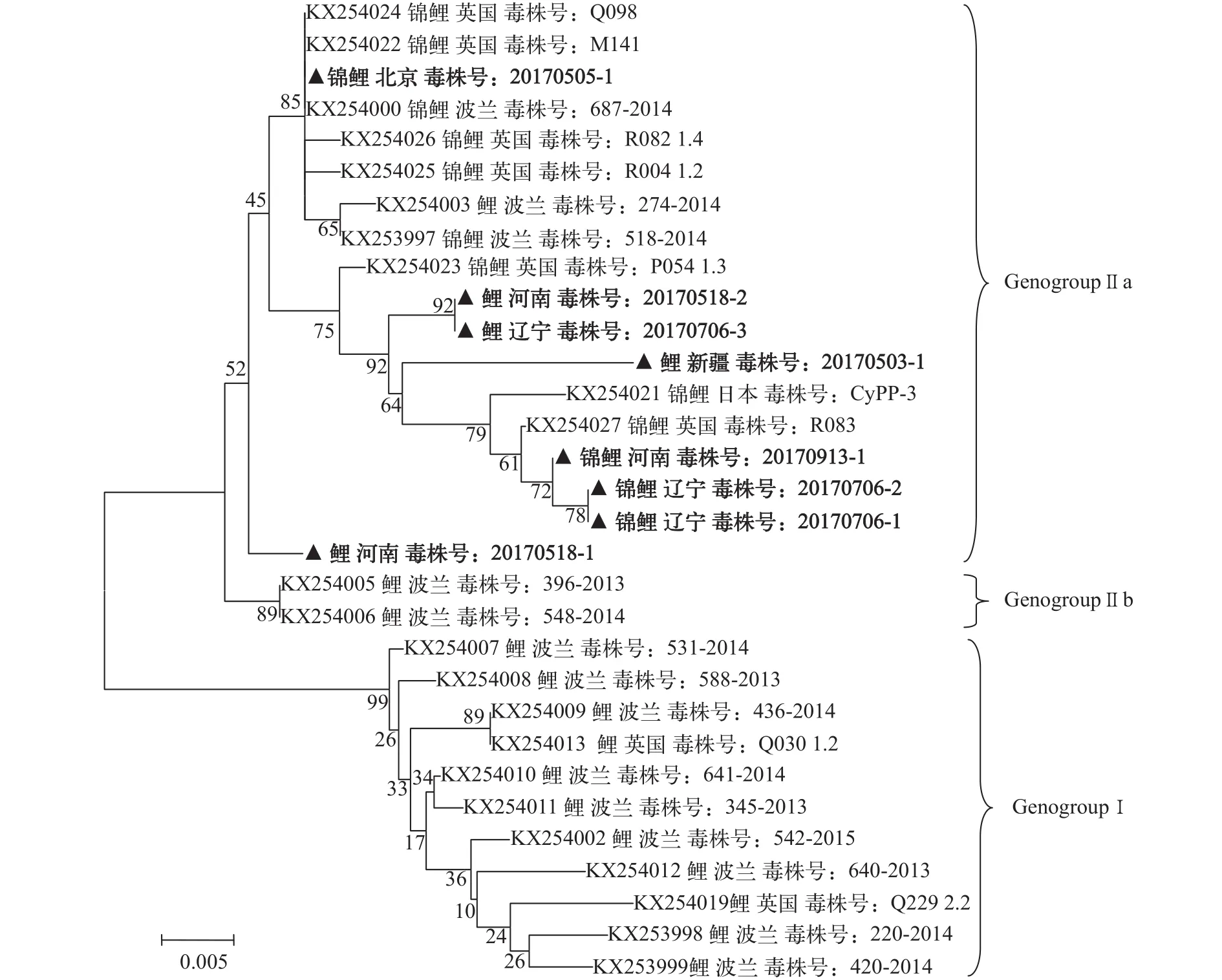
图1 基于CEV p4a基因部分序列构建的无根进化树Fig. 1 Unrooted phylogenetic tree based on partial p4a gene sequence of CEV
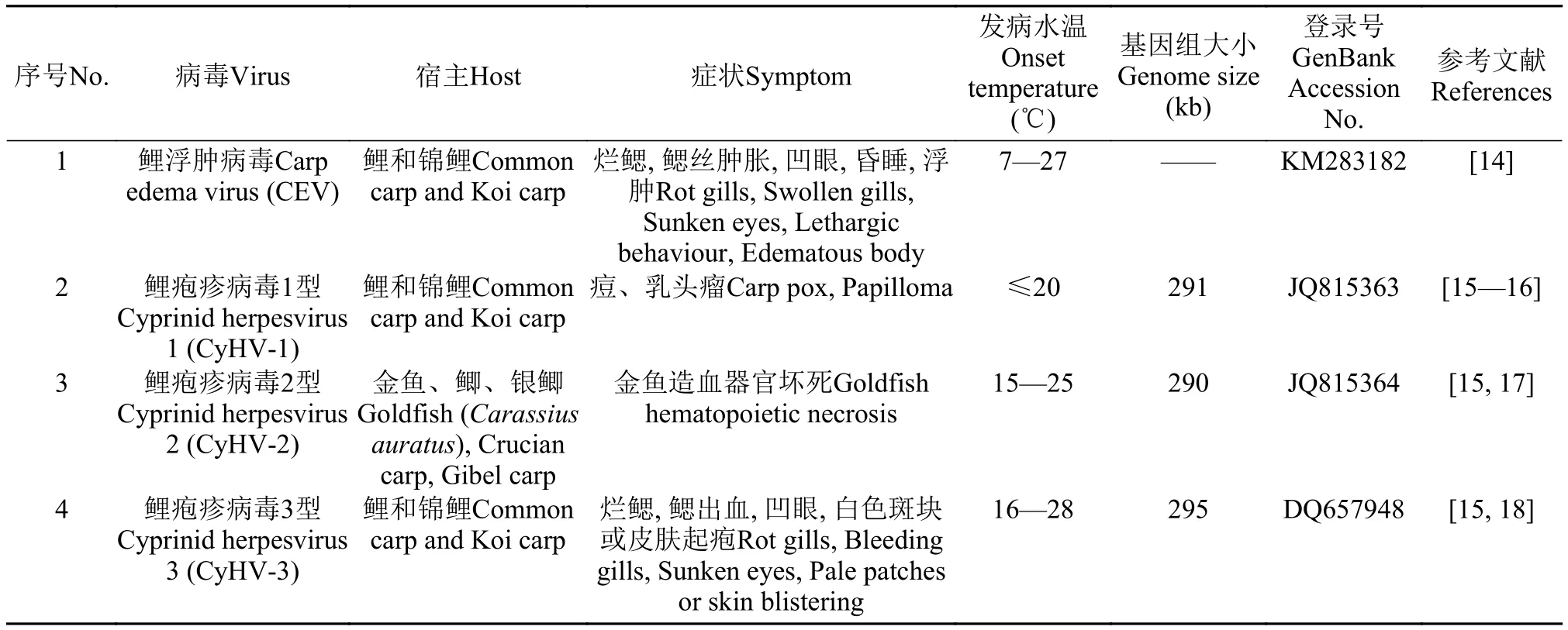
表6 CEV与鲤疱疹病毒的信息比较Tab. 6 Comparing biological information among Cyprinid herpesvirus infected by CEV
据报道CEV的感染水温为7—27℃[10]。本文检出CEV的采样水温分布在12—27℃, 由于水温12℃以下和27℃以上未采集样品, 还无法确定这些水温下我国养殖场是否存在CEV感染情况。将样品按采集温度以20℃为分界限划分的两组之间在CEV检出率上并没有显著差异, 这表明在一定温度范围内, CEV并没有最适宜的感染水温; 在进行CEV监测时, 水温不是影响检出率的主要因素。这与SVCV检出水温集中在11—17℃[28]和KHV检出水温主要在16—28℃[27]明显不同(表6)。调查和监测发现各规格的鲤或锦鲤均可感染CEV, 且没有对特定鲤品种或特定规格鱼感染的选择性, 这与国外报道的观点一致[13,20—26]。2013年, 英国Way等[25]根据CEV病毒的p4a基因部分序列将CEV基因型划分为Genogroup Ⅰ型和GenogroupⅡ型, 其中Ⅰ型毒株仅感染鲤, Ⅱ型毒株感染鲤和锦鲤。2016年, Matras等[13]按此基因, 发现Ⅱ型又可分为Ⅱa型和Ⅱb型, 其中Ⅱa型毒株感染鲤和锦鲤, Ⅱb型毒株感染鲤。本次调查检出的8株CEV属于Ⅱa型, 我国浙江、云南检出的CEV也属于Ⅱa[8,29], 提示目前我国CEV流行的主要基因型为GenogroupⅡa型。
对发生CEVD的养殖场重点调查结果表明, 发生CEVD前普遍存在换水、倒池、水质突变、天气突变、鱼药使用等情况, 这些情况会使养殖鱼产生应激, 而鱼感染病毒后体质下降遭遇应激后易发病。有的养殖场在发病后滥用各种鱼药, 结果导致鲤更大规模死亡; 在发病后用药少的养殖场反而鲤死亡率较低。国外的研究也表明, 应激是养殖的鲤发生CEVD的主要诱因[30]。因此养殖场要提高养殖管理水平, 在发病前后避免滥用药等能导致鱼体产生应激反应的情况, 是防控CEVD和降低损失的有效措施。
致谢:
感谢河南省、河北省、辽宁省、内蒙古自治区、陕西省、新疆维吾尔自治区、黑龙江省、宁夏回族自治区、山西省等水产技术推广站在调查时给予的大力支持; 感谢江育林研究员对全文进行的审阅与修改。

