不同条件对两株乳酸菌降解生物胺的影响
毛 顺,黄笠原,张惠超,李蕊婷,王勇勤,卢士玲
(石河子大学食品学院,新疆石河子 832000)
食品中生物胺的累积呈动态变化主要是由两类微生物引起的:一类是产氨基酸脱羧酶的微生物,它可以催化氨基酸脱羧形成生物胺;另一类是产生生物胺氧化酶的微生物,它可以通过催化生物胺产生醛,氨和过氧化氢,从而降解已经存在的生物胺。
食品基质往往比较复杂,生物胺除了受微生物影响外,还受很多外部因素影响,如添加物葡萄糖、乳糖、亚硝酸盐、香辛料等可以减少生物胺的产生[1-2],对食品进行辐照、超高压处理也可以减少食品中的生物胺[3-5],Nei[6]研究发现,将金枪鱼和鲱鱼在35 kGyγ-射线照射杀菌处理后,贮藏7 d后没有发现生物胺的积累,这些方法都是通过降低产胺微生物活性来达到减少生物胺效果的。不同食品在加工过程中的pH、温度、盐度、乙醇含量有很大差异。此外,食品中生物胺的量也会影响上述两种微生物对生物胺的作用。
本研究通过前期从新疆熏马肠中筛选出来的两株生物胺氧化酶菌株(植物乳杆菌与唾液乳杆菌),分析了8种不同浓度的生物胺对两株乳酸菌降解生物胺的影响,以及一些环境因素(pH、温度、NaCl浓度、乙醇浓度)对两株乳酸菌降解生物胺性能和生长的影响。以期为该菌株在食品中的应用提供理论基础。
1 材料与方法
1.1 材料与仪器
1株植物乳杆菌(Lactobacillusplantarum),登录号为KU555358、1株唾液乳杆菌(Lactobacillussalivarius),登录号为KU555364 均为本实验室筛选;生物胺标准品:色胺、尸胺、苯乙胺、组胺、腐胺、酪胺、精胺、亚精胺 色谱纯,美国Sigma公司;甲醇、乙腈 色谱纯,赛默飞世尔科技(中国)有限公司;丹磺酰氯 色谱纯,美国Sigma公司;MRS培养基 北京奥博星生物试剂公司。
LDZX-40型立式压力蒸汽灭菌锅 上海申安医疗器械厂;ZHWY-1111型落地普通型大容量恒温培养振荡器 上海智城分析仪器制造有限公司;LC-2010AHT型高效液相色谱仪 日本岛津公司;DNP-9272型恒温培养箱 上海精宏有限公司;KQ-250B型超声波清洗器 江苏同君仪器科技有限公司;UB-7型pH计 美国赛多利斯丹佛公司。
1.2 实验方法
1.2.1 高效液相(HPLC)验证菌种降解生物胺能力
1.2.1.1 生物胺标准溶液的配制 分别配制浓度为1000 μg/mL的组胺、酪胺、苯乙胺、色胺、腐胺、尸胺、精胺和亚精胺生物胺标准储备液,均用0.4 mol/L的高氯酸将其溶解,并稀释成50.0、125.0、250.0、500.0、1000.0 μg/mL的生物胺标准溶液。
1.2.1.2 柱前衍生 按照Lu等[7]的方法进行衍生。取1.2.1.1的标准溶液与处理好的样品处理液各1 mL于5 mL的棕色容量瓶中,加入200 μL的2 mol/L NaOH,摇匀后加入300 μL饱和NaHCO3溶液进行缓冲,然后再加入2 mL的丹磺酰氯溶液(Dns-Cl,10 mg/mL溶于丙酮),摇匀后将其放置于40 ℃的黑暗环境中反应45 min后,加入100 μL的氨水以除去过多的Dns-Cl,最后用乙腈定容至刻度。衍生结束后,用0.22 μm滤膜将其过滤于进样瓶中。
1.2.1.3 色谱条件 Agilent C18柱(XDB-C18,4.6 mm×250 mm,5 μm);流动相A为水,流动相B为乙腈;流速为0.8 mL/min;进样量为20 μL;柱温:30 ℃;检测波长:254 nm。梯度洗脱程序如表1所示。

表1 梯度洗脱程序Table 1 Gradient elution program
1.2.2 种子液的制备 将保藏的2株微生物在MRS液体培养基中活化3次后进行平板计数,将活化后的培养液吸取1 mL,逐级稀释,选取3个合适梯度涂布,于37 ℃条件下培养48 h,将液体培养基放入4 ℃冰箱中。计数后液体培养基稀释至107CFU/mL,此液体即为种子液。
1.2.3 微生物对单种生物胺的降解作用 分别配制含单种生物胺浓度为100、200、300、400、500、600 μg/mL的MRS培养基,灭菌后,将1.2.2中的种子液各接种1 mL于MRS培养基(9 mL)中,调节pH为6.3,在37 ℃条件下培养48 h,对照组不接种生物胺。取菌悬液2 mL,12000 r/min离心10 min,离心后取1 mL上清液,将1 mL高氯酸(0.4 mol/L)添至上清液中混匀以溶解生物胺作为样品处理液,之后按1.2.1.2进行衍生化,-20 ℃避光保存、待测。生物胺的降解效果用降解率表示。
式中:W1为不加生物胺的对照组;W2为加了生物胺的样品组。
1.2.4 温度对生物胺降解的影响 将1.2.2的菌株种子液接种1 mL到含有8种生物胺各100 μg/mL的液体培养基中,调节pH为6.3,分别在22、27、32、37、42 ℃条件下培养24 h,对照组不接种生物胺。取菌悬液1 mL,逐级稀释,选取3个合适的梯度涂布,在37 ℃下培养48 h后在MRS固体培养基上做平板计数,其余操作同1.2.3。
1.2.5 pH对生物胺降解的影响 将1.2.2的菌株种子液接种1 mL到含有8种生物胺各100 μg/mL的液体培养基中,分别调节pH为5.5、6.0、6.5、7.0、7.5,在37 ℃培养24 h,对照组不接种生物胺。其余操作同1.2.4。
1.2.6 NaCl添加量对生物胺降解的影响 将1.2.2的菌株种子液接种1 mL到含有8种生物胺各100 μg/mL的液体培养基中,添加NaCl使其浓度分别为0、2%、4%、6%、8%,调节pH为6.3,在37 ℃培养24 h,对照组不接种生物胺。其余操作同1.2.4。
1.2.7 乙醇对生物胺降解的影响 将1.2.2的菌株种子液接种1 mL到含有8种生物胺各100 μg/mL的液体培养基中,添加乙醇使其浓度分别为0、1.5%、3.0%、4.5%、6.0%,调节pH为6.3,在37 ℃培养24 h,对照组不接种生物胺。其余操作同1.2.4。
1.3 数据处理
试验数据通过SPSS软件统计分析,采用Origin 8.5作图,使用邓肯式多重比较在5%水平来评估处理样品之间差异的显著性,以p<0.05为差异显著,p>0.05为差异不显著,以p<0.01为差异极显著,所有试验重复测定3次。
2 结果与分析
2.1 微生物对不同浓度梯度生物胺的降解作用
由表2可以看出,随着生物胺浓度的增加,两株菌对生物胺的降解能力先增加再逐渐减少。当生物胺浓度在200~300 μg/mL时两株菌生物胺降解能力基本达到最大,而当生物胺浓度大于300 μg/mL时两株菌降解生物胺的能力逐渐减小。植物乳杆菌对色胺的降解能力显著高于唾液乳杆菌(p<0.05),当胺浓度为300 μg/mL时降解率最大达到41.73%。而在对苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺和精胺降解方面,相对于植物乳杆菌,唾液乳杆菌表现出更好的降解能力(p<0.05),对组胺和酪胺的最大降解率可分别达到36.53%和32.13%。

表2 两株菌对不同浓度梯度生物胺的降解作用Table 2 Two strains on the degradation of biogenic amines in different concentrations of biogenic amines
总的来说,除了在色胺方面是植物乳杆菌表现出较好的降解能力,对于其余生物胺,均是唾液乳杆菌表现出更佳的降解能力。Bartkiene等[8]报道了LactobacillusplantarumZY-40能将鲢鱼香肠中腐胺和尸胺的含量降低70%以上,但不影响酪胺的积累。Zhang等[9]研究表明,烟熏前用乳酸菌处理对尸胺、亚精胺的减少具有积极作用,在烟熏后以乳酸菌处理香肠表面,可使香肠外层和中心的腐胺含量显著降低或完全消除。佟婷婷[10]对四川泡菜中乳酸菌研究表明,LactobacillusplantarumM6能够高效降解生物胺,其降解作用与sufI基因密切相关,发现sulfI基因表达产物个别位点的差异会使得菌株之间对生物胺的降解能力存在差异,推测这可能是植物乳杆菌和唾液乳杆菌对生物胺降解能力不同的原因,但也不排除其他潜在生物胺降解机制的因素影响。
2.2 温度对生物胺降解效果的影响
温度对两株菌降解生物胺的影响见图1,可以看出两株菌都在32~37 ℃范围内对生物胺有较好的降解效果,偏离这些范围,降解能力都受到不同程度的抑制。其中植物乳杆菌降解效果最明显的生物胺是色胺和尸胺,都在37 ℃时达到最佳降解效果,降解率分别为42.55%和36.62%;唾液乳杆菌对组胺和尸胺降解效果最好,在32 ℃时对组胺降解率达到38.63%,而对尸胺的降解效果在32和37 ℃时几乎一致,降解率分别为33.64%和33.61%。但从整体趋势来看,唾液乳杆菌的降解效果优于植物乳杆菌,在32~37 ℃范围内,唾液乳杆菌对生物胺的降解率均超过了16.41%,而植物乳杆菌最低降解率为11.53%。两株菌均在22 ℃时对生物胺降解效果最差,这可能由两方面原因造成,一方面是低温环境降低了微生物活性,另一方面是此温度下降解生物胺的酶的活性被强烈抑制。相关学者也有类似的报道,如Sugawara等[11]从AspergilluscarbonariusAIU 205提取的3种氧化酶在20 ℃时其活性仅为20%,而在40 ℃时却可表现出最佳活性。
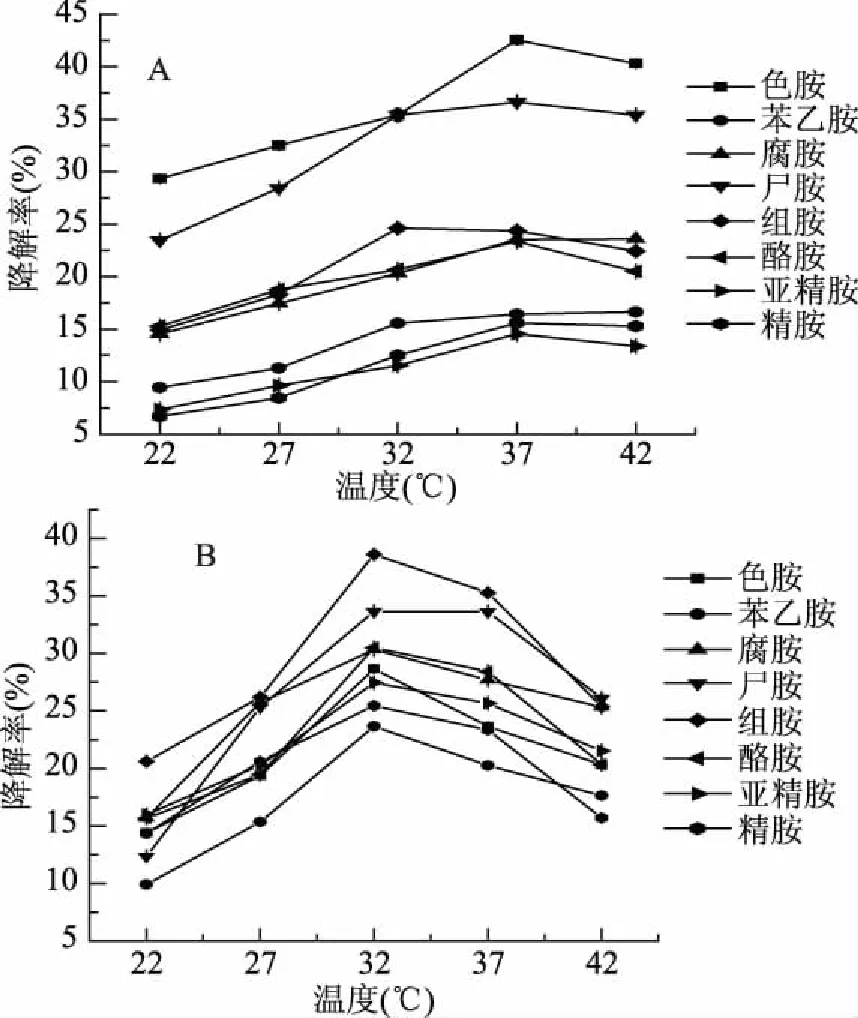
图1 温度对植物乳杆菌(A)和唾液 乳杆菌(B)降解混合生物胺的影响Fig.1 Effects of temperature on the degradation of mixed biogenic amines by Lactobacillus plantarum(A) and Lactobacillus salivarius(B)strains
2.3 pH对生物胺降解效果的影响
初始pH对两株菌降解生物胺的影响见图2,可以看出pH对微生物降解生物胺能力的影响随着pH的增大呈现先增长后下降的趋势,两株菌都在pH6.0~7.0的范围内有良好的降解效果。在pH6.0~6.5的范围内,植物乳杆菌对除了苯乙胺外的其他胺均有较好的降解效果;在pH6.5~7.0的范围内,唾液乳杆菌对除了亚精胺外的其他胺均有较好的降解效果。其中植物乳杆菌降解色胺、腐胺、组胺和酪胺的最适pH为6.5,对苯乙胺和尸胺最佳降解pH为6.0,对色胺和尸胺最大降解率分别为42.57%和37.46%。唾液乳杆菌降解组胺、亚精胺的最适pH为6.5,对色胺、苯乙胺、腐胺、酪胺和精胺的最佳降解pH为7.0。对组胺、色胺、腐胺和酪胺的最大降解率分别为37.2%、31.68%、32.44%和32.41%。在pH为5.5和7.5时对大多数生物胺的降解效果都有所降低,这可能是这些pH下微生物和生物胺氧化酶活性受到抑制的缘故。之前有报道表明微生物在偏酸或偏碱的环境中对生物胺的降解能力大幅度降低,如MicrococcusvariansLTH1540降解酪胺的最适pH为7.0~8.0,在pH偏酸和偏碱的环境中,其会丧失对酪胺的降解活性[12];NatrinemagariHDS3-1降解组胺的最适pH为6.5~8.0,在pH为4.0~4.5的酸性环境中丧失降解活性[13],报道的两株微生物均适宜在偏中性环境中发挥作用,与本研究基本一致。
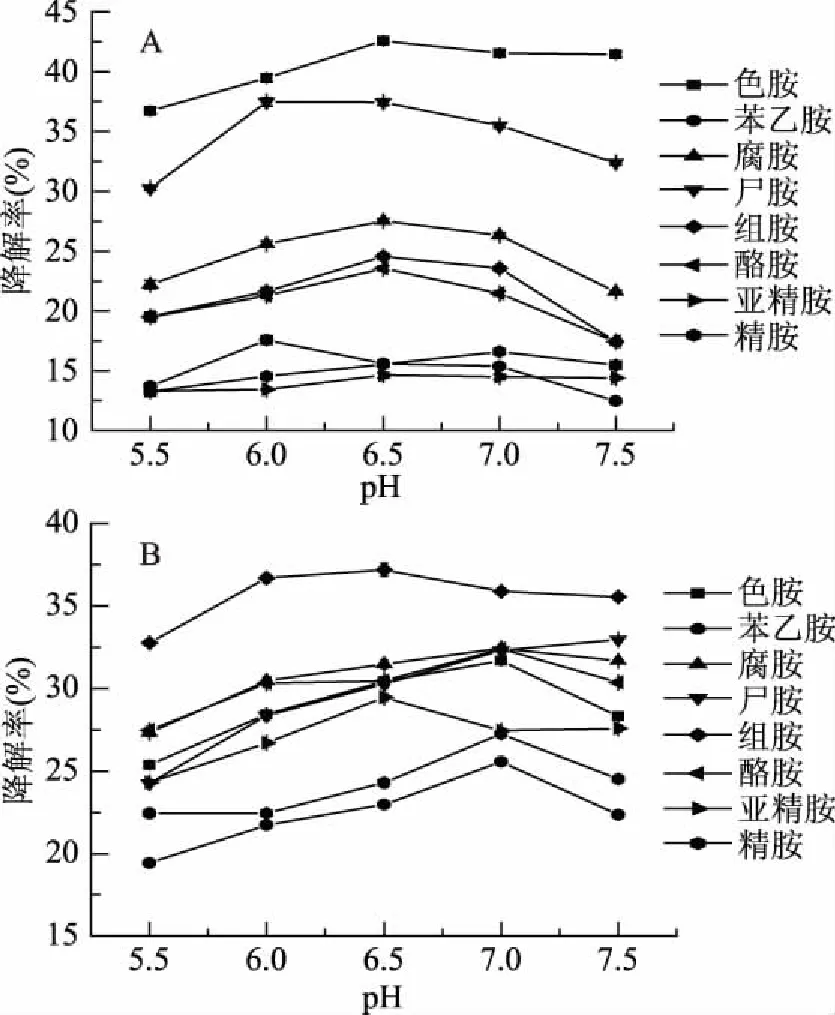
图2 初始pH对植物乳杆菌(A) 和唾液乳杆菌(B)降解混合生物胺的影响Fig.2 Effects of initial pH value on the degradation of mixed biogenic amines by Lactobacillus plantarum(A) and Lactobacillus salivarius(B)strains
2.4 NaCl浓度对生物胺降解效果的影响
NaCl浓度对两株菌降解生物胺的影响见图3,可以看出两株菌对生物胺的降解能力随着NaCl浓度的增加缓慢下降。植物乳杆菌对亚精胺的降解效果在NaCl浓度为2%时达到最大值,降解率为17.44%;对酪胺的降解效果在NaCl浓度为4%时最好,降解率为22.53%;对于其它生物胺,均在NaCl浓度为0%时有较高的降解能力。

图3 NaCl浓度对植物乳杆菌(A) 和唾液乳杆菌(B)降解混合生物胺的影响 Fig.3 Effects of NaCl concentration on the degradation of mixed biogenic amines by Lactobacillus plantarum(A) and Lactobacillus salivarius(B)strains
整体来看,除了组胺外,在NaCl浓度0~4%范围内,植物乳杆菌对其它生物胺的降解效果变化都在3%以内,降解率均在15%以上。当NaCl浓度为2%时,唾液乳杆菌对色胺、苯乙胺和尸胺降解效果达到最大值,对腐胺、组胺、酪胺、亚精胺和精胺的降解效果在NaCl浓度为0%时最好。同植物乳杆菌一样,在NaCl浓度0%~4%范围内唾液乳杆菌对生物胺表现出较高的降解率。当NaCl浓度达到4%时,两株菌对8种生物胺降解率下降幅度较小,可能是由于在低盐的浓度范围内,微生物活性几乎不受抑制。NaCl在微生物生长中起重要作用,并影响其氨基酸脱羧酶的活性。Gardin等[14]发现,在奶酪中添加5%浓度的NaCl能抑制酪胺和苯乙胺的产生以及生物胺产生菌的生长,但并不是NaCl浓度越高就一定能降低生物胺的含量。当NaCl浓度在5%~20%时,盐水四联球菌的组胺产生率大大降低[15]。头状葡萄球菌,阴沟肠杆菌和成团泛菌的组氨酸脱羧酶活性也被高浓度NaCl抑制[16-17]。这种现象可归因于在高浓度NaCl条件下细胞数量降低以及位于细胞膜上的微生物脱羧酶位点受到干扰。作为对比,一项研究[18]报道NaCl增强了从腌渍凤尾鱼中分离的耐盐葡萄球菌属组氨酸脱羧酶的活性。因此,可以认为NaCl抑制和刺激生物胺产生的作用是菌株特异性的。以上结果说明两株菌在低于4%浓度的NaCl的体系中降解生物胺效果最佳,而在NaCl浓度4%~6%的体系中能发挥一定程度的生物胺降解性能。
2.5 乙醇浓度对生物胺降解效果的影响
乙醇浓度对两株菌降解生物胺的影响见图4,可以看出两株菌对生物胺的降解作用随着乙醇浓度的增加呈快速下降趋势。

图4 乙醇浓度对植物乳杆菌(A) 和唾液乳杆菌(B)降解混合生物胺的影响Fig.4 Effects of ethanol concentration on the degradation of mixed biogenic amines by Lactobacillus plantarum(A) and Lactobacillus salivarius(B)strains
在0~1.5%的浓度范围内,对生物胺的降解能力变化不大;当乙醇浓度达到6%时,对大多数的生物胺的降解能力减少在50%以上,这可能是由于微生物在该乙醇浓度下活性受到抑制,也可能是由于乙醇对生物胺氧化酶产生抑制作用所造成的。乙醇不仅可以抑制生物胺氧化酶活性,还可以增加肠道对生物胺的吸收作用,因此在食用酒精类食品或者和含生物胺食品共同食用时更容易引起生物胺中毒[19-20]。因此,植物乳杆菌和唾液乳杆菌只有在低于1.5%浓度的乙醇体系中才能发挥较好的生物胺降解作用。
2.6 不同外部条件对两株菌生长的影响
不同外部条件(初始pH、温度、NaCl浓度和乙醇浓度)对两株菌生长的影响见图5。可以看出随着pH和温度的变化,微生物数量呈先上升后下降的趋势,在初始pH为6.0~7.0,温度27~37 ℃时,微生物拥有较高的活菌数,表明此条件比较适宜微生物生长,同时在此条件下,微生物对生物胺也有较高的降解能力,这一结果与获得的pH和温度对生物胺的降解结果一致(图1和图2)。Zaman等[21]测定了StaphylococcuscarnosusFS19在不同pH下的活菌数以及对组胺降解能力的变化,发现该菌在pH6.0~8.0的范围内有较高的活菌数,在5.0~7.0的pH范围内对组胺降解效果最好。NaCl浓度和乙醇浓度对微生物生长的影响都是随着其浓度上升微生物数量先缓慢下降后快速下降,这与前面对生物胺降解能力变化的研究一致(图3和图4)。唾液乳杆菌在NaCl浓度为2%时活菌数最高,在此条件下该菌对色胺、苯乙胺和尸胺也拥有较高的降解能力。而当NaCl浓度达到4%时,对生物胺降解率变化也加快,说明生物胺的变化与微生物生长密切相关。

图5 不同外部条件对两株菌生长的影响Fig.5 Effects of external conditions on the growth of 2 strains
3 结论
通过比较两株微生物(植物乳杆菌和唾液乳杆菌)在不同浓度梯度下对生物胺的降解效果,当生物胺浓度在200~300 μg/mL时两株菌生物胺降解能力基本达到最大,而当生物胺浓度大于300 μg/mL时两株菌降解生物胺的能力逐渐下降。从总体来看,唾液乳杆菌对生物胺的降解效果显著优于植物乳杆菌(p<0.05)。
研究两株微生物在不同外部条件下(初始pH、温度、NaCl浓度和乙醇浓度)对生物胺降解效果以及生长情况得出,植物乳杆菌和唾液乳杆菌分别在pH6.5和7.0时对大多数生物胺具有较高的降解活性;两株菌均在32~37 ℃范围内对生物胺有较好的降解效果,并在此最适pH和温度条件下具有较高的活菌数与较强的生物胺降解能力;当NaCl浓度达到8%,乙醇浓度达到4.5%时,两株菌对生物胺的降解活性被强烈抑制,同时活菌数也急剧下降。
本研究的结果为肉类加工企业提供了有价值的信息,选择合适的商业发酵剂,为消费者生产出高质量和更健康的产品。在本研究的基础上,相对于植物乳杆菌,唾液乳杆菌具有生产出更低生物胺产品的潜能。

