一株广域pH耐受性微小噬菌体αα的分离、纯化及生理学特性分析
李梦哲,林 洪,王静雪,鞠 磊
(中国海洋大学食品科学与工程学院,山东青岛 266003)
沙门氏菌是革兰氏阴性菌,为人畜共患病原菌,是食源性致病菌的主要来源。沙门氏菌具有2600多种血清型[1],分为6个亚种[2]。沙门氏菌引起的疾病主要包括4种症状,如伤寒、腹泻、菌血症以及慢性无症状携带者[3]。然而,近年来随着抗生素的大量使用,其耐药现象和药物残留等问题日益凸显。越南对肉制品抗生素残留以及菌株耐药性的调查发现,胡志明市的117份鸡肉、猪肉、牛肉样品中非伤寒沙门氏菌的检出率为68.4%,具有多重耐药性的菌株占52.2%[4]。周志洪等在2015年12月和2016年4月在珠江广州段水体中分别检出18种(ND~642 ng/L)和20种抗生素(ND~703 ng/L),大部分断面总抗生素属于高风险范围[5],支威等对江苏省徐州市采集的500份猪肉样品进行调查,60株分离的沙门氏菌中无菌株对所测药物均敏感,耐2种以上药物的菌株达100%,且有一株菌株同时耐10种抗菌药物[6]。因此,寻找完全或部分替代抗生素的生物抑菌剂尤为重要。经过前期研究发现,噬菌体具有专一性、易增殖、抗性菌株产生率低以及高效抑菌等特点[7-9],成为替代抗生素的有力工具。
噬菌体是一种细菌病毒,广泛存在于不同的生态环境中,如海洋生态系统、淡水河流等,平均浓度高达107个/mL[10]。自然界存在的噬菌体多为双链DNA病毒,主要分为肌尾病毒科(Myoviridae)、短尾病毒科(Podoviridae)、长尾病毒科(Sphoviridae)。GenBank上已上传全序列的噬菌体生物信息表明,双链DNA噬菌体占噬菌体总数的80%以上[11]。微小噬菌体(Microviridaephage)是一类侵染细菌的单链DNA病毒,至今对其研究仍有不足[10]。按照Virus Toxomony:2016 Release报告分类,微小噬菌体科(Microviridae)分为Bullaviridae和Gokushoviridae两个亚科。已有研究表明,单一噬菌体、噬菌体混合液或者噬菌体与其他抑菌物质协同作用可以有效降低食品中食源性病原菌的水平,减少致病菌在动物体内外的污染[12-14],从而更好地应用于生产生活中。微小噬菌体因核酸组成为单链DNA,遗传稳定性介于RNA噬菌体和双链DNA噬菌体之间[15],于是可通过诱导突变获得裂解不同宿主菌的噬菌体突变株[16],有利于将其应用于沙门氏菌的防控中。
本研究以鼠伤寒沙门氏菌为宿主菌株,采用双层平板法分离纯化获得了一株微小噬菌体αα,利用电镜观察其形态特征,并通过琼脂糖凝胶电泳分析其核酸组成,并对其生理特性(包括一步生长曲线、温度耐受性、pH耐受性、裂解谱、最佳离子浓度和最佳感染复数)进行研究,以期为沙门氏菌的防控提供有效的生物抑菌剂,也为今后微小噬菌体的进化研究、应用研究等奠定基础。
1 材料与方法
1.1 材料与仪器
用于噬菌体的分离筛选的100份水样 来自青岛市污水处理厂污水、家禽市场污水、生活小区下水道污水、湖水、海水等;噬菌体αα分离自青岛市污水处理厂污水,保藏于中国典型培养物保藏中心(China Center for Type Culture Collection,CCTCC),保藏号为CCTCC M 2017078;鼠伤寒沙门氏菌SalmonellaTyphimuriumATCC 14028,鼠伤寒沙门氏菌SalmonellaTyphimuriumATCC 13311,伤寒沙门氏菌Salmonellaentericaserovar Typhi ATCC 19430,肠炎沙门氏菌SalmonellaEnteritidisCMCC 50041,甲型副伤寒沙门氏菌SalmonellaentericaserovarParatyphi A CMCC 50001,乙型副伤寒沙门氏菌SalmonellaentericaserovarParatyphi B CMCC 50094,大肠杆菌EscherichiacoliBL21(DE3),副溶血弧菌VibrioparahaemolyticusATCC 17802,腐败希瓦氏菌ShewanellaputrefaciensCCTCC AB2010225,李斯特菌ListeriamonocytogenesCMCC54001 实验室保存菌株;肠炎沙门氏菌SalmonellaEnteritidisN16444 美国Clemson University的Dr. Xiuping Jiang赠与;LB肉汤培养基、LB琼脂培养基 北京陆桥技术有限责任公司;乙二胺四乙酸(Ethylenediaminetetraacetic acid,EDTA) 分析纯,上海索莱宝生物科技有限公司;氯化钠、七水合硫酸镁 分析纯,国药集团化学试剂有限公司;三羟甲基氨基甲烷(Tris) 分析纯,上海索莱宝生物科技有限公司;浓盐酸 分析纯,莱阳经济技术开发区精细化工厂;核糖核酸酶A(RNase A) 赛默飞世尔科技(中国)有限公司;重组脱氧核糖核酸酸I(rDNase I) 宝生物工程(大连)有限公司;绿豆核酸酶(Mung Bean Nuclease) 宝生物工程(大连)有限公司;盐水镁(SM)缓冲液(1 L) 由5.8 g NaCl,2 g MgSO4·7H2O,50 mL 1 mol/L pH7.5 Tris-HCl缓冲液,加蒸馏水至1000 mL,121 ℃高压灭菌15 min后制成。
HZQ-F100型振荡培养箱 哈尔滨市东联电子技术开发有限公司;Sigma 3K15型高速冷冻离心机 曦玛离心机(上海)有限公司;MLS-3750型高压蒸汽灭菌锅 日本Sanyo公司;Power Wave XS型酶标仪 美国Biotek公司。
1.2 实验方法
1.2.1 噬菌体的分离、纯化及原液制备 取青岛不同地点的污水样品,5000 r/min离心10 min,取100 μL上清液与100 μL沙门氏菌混合液于5 mL的LB液体培养基中在37 ℃下混合培养24 h,后5000 r/min离心10 min,取上清液用0.22 μm的微孔滤膜过滤,获得的液体利用双层平板法[17]形成噬菌斑进行分离并确定其宿主菌。噬菌体需经过五次单斑穿刺进行纯化,纯化后的噬菌体可以通过固体增殖法和液体增殖法[18-19]进行增殖,将获得的增殖液通过8000 r/min离心20 min,取上清液用0.22 μm的微孔滤膜进行过滤获得噬菌体原液。噬菌体的效价通过双层平板法进行测定。
1.2.2 生理特性研究
1.2.2.1 噬菌体噬菌斑的形态观察 将不同稀释度的噬菌体原液与宿主菌混合均匀,利用双层平板的方法进行噬菌斑培养,于37 ℃培养箱中过夜培养后观察噬菌斑的外观形态。
1.2.2.2 噬菌体电镜形态观察 用于电镜观察的噬菌体αα需要先通过5000 r/min离心1 min去除宿主菌或降解产物形成的碎片,从而获得较为纯净的噬菌体αα。按照Li等[20]的电镜观察方法进行操作:将5 μL的噬菌体αα滴于预处理的铜网上,放置几分钟后用滤纸从边缘吸去多余液体,滴上5 μL 0.5%磷钨酸染色3 min。经空气干燥后,用JEOL JEM-1200EX电镜下可观察到网格状结构,即可观察到噬菌体的形态并拍照。
1.2.2.3 噬菌体的核酸类型 首先准备高浓度的噬菌体液用于基因组提取,通过超滤法浓缩[21]噬菌体使其浓度达到1010pfu/mL。取200 μL噬菌体液加入20 μL RNaseA(25 mg/mL)和2 μL rDNase I(15 U/μL),混匀后置于37 ℃培养箱中培养15~30 min以降解来自宿主的核酸杂质。然后加入30 μL 150 mmol/L的EDTA溶液,65 ℃水浴15 min,以终止两种核酸酶的酶解反应。通过上述前处理过程,获得的噬菌体用于基因组提取,其提取方法参照TIANamp Virus DNA/RNA Kit[TIANGEN Biotech(Beijing)Co.,Ltd.]进行。将提取的噬菌体核酸进一步进行核酸类型鉴定,分别与rDNase I、RNase A及Mung Bean Nuclease按体积比9∶1混合后37 ℃孵育1 h,进行酶切实验。实验结果采用1%琼脂糖凝胶电泳实验进行鉴定,利用凝胶成像仪进行拍照观察结果。
1.2.2.4 噬菌体的热稳定性 将900 μL LB肉汤培养基分别置于40、50、60、70、80 ℃的水浴锅中预热30 min 至温度稳定后加入100 μL噬菌体αα,初始效价为5.2×108pfu/mL,经过15 min和30 min的孵育后,8000 r/min离心10 min,取100 μL上清液用SM缓冲液稀释后利用双层平板法测定噬菌体效价,不同温度、不同孵育时间各设三个平行组进行测定。
1.2.2.5 噬菌体的pH稳定性 将900 μL不同pH的LB肉汤培养基置于37 ℃的培养箱中预热30 min 至温度稳定后加入100 μL噬菌体αα,初始效价为5.2×108pfu/mL,继续在37 ℃的培养箱中孵育60 min,8000 r/min离心10 min,取100 μL上清液用SM缓冲液稀释后利用双层平板法测定噬菌体效价,不同pH各设三个平行组进行测定。
1.2.2.6 噬菌体液体增殖最佳离子浓度的筛选 设置LB液体培养基为空白对照组,实验组为含有不同钙镁离子浓度的LB培养基,离子浓度分别为10 mmol/L CaCl2、20 mmol/L CaCl2、30 mmol/L CaCl2、10 mmol/L MgCl2、20 mmol/L MgCl2和30 mmol/L MgCl2。分别在不同处理的50 mL液体培养基中加入100 μL过夜培养的宿主菌和100 μL噬菌体(效价为1.49×109pfu/mL),在37 ℃振荡培养箱中150 r/min振荡培养6 h后,取1 mL培养液于8000 r/min离心2 min后,将100 μL上清液用SM缓冲液稀释后利用双层平板法测定噬菌体效价,不同处理组各设三个平行组进行测定培养、测定。
1.2.2.7 噬菌体的一步生长曲线 在300 mL LB肉汤培养基(含10 mmol/L MgCl2)中加入3 mL过夜培养的沙门氏菌菌液,于37 ℃ 150 r/min下振荡培养3 h,然后加 3 mL噬菌体(效价为1.40×109pfu/mL),静置3 min后,分别在0、10、20、30、40、50、60、90、120、180、240、300、360 min 时刻取1 mL培养液,于8000 r/min离心2 min后,取100 μL上清液用SM缓冲液稀释后利用双层平板法测定噬菌体效价。实验共设置三个平行组同时进行培养、取样,每个样品选取2~3个合适稀释度进行测定。
1.2.2.8 噬菌体的最佳感染复数 感染复数(multiplicity of infection,MOI)是指在特定条件下噬菌体数目与宿主菌数目的比值。在含有10 mmol/L MgCl2的100 mL LB液体培养基中,分别按照感染复数为10、1、0.1、0.01、0.001、0.0001、0.00001接种1 mL沙门氏菌菌液及1 mL噬菌体,在37 ℃振荡培养箱中150 r/min培养6 h后,取1 mL培养液于8000 r/min离心2 min后,将100 μL上清液用SM缓冲液稀释后利用双层平板法测定噬菌体效价。
1.2.2.9 噬菌体的裂解谱 通过点滴法[22]测定噬菌体的裂解谱。用灭菌棉签蘸取鼠伤寒沙门氏菌ATCC 14028、鼠伤寒沙门氏菌ATCC 13311、伤寒沙门氏菌ATCC 19430、肠炎沙门氏菌CMCC 50041、甲型副伤寒沙门氏菌 CMCC 50001、乙型副伤寒沙门氏菌CMCC 50094以及肠炎沙门氏菌N16444过夜培养的菌液于LB琼脂平板上涂布均匀,然后将10~20 μL噬菌体点滴至平板上,培养12 h后观察噬菌斑形成情况以判定其是否具有裂解效果。
1.3 数据统计分析
实验数据采用SPSS 13.0与Excel 2010进行分析,方差分析采用LSD与Duncan检验方法,p<0.05表示具有显著性差异,p>0.05表示差异不显著。采用Origin8.1进行绘图。
2 结果与分析
2.1 噬菌体αα的分离、纯化及原液制备
噬菌体αα分离自青岛市污水处理厂的污水样品,宿主菌为鼠伤寒沙门氏菌ATCC 13311。通过液体增殖培养后,其效价可达到109pfu/mL,通过固体增殖浓缩后,其效价可达到1010pfu/mL。
2.2 噬菌体αα的生物学性质研究
2.2.1 噬菌体噬菌斑和电镜结果 电镜结果(图1)显示,噬菌体αα个体非常小,有明显的头部,直径约为20 nm,有若干尾刺,无明显的颈部、尾部。根据其形态特征发现,这与已报道的微小噬菌体科噬菌体phiX174具有高度相似性,噬菌体phiX174具有一个直径为24 nm的多面体头部,并且具有12个尾刺结构,无尾部结构[23]。因此,根据形态相似性推测噬菌体αα属于微小噬菌体科。该噬菌体的分类仍需通过核酸类型的鉴定来验证。
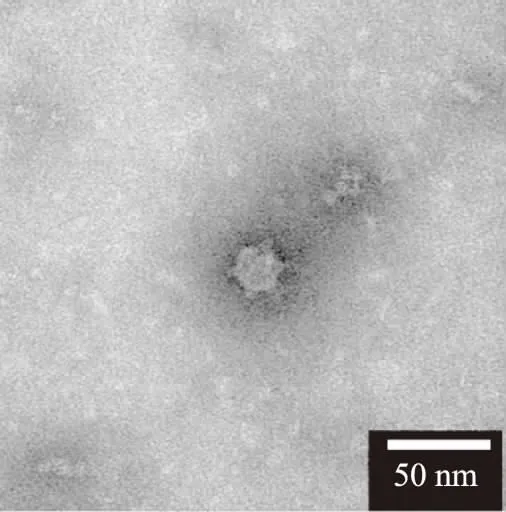
图1 噬菌体αα的电子显微镜图片
2.2.2 核酸类型 由琼脂糖电泳结果(图2)可知,噬菌体αα有两条主要的条带,分别位于1~1.5 kbp和3~5 kbp大小的位置上。酶切结果显示,噬菌体αα的基因组可以被rDNase I酶切而不能被RNase A酶切,说明噬菌体αα的核酸类型为DNA。同时,该基因组还可以被Mung Bean Nuclease酶切,说明其核酸类型是单链的。因此,噬菌体αα的核酸类型为单链DNA,根据国际病毒分类学委员会(International Committee on Taxonomy of Viruses,ICTV)的分类原则判定其属于微小噬菌体科。根据ICTV统计的数据库显示,以电镜结果和基因组大小为依据对已报道的噬菌体进行分类,有尾的双链DNA噬菌体目前占绝大多数,单链DNA噬菌体仅占噬菌体总数的11%,而微小噬菌体又仅占2%。鉴于单链DNA噬菌体在生物技术应用、分子生物学研究以及进化研究等方面的重要意义,单链DNA噬菌体、微小噬菌体科噬菌体的资源的获取和研究就显得十分重要[15]。

图2 噬菌体αα核酸及酶切结果电泳图
2.2.3 噬菌体的热稳定性和pH稳定性 噬菌体αα的热稳定性(图3)是通过40~80 ℃下孵育15、30 min噬菌体的效价变化来评价的。噬菌体αα在40~60 ℃下孵育皆具有活性,其中40 ℃下孵育15 min,效价仍保持初始效价的93%,孵育30 min后效价降为初始效价的76%;在50 ℃下孵育15、30 min后,效价降为初始效价的74%和68%;在60 ℃下效价下降得更为明显,孵育15、30 min后效价分别下降为初始效价的29%和2.7%;另外,噬菌体αα在70、80 ℃下皆显示效价为0,即已失去活性。因此,噬菌体αα在40~60 ℃内具有一定的热稳定性,这与李萌报道的沙门氏菌噬菌体SP3在30~60 ℃下均存活的结果相一致[24]。并且,噬菌体αα在40~60 ℃内随着温度提高、孵育时间延长,活性逐渐降低,在70 ℃以上活性丧失。这一现象体现了温度对噬菌体活性的影响,有研究指出,超过适宜温度可以通过破坏噬菌体的组成结构以及DNA结构的变化等使其失活,并且与温度作用的时间有关,时间越长作用越明显[25]。
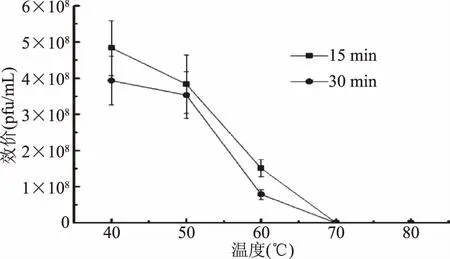
图3 噬菌体αα在不同温度的LB液体培养基中孵育不同时间的效价变化
噬菌体αα的pH稳定性(图4)是通过测定100 μL噬菌体αα在900 μL pH为1.0~14.0的不同LB液体培养基中噬菌体的效价变化来评价的。噬菌体αα在初始pH为2.0~12.0的LB液体培养基中孵育皆具有活性。其中在初始pH4.0~12.0的LB液体培养基中,效价皆保持在108pfu/mL以上,在pH为2.0和3.0时,噬菌体αα的效价皆有所下降,分别降至106pfu/mL和107pfu/mL。因为噬菌体液的加入可能会对LB液体培养基的pH造成一定影响,因此,对加入噬菌体液的LB液体培养基的pH也进行了测定,得到LB液体培养基的最终pH依次为1.17、2.10、3.09、4.04、5.05、6.03、7.00、7.83、8.80、9.73、10.46、11.45、12.86、13.88。由pH测定结果发现,加入噬菌体液后,不同pH的LB液体培养基的pH发生了不同的变化,但噬菌体αα的pH耐受范围仍较广。由此可得,噬菌体αα对酸碱具有较强的耐受性,仅在极强酸(pH1.17)和强碱(pH12.86、13.88)下丧失活性,而在pH2.10~11.45之间皆能保持活性。噬菌体αα的pH稳定性与宽谱沙门氏菌噬菌体fmb-p1(pH4~10)[26]、沙门氏菌烈性噬菌体SLMP1(4.0~11.0)[27]等目前报道的大多数沙门氏菌噬菌体相比,展现出了极广的pH耐受范围,这对该噬菌体在动物体内、人体内以及其他偏酸偏碱环境下的抑菌应用奠定了良好基础。

图4 100 μL噬菌体αα在不同pH的900 μLLB液体培养基中孵育60 min的效价变化
2.2.4 最佳离子浓度 由图5可见,添加了钙镁离子的LB培养基相较于未添加钙镁离子的更利于噬菌体αα的液体增殖,并且镁离子的效果优于钙离子的效果。由图5中可知,添加了低钙、镁离子浓度比高钙、镁离子浓度的LB培养基更能有效促进噬菌体αα的增殖,总体增殖后效价比较结果为10 mmol/L MgCl2显著高于其他组(p<0.05),20 mmol/L MgCl2和30 mmol/L MgCl2组的增强效果次之(p<0.05),10 mmol/L CaCl2的效果也显著高于剩下的三组(p<0.05),而添加20 mmol/L CaCl2和30 mmol/L CaCl2与未添加离子的对照组相比无显著差异(p>0.05),其中以培养基中添加10 mmol/L MgCl2的效果为最佳,与未添加离子的对照组相比提高了1.5个数量级。根据已有报道推测,镁离子可以增强噬菌体与宿主菌的吸附效果,从而加速对宿主菌的裂解,促进噬菌体的增殖[28]。镁离子的添加对噬菌体增殖的促进作用对该噬菌体的高效生产制备及快速抑菌具有指导意义。

图5 钙镁离子对噬菌体αα液体增殖的影响
2.2.5 一步生长曲线 由图6可知,噬菌体的测定初始效价为1.40×106pfu/mL,6 h后效价为2.35×108pfu/mL。噬菌体αα的增殖速度非常快,无明显的潜伏期,10 min时已经进入对数生长期,一直持续到60 min,从60 min以后开始到达平稳期。这与宋增福[30]报道的两株副溶血弧菌烈性噬菌体的裂解期为70 min相近,都能够在短时间内连续完成吸附、侵入、增殖、成熟和裂解这5个阶段而实现噬菌体的增殖,从而说明该噬菌体属于烈性噬菌体。

图6 噬菌体αα的一步生长曲线
2.2.6 最佳感染复数 感染复数是评价病毒感染与产出之间量效关系的重要生物学指标。不同感染复数条件下增殖,子代噬菌体的产率也会不尽相同,而噬菌体产率最高时对应的感染复数为最佳感染复数。由图7可知,当MOI值为10-2、10-3和10-4时,增殖的噬菌体效价都非常高,皆高于1.0×109pfu/mL,以增殖效率高为前提,其最佳感染复数为10-4,此时噬菌体效价为1.08×109pfu/mL。鞠磊等分离得到的金黄色葡萄球菌噬菌体qdsa002的最佳感染复数为0.001[29],宋增福等对分离的两株副溶血弧菌噬菌体的最佳感染复数皆为0.0001[30],以上报道噬菌体皆具有较强的裂解能力。结合上述报道并与之相比较,噬菌体αα具有较强的裂解能力。
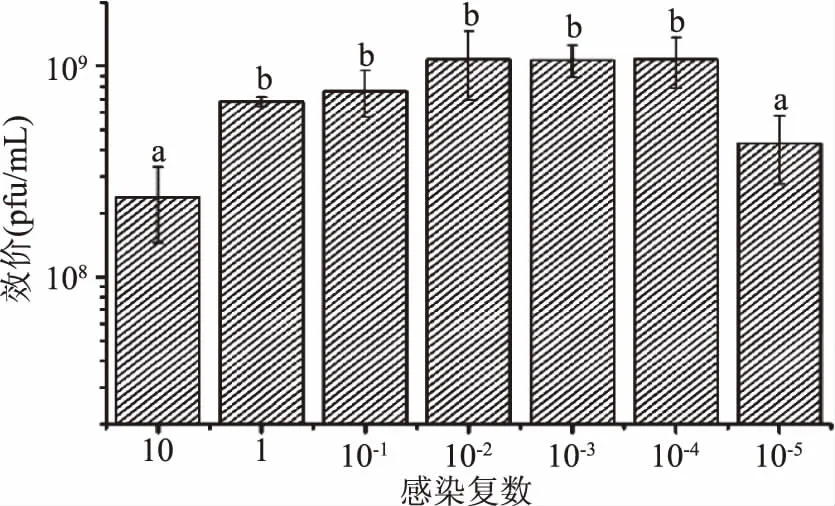
图7 不同感染复数对噬菌体αα液体增殖的影响
2.2.7 裂解谱 噬菌体αα的裂解谱见表1,以7种沙门氏菌、4种非沙门氏菌为宿主谱测定的菌株,其中,噬菌体αα在涂布有S.TyphimuriumATCC 13311和S.EnteritidisN16444这2种沙门氏菌的平板上形成了透明圈,说明噬菌体αα对这两种沙门氏菌具有裂解作用。然而,噬菌体αα涂布其他5种沙门氏菌和4种非沙门氏菌的平板上皆未形成透明圈,说明该噬菌体对这9种菌不能产生裂解作用。以上结果说明了噬菌体αα的特异性程度较强,仅对沙门氏菌有裂解作用,而对所测大肠杆菌、克雷伯氏菌、腐败希瓦氏菌以及李斯特菌均无裂解作用。已报道的宽谱沙门氏菌噬菌体STP4-a[31]与噬菌体αα都有共同裂解菌株ATCC 13311,然而噬菌体αα的裂解谱与之相比,对沙门氏菌的裂解范围较窄,且对沙门氏菌具有较强的特异性,不能裂解非沙门氏菌。一方面,噬菌体αα裂解谱窄的这一特点也与Anna和Mya总结的多数单链DNA噬菌体的裂解谱较窄这一结论相一致[15]。另一方面,Weisbeek等[16]和Pepin等[32]研究表明,微小噬菌体的G蛋白和H蛋白对噬菌体的宿主识别和裂解谱具有重要作用,可以通过关键基因的替换导致裂解谱发生改变,从而获得裂解不同宿主的噬菌体,从而扩大其应用范围。

表1 噬菌体αα的裂解谱
3 结论
本研究从污水中分离纯化出了一株以鼠伤寒沙门氏菌ATCC13311为宿主的噬菌体αα,并对其生理特性进行了研究。研究结果如下:电镜结果显示,噬菌体αα有一个直径为20 nm的头部结构,无尾部结构。酶切及电泳结果显示,噬菌体αα核酸类型为单链DNA,由此判定其属于微小噬菌体科,是国内首例报道的自主分离获得的微小噬菌体。噬菌体αα无明显的潜伏期,裂解期为60 min,在pH为2.10~11.45,温度为40~50 ℃时,效价分别保持在106~108pfu/mL和108pfu/mL左右。最佳感染复数为10-4,且10 mmol/L MgCl2对微小噬菌体αα液体增殖具有显著促进作用。由此可见,微小噬菌体αα具有良好的生理特性稳定,这为沙门氏菌的防控提供了一种有效的生物防控工具,其酸碱耐受范围广的特性为其在体内及酸碱环境中的应用提供了保障。同时,微小噬菌体αα也为今后单链DNA噬菌体在生物技术应用研究、分子生物学研究以及进化研究等方面提供了研究基础。

