奶花芸豆中凝集素的提取、纯化及鉴定
于雪慧,童军茂,张 建
(石河子大学食品学院,新疆石河子 832003)
奶花芸豆(Phaseolusvulgaris)属豆科芸豆属,一年生草本植物,因其豆皮整体呈乳白色,且带有紫色斑点,故得此名。奶花芸豆在我国东北、河北、云贵川、新疆等地区均有较大面积种植,其中新疆阿勒泰地区北屯市已将奶花芸豆发展成为当地的特色种植作物[1]。据测定,其种子中蛋白质含量23.1%,比谷物类高1~3倍,每100 g奶花芸豆中含有脂肪1.3 g,碳水化合物56.9 g,B族维生素的含量丰富[2]。
凝集素(Lectin)是含有一个或多个能够特异性识别并可逆性结合单糖或多糖的一类非免疫原性、非酶本质的蛋白质或糖蛋白[3],广泛分布于自然界的有机体中。目前,从动物、植物、微生物、病毒及真菌中均已经得到分离[4-5]。由于凝集素特异性的糖结合能力,导致其具有细胞凝集能力、诱导细胞凋亡和自噬能力、抗真菌、免疫调节、抗肿瘤、促进有丝分裂及生物固氮力等能力[6]。
目前已有从奶花芸豆中分离得到铁蛋白[7]、黄酮素[8]、多肽[9]等的报道,大量学者亦从大豆[10]、木豆[11]、绿豆[12]、刀豆[13]等豆科植物中分离得到凝集素[14],但尚未有从奶花芸豆中提取凝集素的相关研究。本文以新疆奶花芸豆为原料,采用水提法,从中分离出一种新型凝集素,利用单因素实验结合响应面实验对凝集素提取工艺进行优化,通过硫酸铵分级沉淀、Sephadex G-50和DEAE-A50阴离子交换层析进一步纯化,并利用SDS-PAGE电泳、质谱/质谱联用(LC-MS/MS)技术进行蛋白鉴定,以期为豆类凝集素的开发利用和提高奶花芸豆附加值提供数据参考。
1 材料与方法
1.1 材料与仪器
奶花芸豆(芸豆2号) 新疆生产建设兵团第十师农业科学研究所;新鲜兔血 石河子大学动物科学学院;磷酸二氢钠 天津市福晨化学试剂厂;磷酸氢二钠 天津市福晨化学试剂厂;丙烯酰胺(Acr)、甲叉双丙烯酰胺(Bis)、考马斯亮蓝、十二烷基硫酸钠(SDS)、四甲基乙二胺(TEMED) Sigma公司;二乙基氨基乙基-葡聚糖 A-50(DEAE Sephadex A-50)、交联葡聚糖凝胶G-50(Sephadex G-50) 美国GE-Healthcare Bio-Sciences AB公司;以上试剂均为分析纯;甲酸 Adamas公司;乙腈(ACN) Adamas公司;以上试剂均为色谱纯;胰蛋白酶(Trypsin)V5113 Promrga公司。
RHP-600高速粉碎机 浙江荣浩工贸有限公司;DK-8B电热恒温水槽 上海精宏实验设备有限公司;ZXRD-7080全自动新型鼓风干燥箱 上海智城分析仪器制造有限公司;PHS-3C型pH计 上海仪电科学仪器股份有限公司;FDU-1200冷冻干燥机 东京理化器械株式会社;SP-752PC紫外可见分光光度计 上海光谱仪器有限公司;电脑紫外检测仪 金坛市盛蓝仪器制造有限公司;电脑全自动部分收集器 上海青浦沪西仪器厂;凝胶呈像仪 BIO-RAD 公司。
1.2 实验方法
1.2.1 奶花芸豆豆粉的制备 将奶花芸豆用蒸馏水浸泡12 h后,手工脱皮处理,于40 ℃恒温干燥箱内烘干1 h后高速粉碎,过80目筛后得到细腻的豆粉。
1.2.2 奶花芸豆粗蛋白的提取 奶花芸豆豆粉按照一定比例加入蒸馏水,混合均匀后调节混合液的pH,恒温水浴一定时间,在4 ℃、10000 r/min的条件下离心15 min,经硫酸铵沉淀、透析得到粗提液。
1.2.3 单因素实验
1.2.3.1 料液比对提取效果的影响 称取5 g豆粉,按照1∶4、1∶8、1∶12、1∶16、1∶20 g/mL的料液比加入蒸馏水,固定pH为7.5,于40 ℃下浸提18 h后,离心取上清液进行血凝反应,并测定蛋白质含量。
1.2.3.2 pH对提取效果的影响 准确称取5 g豆粉,按照1∶12 g/mL的比例加入蒸馏水,调节pH分别为5.5、6.0、6.5、7.0、7.5、8.0,于40 ℃下浸提18 h后,离心取上清液进行血凝反应,并测定蛋白质含量。
1.2.3.3 浸提时间对提取效果的影响 准确称取5 g豆粉,按照1∶12 g/mL的比例加入蒸馏水,固定pH为7.5,于40 ℃下分别浸提2.0、6.0、10.0、14.0、18.0、22.0、26.0 h后,离心取上清液进行血凝反应,并测定蛋白质含量。
1.2.4 响应面优化实验 结合单因素实验的结果,选取料液比、pH、浸提时间为自变量,以凝集素的特异性活力为响应值,运用Design Expert 8.0软件进行响应面实验设计,实验因素水平表见表1。

表1 响应面实验因素水平表
1.2.5 硫酸铵分级沉淀法纯化奶花芸豆凝集素 由于凝集素的蛋白特性,采用硫酸铵分级沉淀的方法对粗提液进行初级纯化。向粗提液中缓慢加入饱和硫酸铵溶液,直到混合液中硫酸铵达到10%饱和度,4 ℃静置过夜,于8000 r/min的条件下离心20 min,将沉淀和上清液分别收集,上清液中继续加入饱和硫酸铵溶液分别至20%、30%、40%、50%、60%、70%、80%饱和,静置、离心,收集沉淀及上清液;不同饱和度下收集的沉淀分别以蒸馏水复溶,并进行透析,不断更换透析外液,直至用5%的BaCl2溶液检测透析外液中无白色沉淀生成,结束透析。测定复溶液的蛋白含量、总活力和特异性活力,并选取硫酸铵分级沉淀的范围。
1.2.6 离子交换层析与凝胶过滤层析
1.2.6.1 DEAE A-50阴离子交换层析 参考文献[15],称取DEAE-A50填料5 g,加入500 mL蒸馏水,浸泡24 h后倾去上层细粒,经过1 mol/L的HCl和1 mol/L的NaOH溶液分别洗涤酸洗、碱洗后用蒸馏水洗至中性,煮沸30 min脱气。处理完毕后装柱,用pH6.9的PB缓冲液进行平衡,直至流入液与流出液经过电脑紫外检测仪280 nm[4]下检测的所得吸光值一致。采用0.1 mol/L、pH6.9的PB缓冲液配制梯度NaCl溶液,室温保存。NaCl梯度洗脱液配制方法如表2所示。

表2 NaCl梯度洗脱液的配比
准确上样3 mL经硫酸铵沉淀浓缩的粗纯化样品,用pH6.9的PB缓冲液进行洗脱,然后再分别用不同浓度梯度的NaCl缓冲溶液进行洗脱,控制流速在0.3 mL/min,洗脱液经过电脑紫外检测仪进行蛋白含量检测后,利用全自动部分收集器进行收集,10 min收集一次,每个试管中收集3 mL,280 nm[4]下测定蛋白含量,收集峰值管。不断重复上述过程富集峰值管,并对富集的峰值管进行浓缩,测定其特异性活力与蛋白质含量,记录体积,保存于4 ℃条件下,已备后续纯化。
1.2.6.2 Sephadex G-50葡聚糖凝胶柱层析 参考文献[16],称取G-50填料5 g,加入50 mL去离子水,浸泡溶胀24 h;倾去上层清水,加入与填料等体积的1.0 mol/L NaOH溶液,浸泡30 min后洗至中性,重复3~5次碱浸过程后,加热煮沸30 min脱气,用pH为6.9的PB缓冲液进行平衡装柱,直至流入液与流出液的吸光值一致。
向平衡好的凝胶柱中加入3 mL经过离子交换层析纯化后的样品,用pH6.9的磷酸缓冲液进行洗脱,控制流速为0.8 mL/min,洗脱的同时用电脑全自动部分收集器进行收集,每5 min收集一次,每个试管中收集4 mL,280 nm下测定蛋白含量,收集峰值管;不断重复上述过程富集峰值管,并浓缩富集的峰值管,通过血凝反应测定其特异性活力,记录体积保存于4 ℃,已备后续纯化。
1.2.7α-AI分子量测定 利用 SDS-PAGE电泳对纯化后的样品进行分析。采用10%的分离胶和5%的浓缩胶,10 μL样品与10 μL样品缓冲液混合,95 ℃下水浴5 min后,加入点样孔,浓缩胶工作电压为80 V;分离胶工作电压为160 V。染色1 h后脱色,直至看到清晰条带。利用BIO-RAD 凝胶成像仪得到凝胶影像,分析电泳图谱。预染标准蛋白为混合标准蛋白,分子量范围25~120 kDa。以SDS-PAGE电泳凝胶上已知分子量的标准蛋白质为依据,通过待测蛋白质的迁移条带分析其分子量范围。
1.2.8 LC-MS/MS质谱分析 切下的蛋白胶条经过水洗、脱色、脱水、烷基化等步骤后用胰蛋白酶酶解,提取的肽段用0.1%甲酸、2%乙腈溶解,充分振荡涡旋,13200 r/min,4 ℃离心10 min,上清转移到上样管中,进行质谱鉴定。
1.2.8.1 液相条件 色谱柱:Acclaim PepMap RSLC C18(250 mm×0.075 mm,3 μm);流动相A:0.1%甲酸,B:0.1%甲酸,80%乙腈;洗脱梯度:0~5 min 5% B,5~55 min 90% B,55~60 min 5% B。
1.2.8.2 质谱条件 离子源:ESI;一级质谱:分辨率70000,最高离子强度3e6,最大离子收集时间40 ms,扫描范围m/z:350~1800;二级质谱:分辨率17500,最高离子强度1e5,最大离子收集时间60 ms,碰撞能量27 eV。
1.2.9 蛋白质标准曲线的绘制 采用考马斯亮蓝法[17],配制考马斯亮蓝溶液及牛血清蛋白标准蛋白液,如表3进行编号并加入试剂,混合均匀后在室温下静置3 min,以管1为空白管,于595 nm波长下测定各管吸光值,并绘制标准曲线。

表3 蛋白质标准曲线的制备
样品蛋白浓度的测定:1.0 mL的待测样品与5.0 mL已配制好的考马斯亮蓝G-250,混合均匀后静置3 min与595 nm波长下测定吸光值。根据标准曲线,计算待测样品的蛋白浓度。
1.2.10 凝集素活力的测定 参照并优化杨明亮等[18]的血凝反应方法,采用96孔V型板法测定凝集素的特异性活力。
1.2.10.1 红血球悬液的配制 采集新鲜兔血于肝素钠抗凝管中后,将新鲜血液倒入离心管中3000 r/min离心3 min,去除上层血清,向沉淀中添加生理盐水以清洗血红细胞。轻轻颠倒摇匀洗涤,然后再次3000 r/min离心3 min,去除上清液,如此重复操作洗涤3次。根据红细胞压积,按照离心出的红细胞体积,加入生理盐水配成2%浓度的红细胞悬液,4 ℃保存备用。
1.2.10.2 血凝反应过程 V型板的96孔中各加入50 μL生理盐水,向第一孔中加入50 μL样品溶液,混匀后从第一孔中吸取50 μL的混合液置于第二孔中,混匀后,再从第二孔中吸取50 μL液体置于第三孔中,按此方式依次稀释至第12孔,最后从第12孔中吸出50 μL混合液,弃去。12孔的液体倍比稀释结束后,分别向每孔中加入50 μL红细胞悬液。静置1.5 h后观察记录凝集结果。
1.2.10.3 凝集程度的判断 由于凝集素与糖蛋白的特异性结合,血红细胞之间可形成交叉网络,从而导致血球不下沉,反之则会形成一个凝集的红点。按照图1及表4判断凝集效果。

表4 孔板法评价凝集程度

图1 凝集程度示意图
1.2.10.4 凝集素特异性活力的计算:

总活力(HU)=[血凝滴数(2n)×1000×红细胞悬液体积]/每孔添加体积
特异性活力(HU/mg)=[血凝滴数(2n)×1000]/(每孔添加体积×凝集素或粗蛋白浓度)
式中,n为样品经过倍比稀释后在96孔V型板上的凝集孔数;2n为倍比稀释的稀释倍数,即血凝滴度。
1.3 数据处理
采用Origin 8.0和Design Expert 8.0软件对所得数据进行分析。
2 结果与分析
2.1 蛋白质标准曲线
以牛血清标准蛋白浓度为横坐标,595 nm波长下测定的吸光值为纵坐标,绘制标准曲线,结果见图2。

图2 牛血清蛋白含量的标准曲线
2.2 单因素实验
2.2.1 料液比奶花芸豆凝集素提取效果的影响 蛋白质在溶解过程中,传质动力增加,随着料液比的增加,蛋白质的提取率也会随之上升。由图3可知,当料液比从1∶4 g/mL增加至1∶12 g/mL时,蛋白质浓度不断增加,特异性活力与总活力亦呈上升趋势;在料液比为1∶12 g/mL时达到最大值,蛋白含量为(10.63±0.2) g/100 g,总活力为(12.77±0.36)×107HU,特异性活力为(12.01±0.42)×103HU/mg;继续增加浸提液,蛋白质含量及凝集活性均呈略微下降的趋势,这就说明在料液比为1∶12 g/mL时,凝集素已经完全析出,继续加大浸提液体积,不能获得更大的蛋白溶解率,且会增加成本和工作量,故选择料液比1∶12 g/mL作为提取的适宜条件。
2.2.2 pH对奶花芸豆凝集素提取效果的影响 蛋白质会在pH的等电点附近发现沉淀,从而影响提取效果,豆类凝集素的等电点大多数均集中在5.4~6.5之间[4],调节适当的pH,可提高凝集素提取效果。由图4可知,蛋白质含量随着pH的增大呈不断上升趋势,pH8.0时蛋白含量达到最大(9.71±0.23) g/100 g,总活力与特异性活力随着提取液碱性逐渐增加,在pH7.5时均达到最大值,总活力为(10.79±0.21)×107HU,特异性活力为(12.73±0.41)×103HU/mg,继续增加pH,提取活力开始下降,这就说明在弱碱性环境中目标蛋白可最大限度的溶解于混合液中,且凝集活性可达到最高,而过碱环境中,虽溶解总蛋白含量增加,但目标蛋白已失活。为了获得最佳的提取效果,保证蛋白含量较高且凝集素活性较稳定,选择pH7.5作为提取的适宜条件。

图4 pH对奶花芸豆凝集素提取效果的影响
2.2.3 提取时间对奶花芸豆凝集素提取效果的影响 由图5可知,随着浸提时间的增加,蛋白质含量及凝集活力均呈现上升趋势,在提取时间为18 h时,达到最佳提取效果,蛋白含量为(11.56±0.38) g/100 g,总活力为(15.22±0.4)×107HU,特异性活力为(13.17±0.31)×103HU/mg。这就代表时间的延长有利于凝集素的溶出,但随着时间继续的增加,豆粉中亦会溶解滋生出一些酶及微生物,分解消耗蛋白质,降低凝集素提取率,因此,选择18 h为提取的适宜时间。

图5 提取时间对奶花芸豆凝集素提取效果的影响
2.3 响应面实验
以单因素实验结果为依据,以料液比(A)、pH(B)、浸提时间(C)为自变量,以凝集素特异性活力(Y)为响应值,根据Box-Behnken 实验设计进行响应面实验。响应面实验设计及结果如表5。
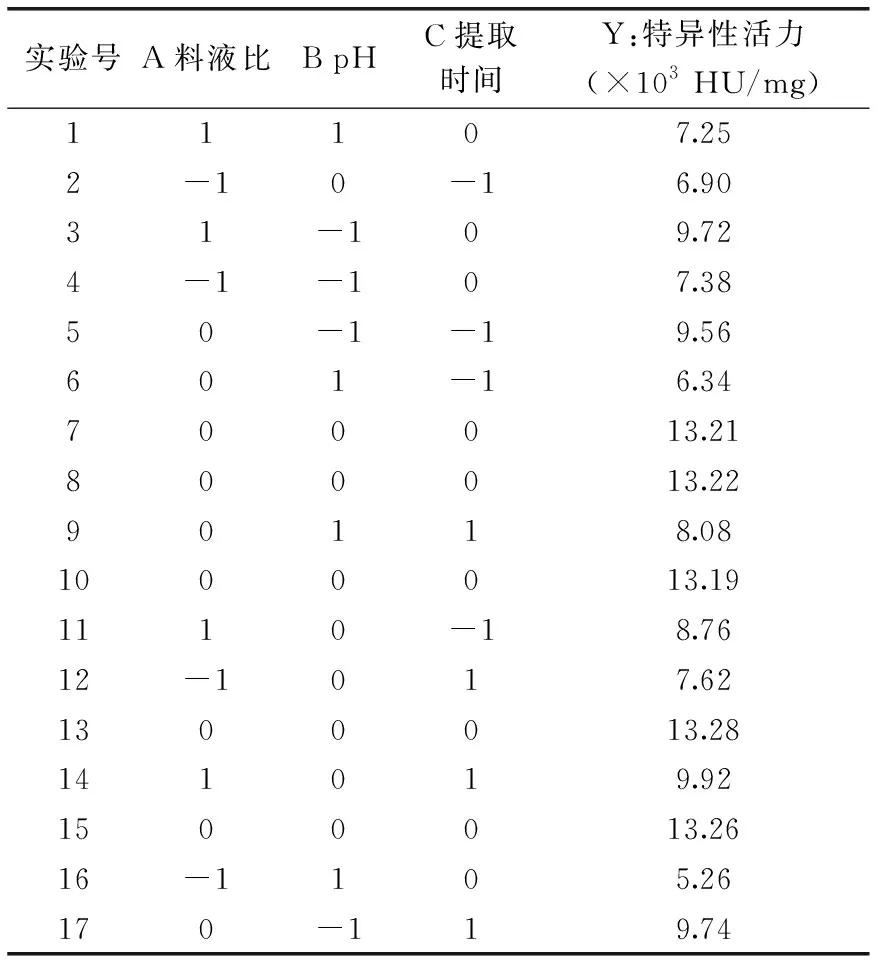
表5 响应面实验设计及结果
利用表中数据结果进行多元回归拟合,得到奶花芸豆凝集素特异性活力(Y)对以上因素的二次多项回归模型为:Y=13.23+1.06A-1.18B+0.47C-0.087AB+0.11AC+0.39BC-2.98A2-2.85B2-1.95C2。


表6 回归方程方差分析结果
各因素交互作用的响应曲面图见图6。等高线的形状可反映出交互效应的强弱,图形趋向椭圆且椭圆轴线与坐标轴的角度越大,交互作用越明显[19]。图6可知,料液比、pH、提取时间这三个因素两两之间交互作用均显著,这与回归分析结果相吻合。

图6 各因素交互作用的响应曲面图
通过软件分析,奶花芸豆凝集素特异性活力的最优参数为:料液比1∶12.73 g/mL,pH7.4,提取时间18.42 h,在此条件下预测所提取出的凝集素特异性活力可达13.4748×103HU/mg。考虑到操作的方便性,对软件给出的最优参数进行修正:料液比(g/mL)为1∶13,pH为7.4,提取时间为18.5 h,在此条件下重复三次实验,得到奶花芸豆凝集素特异性活力为(13.26±0.26)×103HU/mg,与预测值接近,说明采用响应面法优化的奶花芸豆凝集素提取工艺具有可行性。
2.4 硫酸铵分级沉淀法纯化结果与分析
本实验对于不同饱和度的硫酸铵纯化效果进行考察,实验结果如图7所示。由图7可知,硫酸铵饱和度低于30%时,随着硫酸铵饱和度的增加,沉淀复溶液中的蛋白含量不断上升;硫酸铵饱和度达到30%时,在沉淀复溶物中检测到凝血活性,并在70%饱和度时达到最大,蛋白含量为(8.93±0.24) g/100 g,总活力(12.84±0.27)×107HU,特异性活力为(14.38±0.29)×103HU/mg,纯化倍数为1.08。因此,本实验选择30%~70%作为硫酸铵分级盐析的范围。

图7 奶花芸豆凝集素硫酸铵分级沉淀法纯化结果
2.5 离子交换层析与凝胶过滤层析
2.5.1 DEAE A-50阴离子交换层析 凝集素是一类两性电解质,其等电点在6.5~7.5之间,同时考虑到酸碱度对纯化效果的影响,选择阴离子交换层析进行纯化分离,pH6.9的磷酸盐缓冲液进行洗脱。
梯度洗脱图如图8所示,分别在pH6.9缓冲溶液、NaCl浓度100 mmol/L和NaCl浓度150 mmol/L出现了三个蛋白峰。经血凝反应检测,只有峰1收集的蛋白具有凝集活性。多次富集DEAE-A50洗脱得到的峰1蛋白液,经过透析除去磷酸盐,-50 ℃真空冷冻干燥冻干后收集备用。经检验该峰值管内蛋白含量为(4.12±0.19) g/100 g,总活力(13.43±0.24)×107HU,特异性活力(32.60±0.22)×103HU/mg,纯化倍数为2.46。

图8 DEAE-A50阴离子交换层析
2.5.2 Sephadex G-50葡聚糖凝胶柱层析 如图9所示,经过G-50凝胶柱后出现了一个蛋白峰,富集峰值管蛋白液,透析除盐后冷冻干燥。通过血凝反应在峰值管中检测到了凝集能力,蛋白含量为(1.31±0.07) g/100 g,总活力为(7.85±0.20)×107HU,特异性活力为(59.93±0.31)×103HU/mg,纯化倍数为4.52。

图9 Sephadex G-50葡聚糖凝胶柱层析
2.6 奶花芸豆凝集素分子量的鉴定
图10为经过Sephadex G-50葡聚糖凝胶柱层析后样品进行SDS-Page得到的电泳图。从图10中可以看出,经过盐析、离子交换层析和凝胶柱层析后,样品杂蛋白大致被除去,在31 kDa左右呈现出一条清晰的条带,因此推测从奶花芸豆凝集素的分子量在31 kDa左右。
2.7 奶花芸豆凝集素LC-MS/MS蛋白鉴定
蛋白胶条经过酶切成肽段,通过液相使样品以离子化的方式从液滴表面蒸发,进入质谱,一级质谱可以获得肽段的质量数信息,选择强度最高的20个峰的肽段进行碎裂,得到每个肽段的二级质谱,根据二级质谱图与Uniprot数据库进行比对,从而得到肽段的序列信息,根据肽段的信息进一步比对蛋白序列,得到蛋白的鉴定信息。
电泳条带中共鉴定出15种蛋白质,鉴定结果如图11及表7所示,其中蛋白得分与丰度较高的前10种蛋白均属于凝集素这一大类蛋白。剩余的五种蛋白为酶抑制剂、菜豆素、肌动蛋白、磷酸脱氢酶,它们的蛋白得分与丰度很低。因此,由鉴定结果可以确定,通过层析纯化得到的目标蛋白即为奶花芸豆凝集素。

表7 LC-MS/MS检测鉴定结果

图11 LC-MS/MS质谱峰图
3 结论
本实验以新疆奶花芸豆为原料,提取奶花芸豆凝集素。利用单因素实验结合响应面实验得到奶花芸豆凝集素的最优提取条件为:料液比1∶13,pH7.4,提取时间18.5 h,在此条件下凝集素特异性活力为(13.26±0.26)×103HU/mg;经过30~70%硫酸铵分级沉淀、DEAE A-50阴离子交换层析和Sephadex G-50凝胶层析后的凝集素特异性活力达到(59.93±0.31)×103HU/mg,纯化倍数为4.52。SDS-Page电泳确定目标分子量在31 kDa左右,并通过LC-MS/MS检测确定分离的蛋白即为奶花芸豆凝集素。

