甲状腺乳头状癌超声造影征象与病理组织变化的相关性分析
余小琴,郭 莉,张 利,于 兰,刘滨月
1. 深圳市龙岗中心医院超声科,广东 深圳 518116;2. 新疆医科大学附属肿瘤医院超声科,新疆维吾尔自治区 乌鲁木齐 830001;3. 新疆维吾尔自治区人民医院超声科,新疆维吾尔自治区 乌鲁木齐 830001
甲状腺癌是目前增长率最高的肿瘤,其中甲状腺乳头状癌是最常见类型。早期诊断甲状腺癌对临床选择治疗方式至关重要。超声是诊断甲状腺疾病的首选检查方法,迅速发展的超声造影(contrast-enhanced ultrasound,CEUS)为甲状腺癌提供了新的诊断途径。本研究回顾性分析196例甲状腺疾病患者共253个甲状腺结节(141个恶性、112个良性)的CEUS声像图特征,探讨其与病理组织学变化的关系,旨在提高CEUS诊断甲状腺癌的准确率。
1 资料和方法
1.1 研究对象
选取2013年12月—2015年9月196例甲状腺疾病患者共253个甲状腺结节为研究对象,其中141个甲状腺癌为病例组,112个甲状腺良性结节为对照组,均经手术或穿刺病理证实。结节直径0.25~5.23 cm,平均(1.15±0.81) cm。女性132例,男性64例,年龄24~76岁,平均(49.70±1.01)岁。
1.2 仪器与方法
1.2.1 超声常规检查
采用GE Logiq E9、PHILIPS iU-Elite超声仪,探头为ML6-15、L9-3和L12-3,探头频率为6~15 MHz。选择仪器设置的甲状腺检查条件,根据病灶的具体情况调整深度、增益、聚焦部位,使超声图像最佳化。患者取仰卧位,头后仰,充分暴露颈部检查区域,由具有多年工作经验的超声科医师对甲状腺进行纵、横多切面扫查,发现结节后观察二维超声声像图特征,详细记录结节的位置、大小、形态、边界、内部构成、回声水平、有无钙化及血流信号。
1.2.2 CEUS检查
造影探头频率为4~9 MHz,造影剂为SonoVue,机械指数(mechanic index,MI)为0.08~0.12。CEUS切面尽量选择甲状腺长轴切面,使得完整的病灶和周边部分正常组织能同时显示在一个切面内;如不能实现,则选用甲状腺短轴切面,以健侧组织作为参照。确定最佳造影切面后,尽量保持观察切面不变,选择相同的切面进入CEUS模式。将配制好的造影剂混悬液经肘正中静脉弹丸式注射1.0~2.4 mL,实时动态观察结节内造影剂微泡的灌注情况,动态图像采集时间为90~120 s,观察并记录结节内增强早期(增强开始后30 s内)和增强晚期(增强开始30 s后)增强特征及病灶范围变化等情况。观察同一患者不同结节的造影间隔时间>15 min。所有患者在造影前均签署CEUS知情同意书。
1.2.3 诊断标准
① 恶性甲状腺结节常规超声征象:低回声、肿块边缘不规则(浸润性、小分叶或毛刺)、微钙化、纵横比(A/T)≥1、彩色多普勒超声显示不规则血流信号增多[1-2]。甲状腺癌转移性淋巴结的CEUS特征包括:淋巴结肿大、形态趋圆、淋巴门消失、高回声区、囊性变、钙化、周边或中央异常紊乱血流信号等[3-7]。② CEUS诊断标准采用Zhang等[8]的诊断标准:均匀等增强、周边环形高增强、病灶范围无变化判断为良性结节,不均匀低增强判断为恶性结节。结节增强后形态不规则、病灶范围缩小、颈部淋巴结充盈缺损判断为恶性结节。③ 以手术或穿刺病理结果为金标准。
1.3 统计学处理
采用SPSS 17.0统计软件进行分析,以病理结果为诊断金标准,计量资料以x±s表示。单因素分析采用χ2检验,以病理结果为标准,比较病例组和对照组结果。多因素分析以病理结果为因变量,甲状腺结节常规及CEUS各超声征象为自变量,建立Logistic回归模型。P<0.05为差异有统计学意义。
2 结 果
2.1 甲状腺结节病理类型
141个甲状腺癌包括甲状腺乳头状癌90个、甲状腺乳头状微小癌51个。其中5例为多灶癌,18例伴颈部淋巴结转移。112个甲状腺良性结节包括单纯结节性甲状腺肿70个、结节性甲状腺肿伴其他病变25个、桥本病6个、滤泡管结节状分布部分嗜酸性变3个、肉芽肿性甲状腺炎3个、良性肿瘤上皮细胞乳头状增生2个、滤泡性肿瘤伴玻璃样变钙化2个、滤泡结节1个。
2.2 统计学结果
甲状腺结节超声征象与病理相关性的单因素分析结果见表1,多因素分析结果见表2。常规超声征象中边缘不规则、微小钙化灶和A/T≥1与甲状腺癌病理组织变化关系密切(χ2=8.677、13.074和15.251,P=0.000、0.003和0.000;OR=3.714、35.442和6.632,P=0.007、0.000和0.000,图1~2)。CEUS中不均匀性低增强、增强后肿块范围缩小和增强后肿块形态不规则与甲状腺癌病理组织变化关系密切(χ2=1.080、79.441和7.595,P=0.000、0.000和0.006;OR=22.332、29.296和18.678,P=0.000、0.000和0.000)(图3~4)。环形高增强与甲状腺良性结节密切相关(χ2=67.143,P=0.000;OR=35.264,P=0.000,图5~6)。
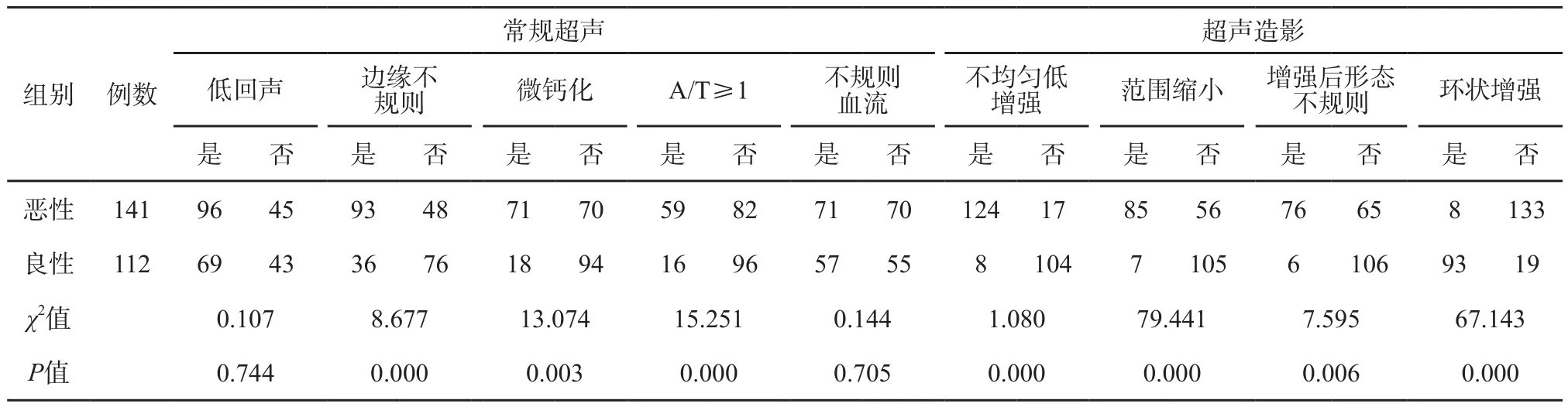
表 1 甲状腺结节超声征象与病理相关性单因素分析
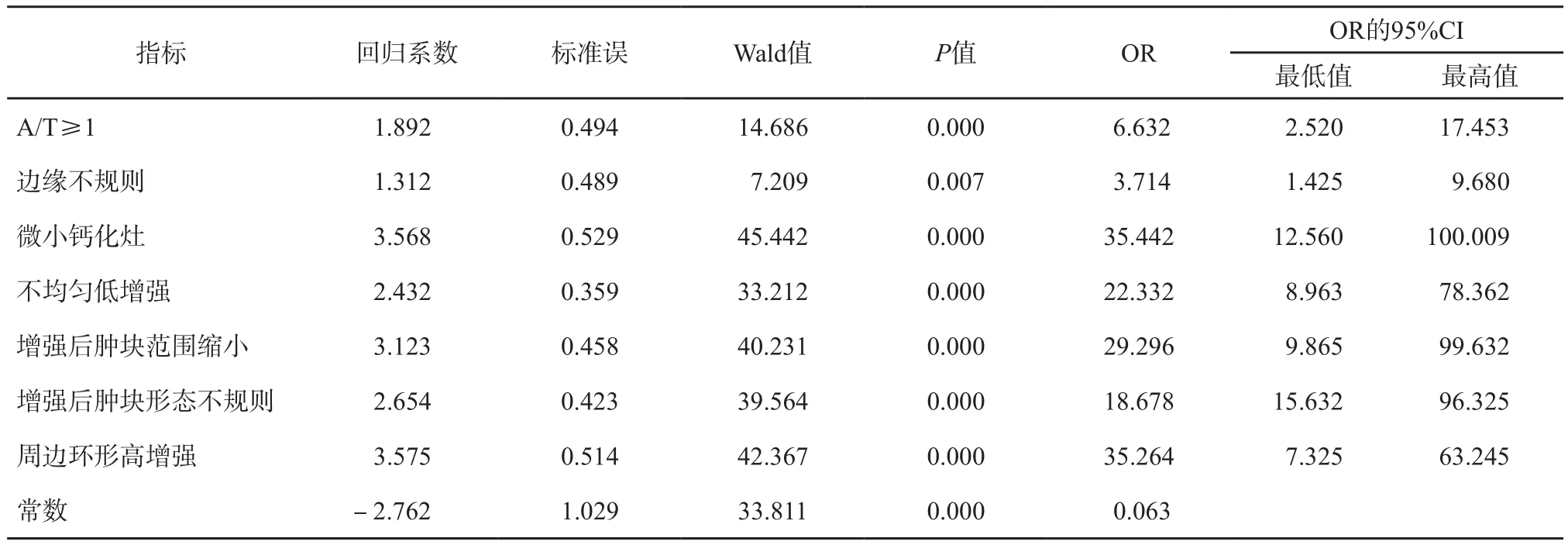
表 2 甲状腺结节超声征象与病理相关性多因素分析
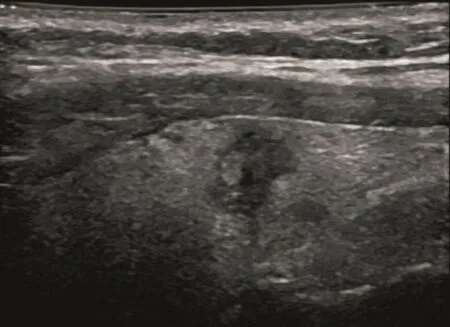
图 1 甲状腺乳头状癌常规超声征象
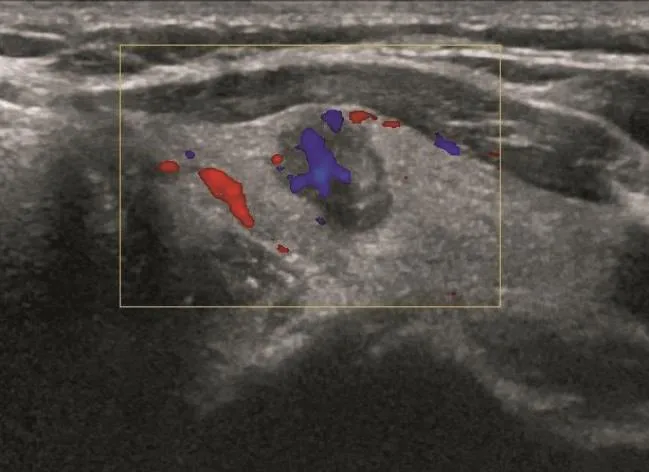
图 2 甲状腺乳头状癌彩色多普勒超声征象
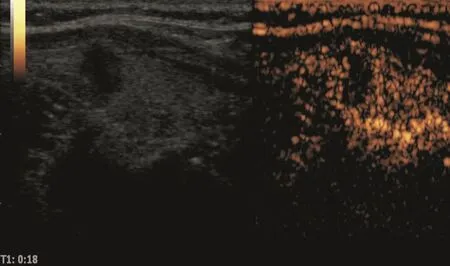
图 3 甲状腺乳头状癌超声造影表现(一)

图 4 甲状腺乳头状癌超声造影表现(二)
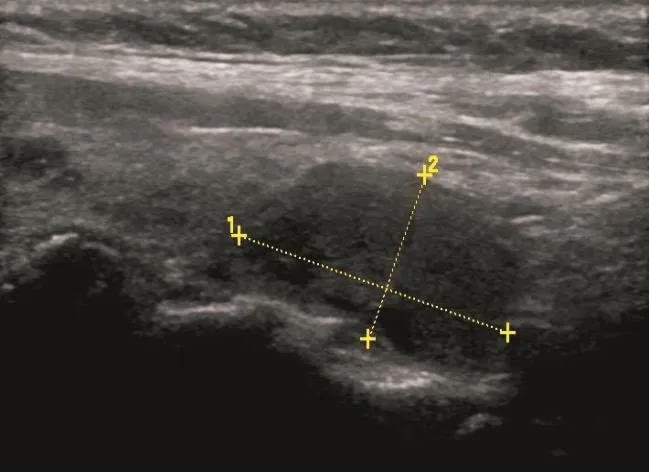
图 5 甲状腺右侧叶低回声结节,形态尚规则,内回声不均匀

图 6 超声造影
141个甲状腺癌中,18例发生颈部淋巴结转移,其中13例出现淋巴门消失、囊性变、钙化等征象,12例CEUS出现充盈缺损。
3 讨 论
甲状腺结节在临床上非常多见,高分辨率超声检查能检测出19%~67%随机人群的甲状腺结节[9]。2009年美国甲状腺协会(American Thyroid Association,ATA)发布的《甲状腺结节和甲状腺癌诊治指南》指出,甲状腺结节即为甲状腺内散在的病灶,影像学检查能将其与周围甲状腺组织清楚分界[9],表明影像学检查尤其是超声检查在甲状腺结节的诊断中具有重要地位。
甲状腺结节回声水平分为无、极低、低、等和高回声。低回声是恶性结节的主要征象之一[1],无回声、等回声和高回声多见于良性结节。甲状腺癌细胞大而重叠,间质少,在声像图中很少形成强烈的反射界面,故以低回声多见。但该征象的特异性较差,部分良性结节也呈现低回声。以往研究[10]发现,仅有5.6%~7.8%的良性结节表现为极低回声,而恶性结节中该比例为26.5%~41.4%,两者之间的差异具有统计学意义,即极低回声多数为恶性表现。本研究141个甲状腺恶性结节中96个(68.09%)为低回声,112个良性结节中69个(61.61%)为低回声,两者比较低回声判断结节良恶性差异无统计学意义(χ2=0.107,P=0.744),需结合其他指标综合判断。
甲状腺结节形态对良恶性结节鉴别具有重要意义。结节形态可分为椭圆形、类圆形及不规则形。椭圆形和类圆形结节以良性较多见,也可见于部分乳头状癌和滤泡状癌。若椭圆形结节内部回声均匀,类似睾丸回声,且边界清晰,则应警惕恶性可能。形态边缘不规则结节如出现成角、毛刺或微小分叶结构,需高度警惕恶性可能。本研究141个甲状腺恶性结节中93个(65.96%)出现边缘不规则,112个良性结节中36个(32.14%)出现边缘不规则,两者比较甲状腺结节边缘不规则判断结节良恶性具有统计学意义(χ2=8.677,OR=3.714,P均<0.01)。但该征象也可见于局灶性甲状腺炎等良性病变,亚急性甲状腺炎或囊液吸收后的结节也可呈不规则形状,需仔细询问病史以进行鉴别。
甲状腺结节钙化可分为微钙化、粗大钙化和边缘钙化。微钙化多表现为点状强回声,后方一般不出现声影,是诊断甲状腺乳头状癌最特异的指标[1,11],特异度高达93%~95%[1]。目前尚没有统一的标准来界定微钙化的大小,有研究将直径<1.0 mm[12]、<1.5 mm[13]和<2.0 mm[14]作为标准来定义微钙化。本研究以直径<1.0 mm定义为微小钙化灶,141个甲状腺恶性结节中71个(50.35%)发现微小钙化灶,112个良性结节中仅18个(16.07%)有微小钙化灶,两者比较微小钙化灶判断结节良恶性差异有统计学意义(χ2=13.074,OR=35.442,P均<0.01)。需注意微钙化与结节内浓缩胶质的鉴别。胶质在结节内高度浓缩,超声图像上表现为点状强回声,后伴“彗星尾征”。一般认为, “彗星尾征”是良性结节的超声征象[15],主要见于单纯性或复杂性囊性甲状腺结节。粗大钙化多见于良性结节,多因结节内血肿吸收所致,如结节性甲状腺肿,但部分甲状腺乳头状癌中亦可出现粗大钙化[1]。边缘钙化指位于甲状腺结节边缘部位的钙化,常见于结节性甲状腺肿,常是良性结节的标志,但也可见于乳头状癌和未分化癌。需仔细观察鉴别甲状腺结节几种类型钙化的超声声像图特征。
A/T是指甲状腺结节前后径与左右径的比值,可分为<1与≥1两类。A/T≥1是诊断甲状腺癌特异度及灵敏度均较高的特征[16-19],但需要注意超声纵切面、横切面A/T均≥1才具有诊断价值。Cappelli等[16-17]认为,若结节的A/T≥1,且伴微钙化、边界模糊及低回声,则考虑为恶性。若结节的A/T<1,但周边伴有不规则声晕,内部回声均匀,类似于正常睾丸回声,此时需警惕为甲状腺滤泡状癌。本研究141个甲状腺恶性结节中59个(41.84%)A/T≥1,而112个良性结节中仅16个(14.29%)A/T≥1,两者比较A/T≥1判断结节良恶性差异具有统计学意义(χ2=15.251,OR=6.632,P均<0.01)。然而,随着结节增大,A/T鉴别诊断良恶性结节的价值下降[6]。
彩色多普勒超声检查可观察甲状腺结节的血管模式、血供程度及血流动力学特征。甲状腺癌组织代谢快,呈快速生长,血管形成较多,结节内可表现为丰富血流,但血流丰富不是甲状腺癌的特异性表现。甲状腺微小癌因体积小,血流显示不佳,多数微小癌内部未能显示明显血流,少数内部可见点棒状血流。既往研究[11,20]报道,良性结节多为无血管型及周边为主血管型,恶性结节多为内部血管型。而Moon等[19]发现,彩色血流信号的多少及分布与结节良恶性之间并无相关性。计静丹等[20]的研究结果与Moon等[19]的研究结果类似,并且发现≤1 cm组和>1 cm组的恶性结节以低血供为主,但随着结节变大,高血供所占比例上升,结节内部血管类型与其良恶性不存在相关性。本研究141个甲状腺恶性结节中71个(50.35%)血流不规则,112个良性结节中57个(50.89%)血流不规则,两者比较不规则血流判断结节良恶性差异无统计学意义(χ2=0.144,P=0.705)。此外,脉冲多普勒超声检查可获得结节血管流速和阻力方面的参数信息,其中阻力指数(resistance index,RI)是评估结节性质较好的多普勒参数,目前常以0.70作为分界,一般认为RI≥0.70多发生于恶性结节。有研究[21-23]表明,恶性结节内血流RI平均为0.74~0.76,这可能与恶性肿瘤内新生血管管壁薄、缺少平滑肌及无正常血管应有的弹性有关。RI<0.70多见于良性结节,平均为0.56~0.66。但也有研究[24-26]表明,多普勒超声中的RI、收缩期峰值速度等对区分结节良恶性并没有帮助。
CEUS最早报道于20世纪60年代,Gramiak等[27]首先将其应用于心导管检查中。甲状腺是人体内血供丰富的器官之一,由于正常甲状腺组织与良恶性结节的血管分布和血供程度不同,CEUS鉴别甲状腺良恶性结节具有较大价值。Zhang等[8]采用SonoVue对甲状腺结节进CEUS研究后发现,良性结节呈现4 种增强模式:环状增强(83.0%)、均匀增强(7.5%)、不均匀增强(7.5%)及无增强(2.0%);恶性结节呈现3种增强模式:不均匀增强(88.2%)、均匀增强(5.9%)及环状增强(5.9%)。良性结节多表现为环状增强,恶性结节多表现为不均匀增强。但良恶性结节的增强特征存在一定的交叉重叠,应结合灰阶超声检查共同诊断。本研究141个甲状腺恶性结节中,124个呈不均匀性低增强,占87.94%,85个结节增强后范围缩小,占60.28%,76个结节增强后形态不规则,占53.90%,差异均有统计学意义(χ2=1.080、79.441和7.595;OR=22.332、29.296和18.678,P均<0.01)。112个良性结节中,93个周边呈环形高增强,占83.04%,差异有统计学意义(χ2=67.143,OR=35.264,P均<0.001)。
此外,颈部淋巴结转移是甲状腺癌的常见表现,甲状腺乳头状癌的淋巴结转移尤为常见,是预后不良的重要因素之一。甲状腺癌转移性淋巴结的超声图像特征包括淋巴结肿大、形态趋圆、淋巴门消失、高回声区、囊性变、钙化、周边或中央异常紊乱血流信号等[3-7]。然而,超声诊断受操作者主观判断的影响较大,且部分淋巴结的位置难以清楚探查。本研究141个甲状腺癌中,18例甲状腺癌发生颈部淋巴结转移,其中13例出现淋巴门消失、囊性变、钙化等征象,12例CEUS出现充盈缺损。此外,甲状腺癌以中央区淋巴结转移最常见,而超声检查对中央区淋巴结转移的诊断灵敏度(42%~47%)低于颈侧区(70%~80%)[6]。因此,超声检查对某些特殊部位淋巴结转移的诊断价值较有限,若发现可疑淋巴结,可结合超声引导下穿刺检查以提高诊断效能。本研究中淋巴结转移例数较少,今后需要扩大样本量继续深入研究。
综上所述,边缘不规则、A/T≥1、微小钙化灶、不均匀性低增强、增强后肿块范围缩小、增强后肿块形态不规则与甲状腺乳头状癌病理组织变化密切相关。CEUS可提高甲状腺癌的诊断准确率,对手术方式选择、术后随访及预后评估均具有重要意义。

