大白菜转基因选择剂卡那霉素的浓度筛选
齐仙惠,李梅兰,巫东堂,李改珍,赵军良
(1.山西省农业科学院蔬菜研究所,山西 太原 030031;2.山西农业大学园艺学院,山西 太谷 030801)
大白菜(Brassica rapa subsp.pekinensis)属十字花科芸薹属植物,又称结球白菜、包心白菜、黄芽白、胶菜等,是一种原产于我国的蔬菜。其具有抗寒、适应性强、味甘等特点,营养价值很高。因此,大白菜的栽培和育种研究越来越受到人们的关注[1]。近年来,植物遗传转化已成为应用生物学研究的热门课题,为蔬菜品种的改良开辟了一条新途径。目前,植物遗传转化中常用的2类选择剂分别是除草剂类和抗生素类。其中,抗生素类的卡那霉素(Kan)是植物转基因研究中最常用的筛选标记[2-3],已被成功应用于黄瓜[4]、烟草[5]、水稻[6]、棉花[7-8]、花生[9]、菊花[10]等植物。由于不同物种和基因型以及外植体材料对Kan浓度的敏感性存在较大差异[11],所以,需要针对具体的研究材料进行Kan最佳筛选浓度的确定。
本试验拟研究不同浓度Kan对7#和9#大白菜幼苗生长发育的影响,通过比较2个品系在不同处理条件下的种子发芽率、子叶黄化率、下胚轴长度和幼苗鲜质量等,以筛选出2个大白菜品系的最佳选择浓度,旨在为今后筛选转基因大白菜植株奠定基础。
1 材料和方法
1.1 试验材料与试剂
供试大白菜品系为7#和9#自交系。试验试剂有卡那霉素(上海生工公司)、氯化汞、吐温(Tween-20,美国BBI公司)、乙醇。
1.2 试验方法
1.2.1 培养基配制 试验采用MS基本培养基,以30 g/L蔗糖为碳源,添加6.5 g/L的琼脂粉,调节pH值至5.8,用灭菌锅在121℃下灭菌20 min。灭菌后待培养基冷却至50℃左右时添加Kan,使培养基中 Kan 的终质量浓度分别为 0,100,150,175,200,225,250 mg/L。
1.2.2 种子消毒 取7#和9#大白菜种子,分别用无菌水冲洗干净后,在无水乙醇中浸泡1 min,再用无菌水冲洗3次,然后用0.1%的氯化汞溶液浸泡10 min,其中加一滴Tween-20,最后用无菌水冲洗5次。消毒后分别播种于含有不同浓度Kan的MS培养基上,每个处理50粒种子,重复3次。
1.2.3 培养条件和植株生长状态调查 将培养基置于培养温度为(25±1)℃、光照强度为1 500~2 500 lx,光/暗为16 h/8 h的培养室中,待种子萌发后统计各处理的发芽率并观察幼苗长势;培养7 d后统计各处理幼苗的子叶黄化率、下胚轴长、主根长、侧根数以及幼苗鲜质量。下胚轴的长度为下胚轴基部至芽顶端的长度,主根的长度为下胚轴基部至主根尖端的长度,侧根数为根长大于1 cm的第1侧根数。
1.3 数据统计与分析
采用SAS软件对生长于不同Kan浓度下的2个大白菜幼苗的种子发芽率、子叶黄化率、下胚轴长、主根长、侧根数以及幼苗鲜质量进行方差分析。
2 结果与分析
2.1 不同质量浓度Kan对种子发芽率及子叶黄化率的影响
将7#和9#大白菜种子接种到含Kan的培养基中,培养3 d后,种子陆续发芽。由统计结果可知(表1),除个别种子外,2个品种中几乎所有的种子都能正常萌发,说明Kan的不同浓度对大白菜种子的萌发基本没有影响。

表1 不同质量浓度Kan对7#和9#种子发芽率和子叶黄化率的影响 %
培养7 d后,在不含Kan的培养基中,7#和9#的幼苗生长健壮,没有出现子叶黄化现象。在添加了Kan的培养基中,随着Kan质量浓度的增加,子叶黄化率明显增加,并有部分幼苗因黄化严重而死亡(图1);当Kan质量浓度为175 mg/L时,7#和9#大白菜的黄化率分别为91.89%和83.72%;当质量浓度为225 mg/L时,二者的子叶黄化严重,黄化率分别为100%和97.22%;当质量浓度为250 mg/L时,二者的黄化率均高达100%(表1)。
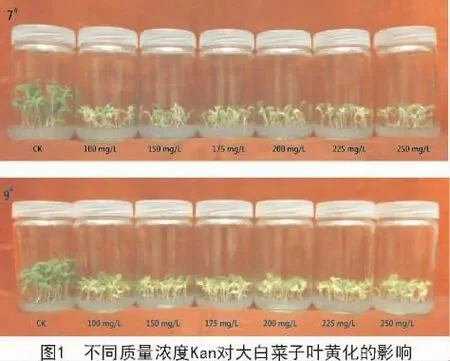
2.2 不同质量浓度Kan对幼苗生长的影响
幼苗在不含Kan的培养基中培养7 d后,植株生长健壮,子叶充分展开,大而浓绿,下胚轴正常生长,根系发达,侧根较多(图2)。其中,7#和9#的下胚轴长分别为3.13,1.76 cm,主根长分别为8.73,8.90 cm,分别具有 7.30,5.57条侧根(表 2,3)。

在添加Kan的培养基中,2个品种的子叶伸展不充分,小而发黄,植株矮化严重,下胚轴和主根明显短缩,根系不发达,没有侧根(图2)。随着Kan质量浓度的增加,7#和9#幼苗的下胚轴长和主根长、鲜质量均呈下降趋势,且显著小于对照植株 (表2,3)。

表2 不同质量浓度Kan对7#大白菜幼苗生长的影响
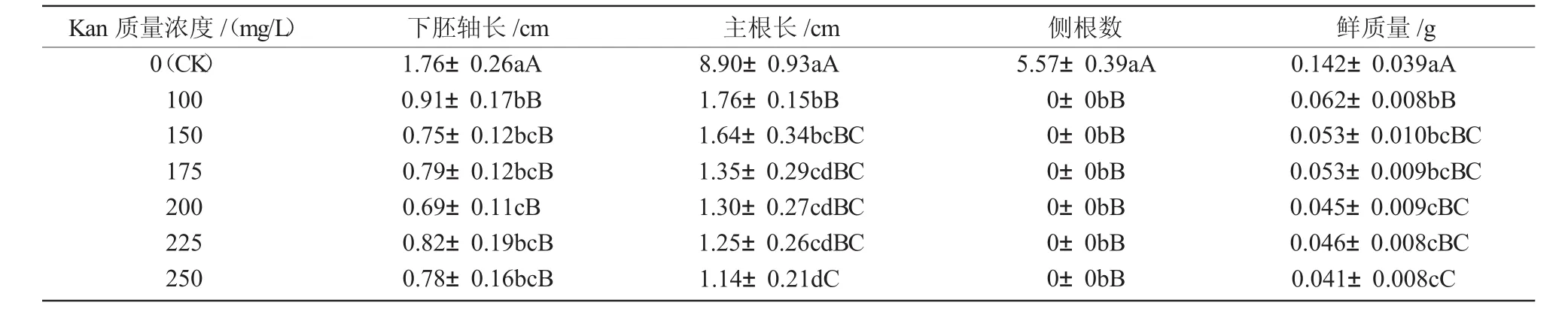
表3 不同质量浓度Kan对9#大白菜幼苗生长的影响
2.3 最佳Kan筛选浓度的确定
利用Kan作为选择剂,一般要求其既能有效抑制非转化细胞的生长,使之缓慢死亡,又不影响转化细胞的正常生长[12]。本试验中,100~250 mg/L的Kan均能有效抑制7#和9#大白菜幼苗的生长。其中,7#大白菜,在100 mg/L的Kan质量浓度下,子叶黄化率偏低(78.39%);在200 mg/L的质量浓度下则偏高(97.33%);在150,175mg/L的质量浓度下,子叶黄化率差异不显著,均在90%左右,因此认为,7#大白菜的最佳筛选质量浓度为150~175 mg/L。大白菜9#,在175 mg/L的Kan质量浓度下,子叶黄化率偏低(83.72%);在225 mg/L的质量浓度下则偏高(97.22%),因此认为,9#大白菜的最佳筛选质量浓度为200 mg/L。
3 讨论
张丽华等[13]对4个加工番茄品种的Kan抗性进行了筛选,结果显示,不同部位对Kan的敏感度不同:幼苗对Kan比子叶外植体敏感,而子叶外植体又比下胚轴外植体敏感。在本试验中,Kan对根长、下胚轴和植株鲜质量的增加均有负面影响,且对根长的影响比对下胚轴和鲜质量的影响大,可能是由于植株的不同部位对Kan的敏感性不同,也可能与根系直接生长在培养基中有关[14]。而2个品系大白菜种子的萌发并未受到Kan的影响,各浓度处理下的种子均表现出与对照组基本一致的发芽率,这可能是由于有种皮的保护导致其对Kan的敏感性较差,以及其只接触培养基表面的原因。
Kan已被广泛应用于遗传转化的选择上,利用合适浓度的Kan进行转化植株的筛选非常关键。筛选浓度太高,会影响转化种子发育为正常植株,筛选浓度太低又会有太多的逃逸体,从而加大后期鉴定工作的强度。不同物种和基因型对Kan浓度的敏感性有差异。张甲佳等[9]对4个花生品种的Kan敏感性进行了研究,结果表明,不同品种的花生胚小叶对Kan的敏感性差异较大,其中,D16的Kan敏感性最高,临界质量浓度为100 mg/L;其次是J11和鲁花11,临界质量浓度均为150 mg/L;而花育22的敏感性最低,临界质量浓度达到200 mg/L。张静等[15]研究也认为,Kan对萝卜种子萌发及生长发育有明显的抑制作用,随着Kan浓度的升高,致死率升高,主根和下胚轴长度变短。且不同品种对Kan的敏感性不同,在经Kan溶液浸泡后播种时,07Lb36-9和07Lb39的Kan致死浓度分别为150,300 mg/L。本试验中,7#和9#大白菜对Kan的敏感性也有所不同,其中,7#比9#敏感性高,故其所需的最适筛选浓度较低。但在大白菜遗传转化试验中,不同品种的抗性浓度仍需进一步研究。
4 结论
本试验利用不同浓度的Kan对7#和9#大白菜进行处理,观察子叶期幼苗生长情况并进行数据统计分析,研究结果显示,随着Kan浓度的增加,大白菜种子的萌发没有受到影响,但子叶的黄化率随之增加,下胚轴和主根的长度变短,鲜质量减轻,侧根数减少。此外,不同大白菜品系对Kan的敏感程度不同,7#大白菜的Kan最佳筛选质量浓度为150~175 mg/L,9#大白菜则为200 mg/L。这些结果可为其他大白菜品种的抗性浓度筛选提供参考。

