我国医疗设备标准现状及临床应用技术评价标准研究
陈斌,李斌,石镇山
1.机械工业仪器仪表综合技术经济研究所,北京 100055;2.上海市第六人民医院,上海 200233
引言
根据《医疗器械标准管理办法》,医疗器械标准是指医疗器械研制、生产、经营、使用、监督管理等活动中遵循的统一的技术要求,是医疗设备上市前依法注册检验的主要依据。世界先进国家同样要求上市的产品必须符合法规和标准的要求,欧盟医疗器械指令(MDD 93/42 EEC)明确协调标准是评定医疗设备符合法规基本要求的重要依据[1],所有上市产品须满足其质量体系或协调标准规定的技术要求。然而,对于上市后临床应用的安全性、有效性等评价各国法规文件没有统一的标准[2-3],对使用过程中的医疗设备临床应用技术评价也尚未作出明确规定。
临床应用技术是指具有一定实用价值的技术、理论、方法等,应用于医疗设备的正确选择与操作、方法的正确选择与判断等具体实践,以满足临床诊断与/或治疗需求。目前,医疗设备在使用过程中的临床应用评价标准化工作在国际国内都还处在刚刚起步阶段,本文探讨了国内外医疗设备标准化工作的现状、临床应用技术评价标准的具体内容和重要性初探,为生产企业、临床医生、临床医学工程师、医院决策者等提供新的技术手段和思路,以促进我国医疗设备产品安全、可靠、有效地应用于临床。
1 国外医疗设备标准现状
国际标准化组织(International Standard Organization,ISO)和国际电工委员会(International Electrotechnical Commission,IEC)是国际上最具权威性的标准化机构,医疗设备的国际标准也主要由这两个组织制定。在IEC的专业技术领域中,医用电气设备技术委员会(IEC/TC62)主管医疗设备相关国际标准,下设SC62A、SC62B、SC62C、SC62D四个分技术委员会,负责制定和发布医疗设备通用安全以及软件、可用性、电磁兼容等通用领域,影像设备、X射线设备、超声诊断设备、高频手术设备等专用领域国际标准制定与发布。IEC 60601是TC62制定的最主要的医疗设备系列标准,是目前国际普遍认可的医疗设备基本安全和基本性能标准,包括IEC 60601-1安全通用标准[4],适用于所有医疗设备,及其某一领域或特性下的安全并列标准,如电磁兼容、辐射保护等,以及专有设备或特殊设备的安全专用标准,如心电监护仪、无创血压计等。TC62现有医疗设备相关国际标准超过230项,近年来新开展了软件、信息系统、网络等领域的医疗设备国际标准制定。这些国际标准是各个国家对医疗设备进行上市检验和上市后监管的重要依据。在ISO的专业技术领域中,同样制定发布了一系列重要的医疗设备相关国际标准,其中最为重要的有ISO 14971医疗设备风险管理要求[5]和ISO 13485医疗设备质量管理体系用于法规的要求[6]。ISO 14971规定了医疗设备标准中提及的风险管理原则和实践行为,包括IEC 60601-1电气安全、ISO 13485质量管理体系、IEC/EN 62366医疗设备可用性、ISO 10993生物评价和IEC 62304医疗设备软件等,因此符合ISO 14971对于在各个国家寻求规管许可具有重要意义。
欧盟医疗设备标准管理体系由指令、符合性评估程序以及协调标准组成。根据医疗设备种类不同,欧盟设立的医疗器械技术委员会制定了三个医疗器械指令:医疗器械指令(MDD 93/42 EEC)、有源植入医疗器械指令(AIMD 90/385 EEC)和体外诊断医疗器械指令(IVD 98/79 EEC),是欧盟管理医疗设备产品的依据。医疗设备上市必须经过符合性评估程序,以证明产品满足指令的基本要求,基本要求由指令规定,详细的技术要求和定量指标由相关协调标准规定,协调标准可以是欧洲标准化委员会(CEN)制定的欧洲标准,也可以采纳ISO和IEC发布的国际标准。
无论是国际标准还是欧盟指令,这些标准都规定了医疗设备相关的安全和性能通用要求以及一些专用要求,涵盖设计、制造和使用的要求,但是在使用环节涉及的临床应用技术评价标准,都没有明确的规定和要求,医疗设备临床应用评价标准在国际上尚处于研究阶段。
2 我国医疗设备标准现状
2.1 医疗设备相关标准现状
2014版《医疗器械监督管理条例》将“注册产品标准”改为“产品技术要求”,改变了原有医疗设备国家标准、行业标准和注册产品标准组成的三级标准体系,产品技术要求成为医疗设备注册检验的主要依据,包括医疗设备的性能指标和检验方法。新修订的2017版《医疗器械标准管理办法》将医疗器械标准按其效力分为强制性标准和推荐性标准,按其规范对象分为基础标准、方法标准、管理标准和产品标准,同时明确了产品技术要求不得低于产品适用的强制性国家标准和行业标准[7]。
截止2017年6月底,我国医疗设备标准项目共计1552项。现行的国家标准304项,其中含强制性国家标准142项,主要以GB 9706医用电气设备安全要求相关标准为主,该系列标准是保证设备安全最基本的技术规范,主要依据IEC 60601-1系列标准[4],包括了主流诊疗设备的安全通用标准和安全专用标准,以及心脏起搏器、人工心肺机、外科植入物等的相关技术要求;推荐性国家标准160项,指导性文件2项,见图1。
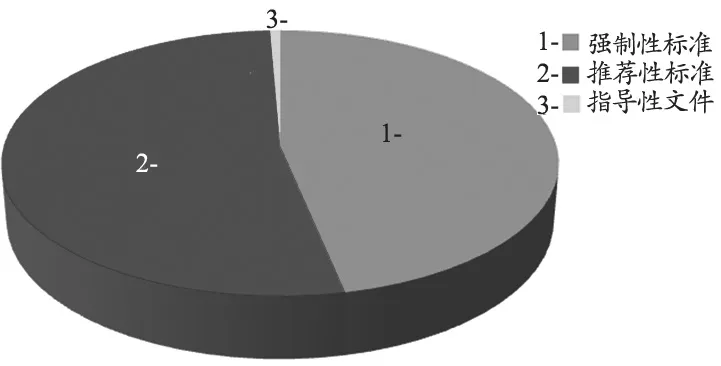
图1 医疗设备国家标准分布情况
现行的行业标准1248项,含强制性行业标准398项,推荐性行业标准850项。其中,基础通用标准117项,以产品通用技术条件为主;试验方法标准228项,以产品性能测试方法和试验方法为主;管理标准35项,以管理规范和试验指南为主,如YY/T 0287质量管理标准和YY/T 0316风险管理标准,分别对标ISO 13485和ISO 14971;产品技术标准868项,以产品性能指标和技术要求为主,见图2。

图2 医疗设备行业标准分布情况
2.2 标准化技术委员会现状
我国的医疗设备标准主要围绕ISO、IEC等国际标准为基础建立,按照专业领域设置相关技术委员会,负责专业领域内的标准化技术工作。我国医疗设备相关的技术委员会共24个[8-9],其中总技术委员会13个,包括医用电器、外科器械、口腔设备、医用注射器、外科植入物、体外循环、质量管理等;分技术委员会11个,其中,医用电器技术委员会下设X线设备、超声、放疗与核医学、物理治疗和医用电子仪器五个分技术委员会,外科植入物技术委员会下设三个分技术委员会,口腔设备技术委员会下设一个分技术委员会,以及其他两个分技术委员会。
我国医疗设备标准监管除了国家标准化管理委员会和国家食品药品监督管理总局制定、监督标准实施之外,国家卫生计生委下设的17个标准专业委员会中,有2个标准专业委员会与医疗设备标准化相关[10]。其中放射卫生标准专业委员会有224项放射卫生标准,以设备质量控制规范和卫生防护标准为主,其中设备相关标准包括了如CT、MR、DR、CR、乳腺X射线机等主流产品的质量控制规范;信息标准专业委员会有175项相关标准,以电子病历、健康档案、信息系统、远程医疗等标准为主,在医院信息化以及医疗设备互联互通方面发挥了重要作用。
2.3 临床应用技术评价标准主要内容
现行的医疗设备标准体系以产品为中心、以技术标准为重点、以管理标准为基础,主要从国际标准转化而来,缺乏符合临床应用特点及中国国情的应用评价体系[11]。目前,对在用医疗设备的评价已从传统的单一设备性能评价逐渐转变到在人机环境下的系统评价和社会体系下的经济效益[12]及服务体系评价上来。2016年,国家重点研发计划专项中专门设置了创新医疗设备产品评价研究项目,开展对PET/CT、MR、立体定向放疗等设备的临床效果、临床功能及适用性、可靠性、技术性能和服务体系等评价研究,临床应用技术评价方面的标准研究工作逐渐在我国兴起[12]。目前,包括PET/CT、MR、立体定向放疗等项目的临床应用技术评价工作已相继开展,目标是形成评价方法和评价规范,最终构建符合我国发展现状的医疗设备临床应用评价体系。运用卫生技术评估方法及工程技术评价方法,从设备的技术性能、临床效果、可靠性和安全性、可用性、经济性以及售后服务质量等方面进行系统的临床应用技术评价,可以为医疗设备的安全可靠使用、合理配置及采购决策提供重要评价依据,推动我国医疗设备整体水平进入国际先进行列[13-16]。
我们对使用过程中医疗设备的临床应用技术评价作了总结,提出我国医疗设备临床应用技术评价标准的具体四个方面内容:
(1)技术特性评价。应用工程学、生物学和医学的理论和方法,运用工程技术手段来评价医疗设备的工程与物理参数、性能等指标符合相关产品技术要求,并达到临床应用的安全性、可靠性和有效性要求[17]。
(2)临床应用评价。运用临床医学理论与方法,基于所获得的图像、图形、数据(含病历、疾病谱等)等临床信息,对临床应用中的有效性、安全(风险)性及临床效果进行综合评价。
(3)卫生经济学评价。基于经济学评价的基本原则,结合医疗设备临床应用中经济活动的特殊性,对其成本与效果等进行评估[18-20]。
(4)服务体系评价。应用管理学的理论与方法,对服务提供方提供的服务进行评价,包括三个层面的评价:企业售后服务层面,包括组织结构与功能、基本条件(人员场地、工具、备件资源)、管理体系等;产品服务层面,包括场地规划、配送服务、安装调试、产品保证、维护服务、投诉处理等;客户服务层面,包括应用培训、应用研究、工程技术支持、客户管理系统等[21-22]。
3 讨论
临床应用技术评价标准的意义表现在以下几个方面:
(1)填补我国医疗设备临床应用评价标准体系的空白。在现有的医疗设备标准体系下,标准化技术委员会主要负责上市前医疗设备的研制、生产、经营、临床试验、注册和质量管理等方面的标准化工作,而上市后的临床使用、在役设备检测、评价等临床应用标准化工作没有明确的专业技术委员会来开展相关工作。新的《医疗器械标准管理办法》增加了技术归口单位的职责,提出医疗设备领域高新技术密集,存在着现有医疗器械标准化技术委员会不能覆盖的专业技术领域,根据需要按程序可以确定其标准化技术归口单位,为这一领域的标准研究和推广提供了可能。此外,国家卫生计生委下设的医疗服务标准专业委员会负责医疗服务相关的质量、安全、服务、技术等相关标准,但是直接与医疗设备临床应用相关的标准不仅少、适用范围局限,而且缺少必要的卫生技术评价。从现状分析来看,我国在用医疗设备的临床应用技术评价标准严重缺乏,建立符合我国国情的临床应用评价标准,可以填补其标准体系的空白。
(2)临床应用技术评价标准是医疗设备产品技术要求的延伸和有效补充。医疗设备进行注册和备案时,须符合强制性标准及经注册或备案的产品技术要求,包括产品的功能性、安全性指标以及与质量控制相关的其他指标。医疗设备产品技术要求,包括国家标准、行业标准以及其他与产品设计特性、预期用途和质量控制水平相适应的技术要求,主要以产品的性能指标为主,在医疗设备申报注册环节依据其标准进行检测并最终判定是否符合该标准要求,作为检测评价设备性能的重要依据。而卫生行业标准主要以产品质量控制检测为主,包括产品验收检测、状态检测和稳定性检测等,是医院对医疗设备进行质量控制的重要依据,保证其稳定运行。然而,无论是检测标准还是质量控制标准,都以医疗设备性能指标参数为主,没有结合人机环境下在用医疗设备的临床应用特点,在使用过程中缺乏必要的临床应用技术评价,导致用户较为关注的质量特性、经济性与技术服务等指标参数难以体现,缺少例如可靠性、可用性、有效性、安全性、经济性、可维修性、人因工效、软件要求等指标。医疗设备产品在长期使用过程中的质量稳定性与可靠性、临床效果、经济性、可维修性等临床应用评价可以有效补充其产品技术要求的范围,使其评价内容扩展到临床应用的全生命周期[23],通过临床应用技术评价回答医生使用过程中普遍关心的不敢用或不好用问题,用标准化的手段来推进设备临床应用,提高医疗设备安全性、可靠性等水平,以满足保障医疗安全、提高医疗质量的要求。同时,现有的医疗设备标准更多是从国际标准转化或依照专家经验,循证证据不足,相关试验测试方法不完善,实用性、可操作性较差[24]。产品技术要求的法律地位的确认,促进了检验方法的制定与其对应的性能指标相适应,保证其具有可重现性和可操作性。因此,在制定、应用和推广医疗设备临床应用评价标准的同时,也亟需进一步完善临床应用技术评价的检测方法体系,提高可实施性。
(3)临床应用技术评价标准是医疗设备使用过程中的综合评价依据。在临床准入和使用维护阶段,临床应用技术评价应当回答几个问题,设备是否具备基本的物质基础,临床效果能否满足临床需求,能否达到更好的成本效益,以及是否具有持续的技术保障能力。其具体内容包括技术特性评价、临床应用评价、卫生经济学评价、服务体系评价四个方面,为医疗设备使用过程中的性能质量、临床效果、经济性和可维修性等问题提供一套综合评价体系,以促进我国医疗设备产品安全、可靠、有效地应用于临床,帮助生产企业、临床医生、临床医学工程师、医院决策者等有效、合理地评估医疗设备。
4 结束语
在我国医疗设备发展新形势下,应不断适应创新发展和市场需求,加快推动医疗设备临床应用技术评价标准实现新突破,进一步完善医疗设备标准体系,满足医疗设备监管、临床准入评价、产业发展和应用推广的新需求,以先进应用标准倒逼医疗设备质量水平不断提升,推动我国医疗设备在临床的安全、可靠和有效使用,为医疗机构、医务人员、患者以及社会带来更好的效益。
[参考文献]
[1] 黄进.世界主要国家和地区的医疗器械法规及全球协调简介[J].中国医疗器械信息,2007,13(8):46-51.
[2] 郭准.欧盟医疗器械管理探究[J].中国医疗器械信息,2012,(12):40-43.
[3] 陈以桢,高惠君.美国、欧盟医疗器械法规概况及与我国法规的对比[J].中国医疗器械杂志,2008,32(3):218-226.
[4] Ed.3.1,2012,IEC 60601-1 Medical Electrical Equipment-Part 1: General Requirements for Basic Safety and Essential Performance[S].
[5] Ed.2.0,2007,ISO 14971 Medical Devices-Application of Risk Management to Medical Devices[S].
[6] Ed.2.0,2003,ISO 13485 Medical Devices-Quality Management Systems Requirements for Regulatory Purposes[S].
[7] 李军.我国医疗器械标准现状调研[J].中国医疗器械杂志,2009,33(5):362-368.
[8] 杨晓芳,王越,母瑞红,等.我国医疗器械专业标准化技术委员会管理现状及分析[J].医疗装备,2014,27(10):16-18.
[9] 董放.对医疗器械标准技术委员会管理的几点思考[J].中国药物警戒,2010,7(4):211-213.
[10] 陈广刚,吕荷叶.我国医疗卫生标准的现状、问题及建议[J].中国卫生监督杂志,2014,21(6):534-538.
[11] 张勇,程敬亮,薛康康.MRI设备及其临床应用评价研究[J].磁共振成像,2017,8(1):1-3.
[12] 姬宇虹,韩雪飞,田小亨,等.基于医疗大数据的大型医疗设备绩效考核的可行性分析[J].中国医学物理学杂志,2017,34(11):1180-1184.
[13] WHO.Health Technology Assessment of Medical Devices[M].Switzerland:WHO Press,2011.
[14] WHO.Measuring Clinical Effectiness[M].Switzerland:WHO Press,2011.
[15] WHO.Safe Use of Medical Devices[M].Switzerland:WHO Press,2011.
[16] WHO.Medical Equipment Maintenance Programme Overview[M].Switzerland:WHO Press,2011.
[17] 李向东,黄韬,崔骊.医疗设备临床使用风险分析和评估体系的研究[J].中国医学装备,2012,9(9):15-17.
[18] 王剑,赵加奎,魏晓敏,等.经济学评价方法现状及在公共卫生领域的应用[J].中国卫生资源,2013,16(5):353-355.
[19] 肖荣.大型医疗设备成本效益分析[J].江苏科技信息,2016,(7):48-49.
[20] 王瑞.大型医疗设备单机管理的绩效评价指标设计[J].行政事业资产与财务,2016,(4):23-24.
[21] 尹军,刘相花,徐力,等.新购进医疗设备售后服务评价研究[J].中国医疗设备,2017,32(6):159-162.
[22] 谢松城.医疗设备售后服务质量评定的初体验[J].中国医院院长,2008,(21):67-69.
[23] 贺伟罡.风险管理与医疗器械标准[J].中国医疗器械信息,2010,16(6):43-46.
[24] 杨晓芳,王春仁,杨昭鹏,等.从医疗器械注册检验角度看待医疗器械标准体系的问题与发展[J].生物医学工程学杂志,2013,30(3):546-551.

