隆突性皮肤纤维肉瘤的影像学表现及临床病理分析
史凤霞,李红玲,刘建滨,郭一清
1.湖南省人民医院放射科,湖南长沙 410005;2.湖南省人民医院病理科,湖南长沙 410005;
隆突性皮肤纤维肉瘤(dermatofibrosarcoma protuberans,DFSP)是一种生长缓慢的纤维组织源性的交界性肿瘤,好发于躯干、四肢及头颈部的真皮,并向皮下延伸。2013版WHO软组织肿瘤分类将其归为成纤维细胞/肌成纤维细胞性肿瘤中少见转移的中间型肿瘤[1]。DFSP呈侵袭性生长、复发率高,影像学常误诊为良性肿瘤,手术切除不彻底局部极易复发。因此,正确的术前诊断对临床治疗具有重要价值。本研究通过回顾性分析11例经手术及病理证实的DFSP患者的临床、影像及病理资料,以提高对本病的认识。
1 资料与方法
1.1 研究对象 回顾性分析2009年9月-2017年3月经湖南省人民医院手术病理证实并接受CT或MRI检查的DFSP患者11例,其中男5例,女6例;年龄10~53岁;5例行CT检查(1例增强),6例行MRI检查(4例增强)。
1.2 仪器与方法 采用Philips Brilliance 16、Philips iCT扫描仪,管电压100~120 kV,管电流171~313 mAs,层厚5 mm,增强扫描采用非离子型对比剂欧乃派克(300 mgI/ml),剂量1.5 ml/kg,经高压注射器注射,注射速度2.5 ml/s。采用Siemens Magnetom Trio 3.0T和Philips Achieva 1.5T扫描仪,MR扫描序列包括横轴位、冠状位或矢状位 FSE压脂或不压脂 T1WI(TR 450~700 ms,TE 10~22 ms)、T2WI(TR 2000~5000 ms,TE 61~140 ms),增强扫描使用SE序列(TR 450~893 ms,TE 9.9~20 ms)或VIBE序列TR 4.2 ms、TE 1.6 ms,以0.1 mmol/kg注射扎喷酸葡胺。增强扫描包括动脉期(注射造影剂后20 s)、门静脉期(注射造影剂后约50 s)。
1.3 观察指标 观察肿瘤部位、形态、数目、边缘、信号特征、与周围组织的关系、增强表现等;记录主要临床表现。病理资料包括病理诊断及免疫组化分析。所有病例通过PACS系统由2位医学影像学主任医师评估,两者对影像表现达成一致意见。
2 结果
2.1 临床特征 11例DFSP中,发生于躯干4例(其中胸壁2例、腹壁1例、背部1例),乳腺2例,四肢2例,头皮2例,颈部左耳下1例。本组患者均以体表肿块就诊,7例单发结节、4例多发结节,病程2个月~30年。8例表面皮肤呈暗红色或青紫,1例表面溃烂,2例压痛。4例见手术瘢痕,1例有烫伤史。2例复发病例距首次手术时间为4~14年。1例左耳下局部病灶切除后病理诊断为 DFSP行扩大根治手术。
2.2 影像学表现
2.2.1 病灶基本情况 11例DFSP的部位、形态、大小见表1。11例患者共18枚病灶,均位于皮肤或皮下,呈单发结节或多发结节状隆起生长。4例多发病灶均呈匍匐的丘状相连。肿瘤大小5 mm×5 mm×3 mm~95 mm×73 mm×40 mm。
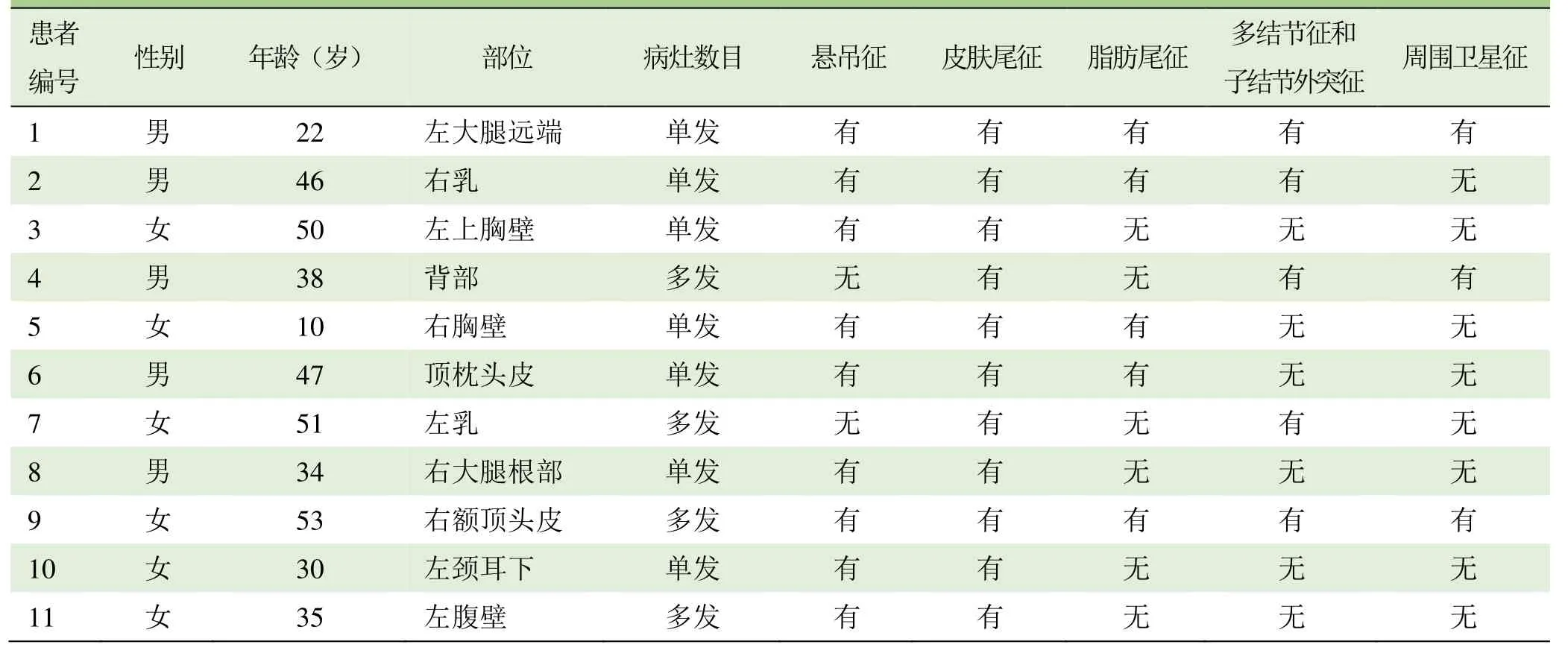
表1 11例DFSP的临床及影像学表现
2.2.2 CT与MRI表现 6例患者行MRI检查,其中5例T1WI呈等信号、T2WI呈高信号,1例因合并出血T1WI呈稍高及高信号、T2WI呈稍高及高信号影,信号不均匀。5例患者CT示等密度影,部分夹杂少许低密度影。3例MRI中可见完整包膜,呈清晰低信号影。CT增强扫描1例呈轻度强化;MRI增强扫描4例呈明显强化,其中1例左乳DFSP动态增强时间-密度曲线呈平台型和流出型。
本组9例共15枚病灶出现悬吊征(图1A、B,图2A、B,图3A~D)。所有病例均显示皮肤尾征(图2A及图3E)。5例显示脂肪尾征(图1B)。5例同时显示多结节征和子结节外突征,其中3例为多发病例(图2C)。3例可显示周围卫星征,其中2例为多发病灶(图3D)。
2.3 病理诊断 本组病例结节 5 mm×5 mm×3 mm~95 mm×73 mm×40 mm,质地坚韧,切面呈灰白色或淡黄色。肿瘤位于真皮内,肿瘤由弥漫性浸润生长的短梭形细胞构成,瘤细胞常呈特征性的席纹结构,细胞的异型不明显(图1C、D)。核分裂各病例之间数量不等(0~10个/10 HPF),其中复发病例除特征性的席纹结构外,瘤细胞异型性增加,核分裂明显活跃,可见巨细胞,并出现黏液变性。本组病例均行免疫组化检测,瘤细胞较一致表达CD34(图3F),Ki-67一般低于5%,但复发病例及纤维肉瘤型DFSP的Ki-67表达显著增高,部分可达30%(图2D)。2例CD68 局灶阳性,11例平滑肌肌动蛋白及S-100均呈阴性。

图1 男,34岁,右腿DFSP。CT平扫冠状位重组呈软组织密度肿块影,可见悬吊征(A);CT平扫矢状位重组可见悬吊征、脂肪尾征(箭,B);经典型DFSP的组织学形态:席纹状、车辐状的排列结构(HE,×20,C);瘤细胞浸润至皮下脂肪组织呈蜂窝状(HE,×20,D)

图2 男,46岁,右乳DFSP,局部纤维肉瘤转化。CT平扫横轴位可见悬吊征、皮肤尾征(箭,A);CT平扫矢状位重组可见悬吊征、多结节征、脂肪尾征(箭,B);冠状位重组可见多结节征,瘤灶内夹杂低密度影(箭,C);瘤细胞失去席纹状排列,呈细长的条束状或鱼骨状排列,类似纤维肉瘤(HE,×10,D)

图3 女,53岁,右额顶多发DFSP(4枚)。T2WI横轴位示右顶头皮2枚DFSP呈高信号,可见悬吊征,多发瘤灶呈丘状相连并见多结节征、子结节突起征(A);T1WI呈低信号(B);增强扫描示瘤灶明显强化,可见悬吊征,多发瘤灶呈丘状相连并见多结节征、子结节突起征(C);矢状位增强扫描示右额2枚DFSP明显强化,前部瘤灶见周围卫星征,后部瘤灶见悬吊征(D);增强扫描横轴位示右额DFSP明显强化,可见皮肤尾征(箭,E);瘤细胞弥漫性表达CD34(HE,×20,F)
3 讨论
3.1 临床与病理特征 DFSP由Taylor于1890年首次发现确定;由Darier等于1924年首次报道,称为“进展和复发性的皮肤纤维瘤”;1925年由Hoffman命名为“隆突性皮肤纤维肉瘤”[2]。本病占成人软组织肉瘤的5%,年发病率约为5/1000000[3]。临床上各年龄段均可发生,包括婴幼儿和老人,20~50岁为发病高峰年龄。本组发病年龄为10~53岁,与文献报道相符[2-3]。本病好发于躯干(腰背部、胸壁、腹壁)和四肢,其次为头颈部,偶见外阴、腮腺、乳腺等。本组发病部位与文献相符[1-3]。2例发生于乳腺者为少见部位;也可见于既往外伤部位(包括烧伤、创伤、免疫接种等)[3-4]。本组1例患者有烫伤史、2例手术后复发、2例有局部手术史,推测与瘢痕处纤维组织修复、过度增生有关。本病病程数月至数年不等,最长达10年[2]。本组病程2个月~30年,6例病史大于7年,部分长达30年,提示DFSP是一种生长缓慢的肿瘤,与文献报道相符[5]。
DFSP的病理大体形态上原发肿瘤多为单结节状肿块,多发者少见,复发性病变可为多灶性,肿瘤多位于真皮内,少数位于深筋膜内,组织形态上DFSP多种多样,包括经典型、色素型、纤维肉瘤型、黏液样型、萎缩型、硬化性等多种类型[6]。经典的DFSP呈真皮层内单一短梭形细胞浸润性生长,瘤细胞异型性不明显,病理性核分裂象较少。肿瘤中心区域瘤细胞丰富,常呈特征性的席纹状、车辐状排列,即由紧密的梭形瘤细胞与胶原纤维围绕一个中心呈放射状排列,典型的车辐状结构中央为致密的胶原纤维束或小血管。在浅表部位及周边部位,瘤细胞纤细,多呈不规则的束状排列,巨细胞、黄色瘤细胞和炎症细胞较少或缺如。肿瘤表面被覆表皮与肿瘤的浅表部之间常有一条细胞稀疏带,肿瘤向深部脂肪浸润,沿小叶间隔形成特征性的蜂窝样图像,可浸润至周围肌肉和骨组织[4]。瘤细胞弥漫强阳性表达CD34,纤维肉瘤型和黏液样DFSP区域中,CD34标记明显减弱,甚至可为阴性[6]。除CD34外,DFSP还可表达载脂蛋白D,伴有肌样分化的肌样结节表达actins,但不表达S-100、平滑肌肌动蛋白、desmin,电镜下瘤细胞呈典型的成纤维细胞、肌成纤维细胞、树突样细胞、神经周细胞和原始间叶细胞的特征,并可产生 COL1A1-PDGFB的融合性基因[6]。
3.2 影像学表现 影像学可清晰显示DFSP的密度或信号特点、部位、形态、大小及浸润范围、与周围血管及神经的关系。MRI是软组织肿瘤的首选检查方法。DFSP位于皮肤或皮下,位置表浅,直接手术切除的患者居多,临床上行影像学检查较少,故本组病例数量有限。本组11例DFSP均位于皮肤或皮下,其中9例不同程度地向皮肤隆突性生长,部分悬吊于皮肤外,这种生长方式具有一定的特征性,影像学多表现为悬吊征。本组病例均可见皮肤尾征,表明DFSP发生于皮肤并向皮下延伸,与病理起源相符,其征象具有较高的特异性。
本组4例多发,瘤灶均呈丘状相连,其多结节征、子结节外突征、周围卫星征常见,表明上述征象具有一定的特征性;4例多发患者中,2例为复发病例,1例有肿瘤手术切除史,表明DFSP复发病例易多发且具有一定的恶性生物学倾向。MRI对肿瘤包膜显示良好,本组3例可清晰显示完整的包膜。
本组4例MRI增强扫描均呈明显强化,与文献报道相符[7]。文献报道DFSP增强扫描后具有纤维性肿瘤的特征,主要表现为渐进性强化或延时强化[8]。本组1例CT增强扫描及4例MRI增强扫描,除1例乳腺外,均未做动态增强,故无法总结其动态增强特征。
原发性乳腺肉瘤是罕见的间叶性肿瘤,占所有乳腺恶性肿瘤的0.2%~1.0%,乳腺DFSP更为罕见,发病率约为0.8/1000000,既往文献均为个案报道[9]。本组有2例乳腺DFSP,其中1例为男性,瘤体巨大,瘤灶部分纤维肉瘤转化,CT平扫与同层肌肉组织相比,DFSP瘤灶呈等密度影,其内夹杂片状低密度影,可见悬吊征、多结节征、子结节外突征,瘤灶巨大、密度不均匀可能与纤维肉瘤转化有关;另 1例乳腺DFSP为女性复发病例,复发病灶与肌肉相比,T1WI呈等信号,T2WI呈高信号,动态增强明显强化,时间-密度曲线呈平台型及流出型,体现了肿瘤有恶性的生物学特征,与文献报道类似[3]。
DFSP复发率高,可达50%~70%,极少发生转移,常发生于肺部[2]。约5%可发生纤维肉瘤转化[3]。本病治疗上以外科手术为主,切缘至少包括瘤灶周围 2~3 cm范围,切除范围不足容易导致局部复发。放疗适用于不可切除的病灶和切缘阳性者、广泛的切除致残或导致功能缺陷者[3];化疗药物伊马替尼试用疗效尚可[10]。
总之,DFSP表现为病史较长的皮肤及皮下肿瘤,悬挂征、皮肤尾征、多发者呈丘状相连;且伴多结节征、子结节外突征和周围卫星征是其特征性影像学表现,最终诊断需结合临床病理学。

