富G寡聚核苷酸修饰的金纳米粒子与细胞相互作用的研究
孙艳红 魏 佳 王振新 孟宪瑛*
1(吉林大学白求恩第一临床医院甲状腺外科, 长春 130021)2(中国科学院长春应用化学研究所 电分析化学国家重点实验室, 长春 130022)
1 引 言
金纳米粒子(GNPs)具有合成简单、形貌易于控制、易修饰并具有较强的表面等离子体共振(SPR)光吸收等特点,自1996年,Mirkin等将单链寡聚核苷酸(ssDNAs)修饰的GNPs应用于比色分析以来,ssDNAs与GNPs复合物(ssDNA-GNPs)作为纳米探针或纳米药物载体在生物分析和生物医学领域得到了广泛应用[1~14]。以ssDNA-GNPs为探针的分析方法通常具有灵敏度高和选择性好的特点。例如,与有机染料标记的荧光法相比,GNPs为探针的比色法对目标ssDNA的检测限能够降低2个数量级以上,并具有较宽的线性范围,能够实现复杂样品中低丰度目标ssDNA的检测[4,6]。另外,由于GNPs被认为是最稳定的生物相容性材料之一,从而使基于GNPs的诊断与治疗相结合的纳米复合物逐渐成为一类有良好临床应用前景的纳米药物。已有研究表明,ssDNA-GNPs能够逃避细胞的免疫反应进入到细胞内部,实现细胞内物质高灵敏检测以及基因调控[12,14]。
ssDNA-GNPs的生物化学性质(DNA杂交、分子识别等)与所修饰的ssDNA的二级结构密切相关,ssDNA的表面密度、二级结构等均能够影响其反应活性[13,15]。G四链体(G-quadruplex,G4)是由富含串联重复鸟嘌呤(G)的DNA或RNA折叠形成的核酸二级结构,因其具有调控基因表达的生物学功能,被认为是一种潜在的肿瘤治疗药物或靶点。相对于线性ssDNA,具有G四链体二级结构的ssDNA能够被细胞表面的A类清道夫受体(SR-A)识别,并由脂筏/小窝介导进入细胞,极大地增加ssDNA-GNPs复合物的细胞内吞量[15]。另外,研究表明,细胞对ssDNA-GNPs的吞噬量与ssDNA的序列有关,即细胞对富含碱基G的ssDNA-GNPs的吞噬量高于富含碱基A、T、C的ssDNA-GNPs[16]。据此,研究不同序列富含G碱基的 ssDNA修饰的GNPs与细胞相互作用的差异,对构建高效的基于ssDNA-GNPs的纳米探针或基因载体有积极意义。目前,富G碱基ssDNA修饰的GNPs与细胞相互作用行为尚不清楚。本研究合成了两种富G 的ssDNA-GNPs(PolyG1-GNPs和PolyG2-GNPs),系统地考察了ssDNA的二级结构对ssDNA-GNPs的细胞毒性、细胞吞噬行为及其细胞内分布等的影响。
2 实验部分
2.1 仪器与试剂
UVmini-1240紫外可见吸收光谱(日本岛津公司); ELAN 9000/DRC电感耦合等离子体质谱(ICP-MS,美国Thermo Fisher Scientific公司); HITACHI H-600型透射电子显微镜(TEM,日本Hitachi公司),5415R型高速冷冻离心机(德国Eppendorf公司); Nano-ZS粒度仪(英国Malvern公司); HPC-250CL 恒温恒湿箱(上海申贤恒温设备厂); ZLS-1真空离心浓缩仪(湘仪离心机有限公司); Power Wave XS2型微孔板分光光度计(美国BioTek仪器有限公司),Thermo Forma 371型恒温恒湿二氧化碳细胞培养箱(美国Thermo Fisher Scientific公司)。
氯金酸(HAuCl3·3H2O,阿拉丁公司); 二水合柠檬酸三钠(C6H5Na3O7·2H2O,北京华腾化工有限公司); 青霉素和链霉素混合液、胰蛋白酶、胎牛血清(FBS)、达尔伯改良伊格尔培养基(DMEM)、二甲基亚砜(DMSO)以及3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT)均购于北京鼎国生物技术公司; 根据文献[16]报道设计的二硫键修饰ssDNAs(PolyT: 5′TTT TTT TTT TTT TTT TTT TTT TTT-C6H12S-SC6H133; PolyG1: 5′GGT GGT GGT GGT CCT CCT CCC GGT GGT GGG AGG AGG TTT TTT-C6H12S-SC6H133; PolyG2: 5′GGT GGT GGT GGT GGT GGT GGT GGT GGT GGT GGT GGT TTT TTT-C6H12S-SC6H133)由上海生工生物工程股份有限公司合成; HeLa(人宫颈癌细胞)细胞株购自中国科学院上海细胞库; 其它化合物均为分析纯,购于北京化工厂。实验用水为Milli-Q(美国Millipore公司)制备的超纯水(18.2 MΩ cm)。
2.2 ssDNA-GNPs的合成
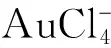
2.3 ssDNA-GNPs的细胞毒性和吞噬实验
向DMEM中添加10% (V/V)FBS、1%(m/V)青霉素和1 %(m/V)链霉素配制完全培养基(CM)。将100 μL CM和8000个HeLa细胞加入96孔板的孔中,在二氧化碳培养箱(37 ℃,5% CO2)中培养24 h。 用100 μL PBS清洗后,分别加入含不同浓度(5、25和50 μg/mL)ssDNA-GNPs的100 μL CM, 继续培养24 h。 用100 μL PBS清洗后,加入90 μL DMEM和10 μL 5 mg/mL MTT。孵育4 h后,加入100 μL DMSO,轻轻振荡,使紫色结晶完全溶解,然后使用酶标仪在490 nm波长下进行吸光度检测。以相同条件下正常培养的细胞为对照组,计算与ssDNA-GNPs作用后细胞的相对活率。
将1.3×105个HeLa细胞于12孔板内孵育24 h 后, 将细胞和25 μg/mL ssDNA-GNPs在不同条件下(CM中37℃、CM中4℃、DMEM中37℃或DMEM中4℃)孵育12 h。用100 μL PBS清洗3次后,使用胰蛋白酶将细胞消化并使用血细胞计数器来对细胞进行计数。加入1 mL 王水孵育24 h, 使用ICP-MS检测细胞中Au的含量。同样条件下,HeLa细胞与ssDNA-GNPs作用后,使用1 mL 多聚甲醛固定胰蛋白酶消化的细胞制备细胞切片,用于TEM观察。同样条件下,HeLa细胞与ssDNA-GNPs作用后,使用超声波细胞粉碎仪(4 min,超声30 s,间隔40 s)将胰蛋白酶消化的细胞打碎,加入100 μL PBS,混匀,转移到96孔板内,使用酶标仪记录其紫外-可见吸收光谱。

图1 PolyG1和PolyG2在PBS中的圆二色谱,PolyG1和PolyG2的浓度为17 μmol/LFig.1 Circular dichroism (CD) spectra of PolyG1 and PolyG2 in PBS. The concentrations of PolyG1 and PolyG2 are 17 μmol/L respectively
3 结果与讨论
3.1 ssDNA-GNPs的合成与表征
PolyG1和PolyG2在PBS中的圆二色谱(CD)如图1所示,PolyG1在238 nm处有一个负的CD吸收峰,PolyG2在260 和240 nm 处有一对对称的CD吸收峰。在此反应条件下,PolyG1为线性结构,而PolyG2能够形成G四链体二级结构[19,20]。如图2所示,所制备的柠檬酸钠保护的GNPs具有较好的分散性,平均粒径为(13±1) nm,水合粒径为(13.4±2.4) nm, 最大SPR吸收峰位于519 nm处,与文献[4,6]报道的结果一致。PolyT因与GNPs具有较高的反应活性,通常在制备ssDNA-GNPs过程中被用作稳定剂。分别使用不同摩尔比的PolyT∶PolyG1或PolyT∶PolyG2与GNPs反应制备ssDNA-GNPs。结果表明,ssDNA-GNPs在PBS中的胶体稳定性随ssDNA混合物中PolyT的比例增加而增强。当ssDNA混合物中PolyT摩尔比低于20%时,所合成的ssDNA-GNPs在PBS中易发生聚集。此现象可能是由于PolyG1或PolyG2与GNPs的反应效率低,使其表面存在一定量的活性位点,并与PBS中Na+产生静电作用导致的。综合考虑ssDNA-GNPs的胶体稳定性以及与细胞的反应活性,在后续的实验中使用摩尔比为1∶4的PolyT∶PolyG1或PolyT∶PolyG2与GNPs反应制备ssDNA-GNPs。如图2和表1所示,TEM、紫外可见吸收光谱、水合粒径分析表明,制备的ssDNA-GNPs在不同的分散介质中均能够保持良好的分散性。ssDNA修饰后,GNPs的最大SPR吸收峰发生红移,水合粒径增大,与文献[1~3,21]报道的结果一致。另外,由于ssDNA-GNPs与完全培养基(CM)中的蛋白质相互作用,蛋白质吸附在ssDNA-GNPs表面, 使其水合粒径和表面荷电量进一步增大。

图2 (A)柠檬酸根保护的GNPs、 (B)PolyG1-GNPs和(C)PolyG2-GNPs的TEM图; (D) 0.32 nmol/L GNPs的紫外-可见吸收光谱Fig.2 Transmission electron microscopy (TEM) images of (A) citrate-capped gold nanoparticles (GNPs), (B) PolyG1-GNPs and (C) PolyG2-GNPs; (D) Corresponding UV-vis absorption spectra, the concentrations of three GNPs are all 0.32 nmol/L
表1 ssDNA-GNPs在不同介质中的最大SPR吸收峰、水合粒径和Zeta电势
Table 1 Maximum SPR absorption bands, hydrodynamic sizes and Zeta potentials of as-prepared ssDNA-GNPs

3.2 细胞对ssDNA-GNPs的吞噬机制
ssDNA-GNPs具有与所修饰ssDNA类似的生理功能,无需阳离子或亲脂性转染试剂即可进入细胞内部,因此被认为是一类具有良好应用前景的纳米药物[22]。早期已有研究报道ssDNA的碱基种类能够影响ssDNA-GNPs与细胞的作用方式[16],但未具体研究ssDNA的构型对ssDNA-GNPs与细胞相互作用的影响。使用ICP-MS测定了不同条件下与ssDNA-GNPs共培养后,HeLa细胞中GNPs的含量。如图3A所示,在正常培养条件(37℃下CM中)下,单个HeLa细胞中的PolyG1-GNPs和PolyG2-GNPs含量分别为4.7105和6.4105个,表明二者均与HeLa细胞有较强的相互作用。HeLa细胞对PolyG2-GNPs的吞噬量大于文献[16]报道的SR-A高表达的C166细胞对富G碱基ssDNA修饰的GNPs的吞噬量(5105个/细胞)。另外,在所有实验条件下,HeLa细胞对PolyG2-GNPs的吞噬量均大于其对PolyG1-GNPs吞噬量,这表明具有G四链体二级结构的PolyG2能够通过与细胞表面受体(如A-SR等)的相互作用增加细胞对PolyG2-GNPs的内吞。相同培养温度下,在DMEM中培养的HeLa细胞对ssDNA-GNPs的吞噬量约为正常培养的HeLa细胞对ssDNA-GNPs吞噬量的16倍。相同的培养基中,在4℃下培养的HeLa细胞对ssDNA-GNPs的吞噬量小于在37℃下的HeLa细胞; 其中正常培养的HeLa细胞对ssDNA-GNPs的吞噬量下降了约50%,在DMEM中培养的HeLa细胞对ssDNA-GNPs的吞噬量下降了约75%。这表明细胞对ssDNA-GNPs的内吞与能量有关,即处于正常生理温度(37℃)和饥饿状态下(无FBS)的HeLa对ssDNA-GNPs有较大的吞噬量。采用常规MTT法对PolyG1-GNPs和PolyG2-GNPs的细胞毒性进行了考察。如图3B所示,分别与5、25和50 μg/mL的ssDNA-GNPs孵育24 h后,HeLa细胞的活率均能够达到90%以上,表明所合成的ssDNA-GNPs具有较低的细胞毒性, 对HeLa细胞的生长状态影响较小。
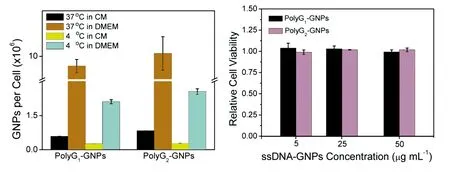
图3 (A)不同条件下HeLa细胞对PolyG1-GNPs及PolyG2-GNPs的吞噬量; (B)PolyG1-GNPs及PolyG2-GNPs的细胞毒性。Fig.3 (A) Cellular internalization amounts of PolyG1-GNPs and PolyG2-GNPs by HeLa cells under different experimental conditions; (B) cytotoxicity test of G1-GNPs and PolyG2-GNPs
3.3 ssDNA-GNPs在细胞中的分布
GNPs的紫外-可见吸收光谱与其聚集状态密切相关。为了考察HeLa细胞作用后ssDNA-GNPs胶体稳定性,收集了细胞内吞的ssDNA-GNPs并进行紫外-可见吸收光谱测定。如图4A所示, PolyG1-GNPs的颜色由红色变为紫色,SPR峰由523 nm红移至537 nm,并在635 nm处出现一个新的吸收峰,表明PolyG1-GNPs发生了聚集。同样条件下,PolyG2-GNPs的颜色和特征光谱均未发生显著变化。这表明PolyG2-GNPs在细胞中的稳定性优于PolyG1-GNPs。这一现象可能是由于具有G四链体二级结构的PolyG2对DNA酶的稳定性优于线性的PolyG1导致的。如图4B所示,ssDNA-GNPs主要分布于溶酶体中, 并且PolyG1-GNPs在溶酶体中量大于PolyG2-GNPs。另外,PolyG2-GNPs在细胞内的分散性优于PolyG1-GNPs。TEM结果与PolyG1-GNPs 和 PolyG2-GNPs的紫外-可见吸收光谱分析一致。

图4 (A)细胞吞噬的PolyG1-GNPs 和 PolyG2-GNPs的紫外-可见吸收光谱图,插图为PolyG1-GNPs (上) 和 PolyG2-GNPs(下)照片; (B)PolyG1-GNPs 和(C) PolyG2-GNPs细胞TEM分析。ssDNA-GNPs在细胞内的分布如箭头所示Fig.4 (A) UV-vis absorption spectra of PolyG1-GNPs and PolyG2-GNPs after interaction with HeLa cells, the inset of (A) is the digital photographs of PolyG1-GNPs (up) and PolyG2-GNPs (bottom); TEM images of (B) PolyG1-GNPs and (C) PolyG2-GNPs in HeLa cell. The cellular dispersed ssDNA-GNPs are indicated by arrows
4 结 论
两种不同构型且含富含G碱基ssDNA修饰的GNPs与HeLa相互作用的比较结果表明,DNA的二级结构能够影响ssDNA-GNPs与细胞的相互作用。尽管细胞对ssDNA-GNPs的内吞均与能量相关,但含有G四链体二级结构的ssDNA能够促进细胞对ssDNA-GNPs的内吞,并且其所修饰的GNPs在细胞内具有较好的分散性与稳定性。本研究为设计高效ssDNA-GNPs纳米探针/药物载体提供了新思路。

