预后营养指数与食管鳞癌患者术后并发症和远期预后的相关性研究*
食管癌是世界位列第8位的恶性肿瘤,其致死率居于所有恶性肿瘤第6位[1],手术为可切除食管癌的主要治疗手段。由于食管走行跨颈、胸、腹3个区域,无论是原发病灶切除还是广泛淋巴结清扫的风险均高于普通的胸外科手术,单一的外科治疗效果欠佳。如何筛选出预后不佳的患者并给予适当的干预是食管外科医师面临的主要问题。因此,手术风险的评估和预后判断对于食管癌患者至关重要。
预后营养指数(prognostic nutritional index,PNI)由血清白蛋白值和外周血淋巴细胞计数计算而来。最早由Buzby提出,后经日本学者Onodera修正后用于评估胃肠外科和心脏外科手术风险[2−3]。PNI>50表示患者为正常的营养状态;45~50提示患者轻度营养不良,但消化道切除和吻合是安全的;40~45提示患者存在明显的营养不良,行消化道切除和吻合有风险;<40提示患者有严重的营养不良,无法耐受手术[4]。近期有研究发现,PNI对胃癌、大肠癌、肝癌和肺癌等多种恶性肿瘤的远期预后有显著影响[5−8]。但PNI与食管癌患者手术风险和远期预后是否存在相关性,目前报道尚少。本研究收集中国科学技术大学附属第一医院2010年1月至2011年12月术后病理诊断为食管鳞癌患者258例,其中157例术前诊断为高PNI患者(PNI≥45),101例术前诊断为低PNI患者(PNI<45),比较分析两组患者临床病例资料、术后并发症、中位生存期和远期生存率情况。
1 材料与方法
1.1 病例资料
收集中国科学技术大学附属第一医院2010年1月至2011年12月309例接受食管癌切除术,术后病理诊断为食管鳞癌患者的临床病理资料。纳入标准:1)术后病理证实为食管鳞癌;2)接受现代二野淋巴结清扫(全纵隔+腹野);3)胸上段食管癌患者接受Mckeown食管切除术;胸中、下段食管癌患者接受Ivor Lewis食管切除术,并为R0切除。剔除标准:1)R1或R2切除患者;2)术前接受过新辅助治疗;3)既往有血液系统疾病患者;4)病例资料不完整。
基于上述标准,共258例患者纳入研究。其中男性182例,女性76例;年龄46~80岁,中位年龄68岁。Ⅰ期56例,Ⅱ期101例,Ⅲ期101例。胸上段食管癌31例,胸中段食管癌145例,胸下段食管癌82例。病理类型均为鳞癌。
治疗前检查包括:胸、上腹部CT增强、上消化道造影、电子胃镜或超声胃镜、心电图、肺功能,年龄>65岁患者加做超声心动图,胸上、中段食管癌患者加做颈部淋巴结超声。术前化验为常规。肿瘤分期采用美国癌症联合委员会(AJCC)第8版TNM分期系统。术后采用Clavien−Dindo外科并发症分级标准评价并发症发生情况,将Clavien−Dindo 1~2级并发症归为微小并发症,将Clavien−Dindo 3~5级并发症归为重大并发症。
1.2 方法
1.2.1 PNI计算方法 所有患者均在术前1周内检测血常规和生化检查,根据其结果,计算PNI值。计算公式为PNI=血清白蛋白值(g/L)+5×外周血淋巴细胞计数(×109/L)。
1.2.2 观察指标 采用门诊定期复诊和电话随访两种方式进行随访,以月为单位,入组病例随访至死亡或5年以上。观察术前PNI水平与患者临床病例资料的关系和术前PNI水平对食管癌患者术后并发症与5年生存率的影响。
1.3 统计学分析
采用SPSS 16.0软件进行统计学分析。计数资料采用χ2检验。生存率根据Kaplan Meier法计算,以Log−rank检验分析组间生存率的差异并行趋势检验。采用Cox模型进行多因素生存分析。P<0.05为差异具有统计学意义。
2 结果
2.1 PNI与患者临床病理特征关系
全组患者PNI的平均值为45.5±5.1,最小为36.2,最大为58.5。两组患者性别、年龄、肿瘤位置、肿瘤分化程度和外周血淋巴细胞计数方面均差异无明显统计学意度(P>0.05)。相对于高PNI组患者,低PNI组患者的TNM分期较晚,肿瘤直径>3 cm、有吸烟史和饮酒史的患者较多(P<0.05)。另外,低PNI组患者血清白蛋白值低者多于高PNI组患者(P<0.05,表1)。
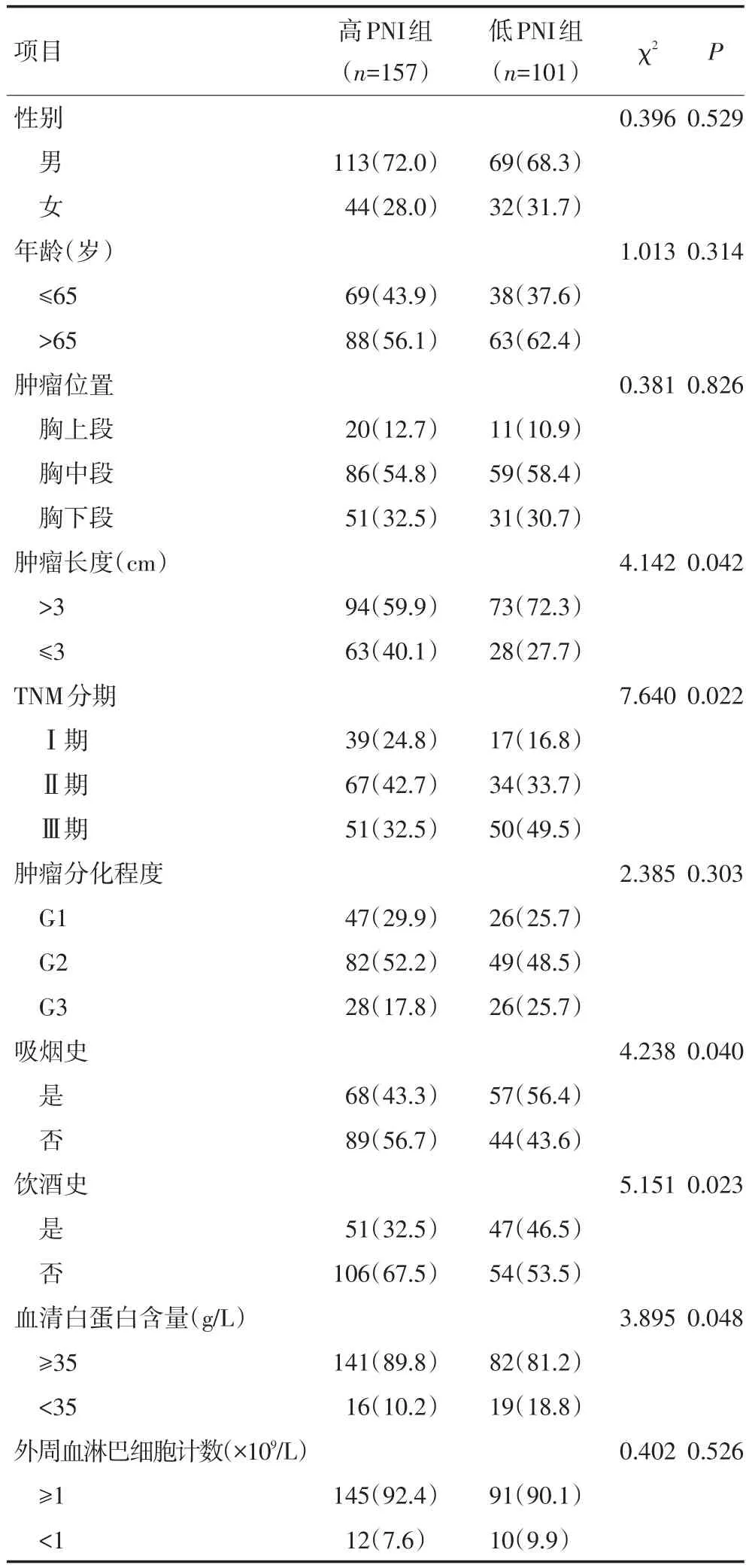
表1 两组患者临床病理资料比较 n(%)
2.2 PNI与患者术后并发症的关系
全组共85例患者出现术后并发症,其中高PNI组44例(28.0%),低PNI组41例(40.6%),两组比较差异具有统计学意义(P=0.036)。进一步分层研究发现,高PNI组在吻合口瘘和肺部并发症方面均低于低PNI组,差异具有统计学意义(P<0.05,表2)。
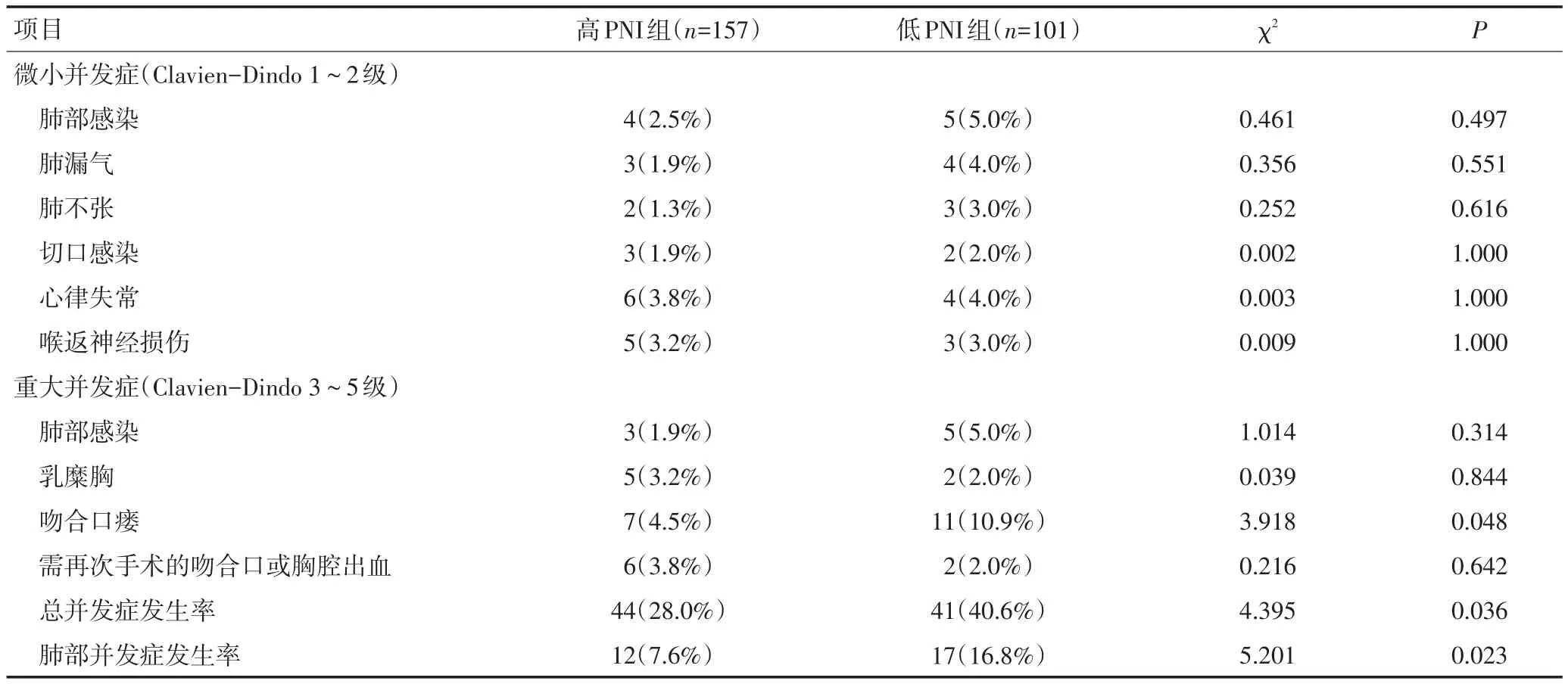
表2 两组患者术后并发症发生率比较 n(%)
2.3 PNI与患者5年生存率的关系
全组患者中242例(93.8%)获得随访,中位随访时间46.8个月。全组患者中位生存期和第1、3、5年生存率分别为48.8个月和83.7%、65.5%、43.4%。高PNI组中位生存期和第1、3、5年生存率分别为53.3个月和87.3%、71.3%、50.3%。低PNI组中位生存期和第1、3、5年生存率分别为41.5个月和76.2%、56.4%、32.7%。高PNI组生存率明显优于低PNI组,差异具有统计学意义(P<0.001,图1)。
2.4 影响患者预后的单因素及多因素分析
将患者临床病例资料分别进行单因素分析发现,吸烟史、肿瘤长度、TNM分期、血清白蛋白值和PNI水平与患者预后显著相关(P<0.05,表3)。将患者临床病例资料进行Cox模型多因素分析,结果显示TNM分期和PNI水平是影响患者生存率的独立预后因素(表4)。
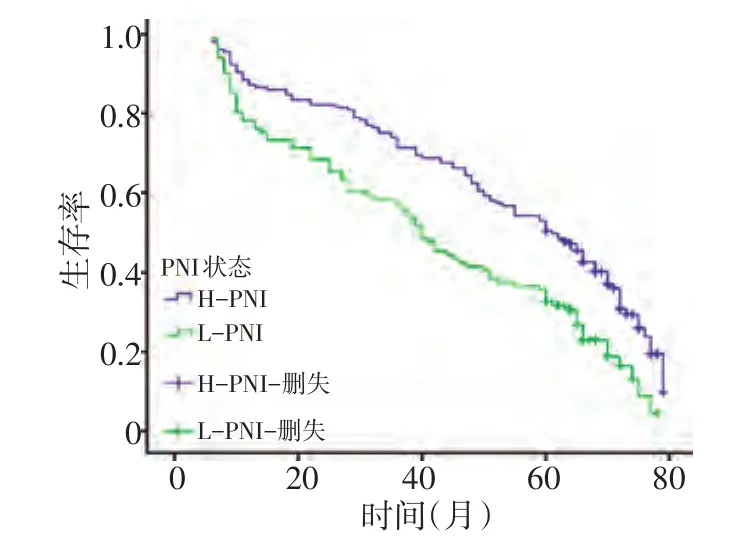
图1 两组患者生存率比较
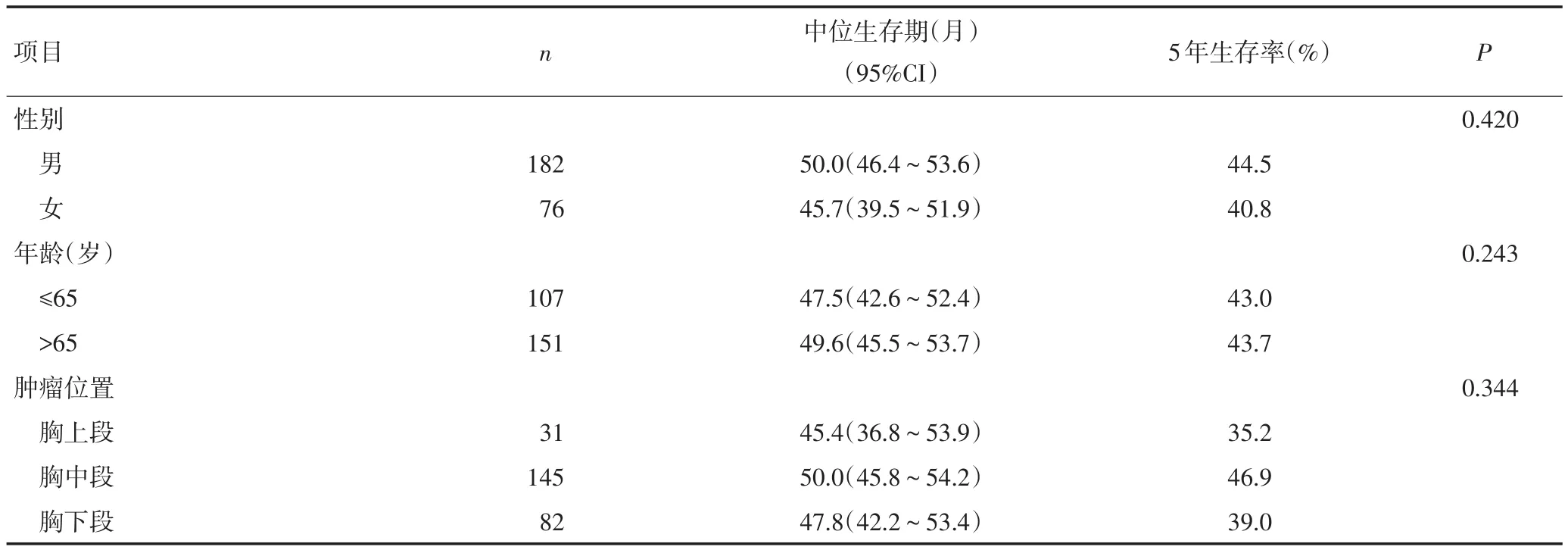
表3 影响患者预后的临床病理资料单因素分析
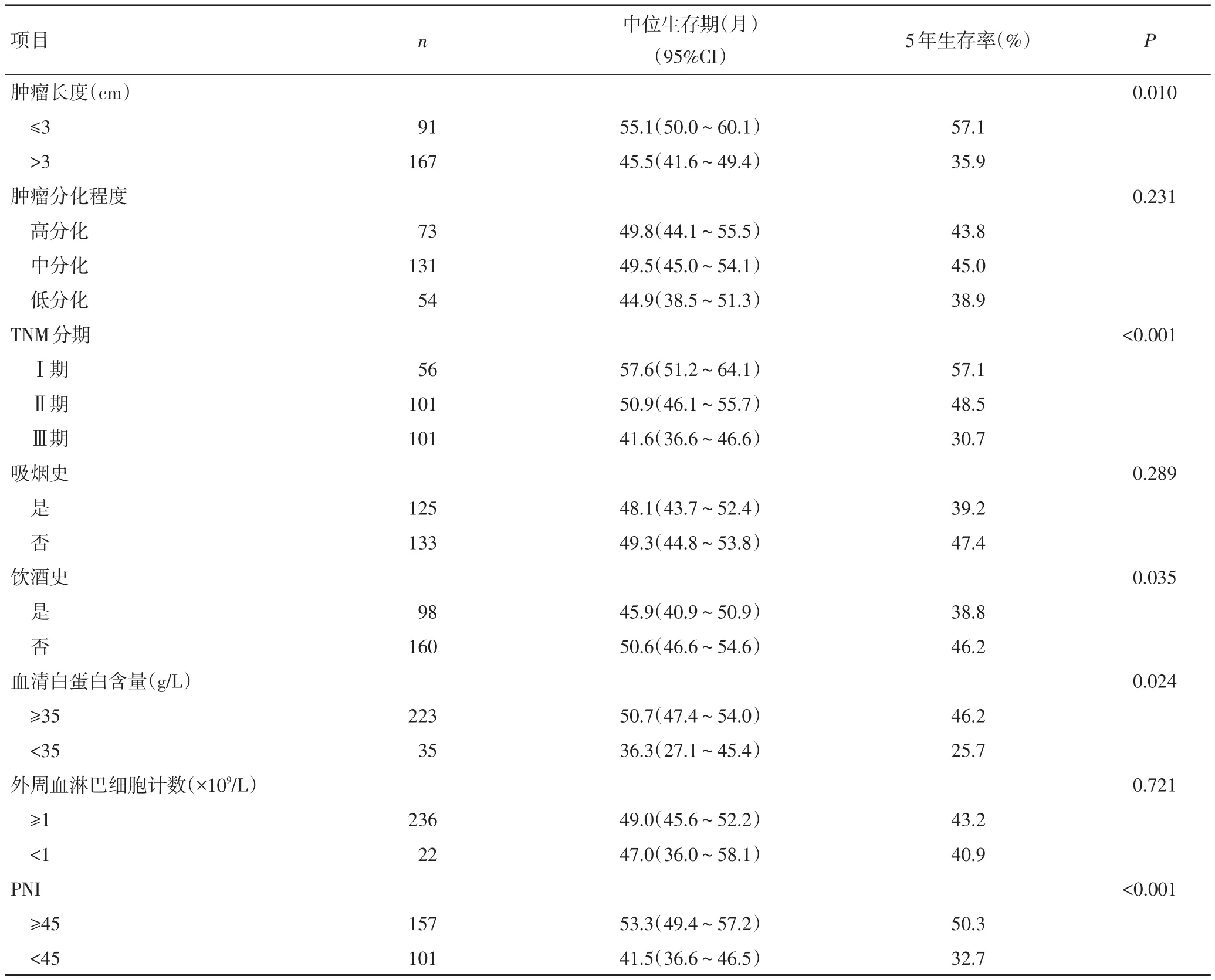
表3 影响患者预后的临床病理资料单因素分析(续表3)
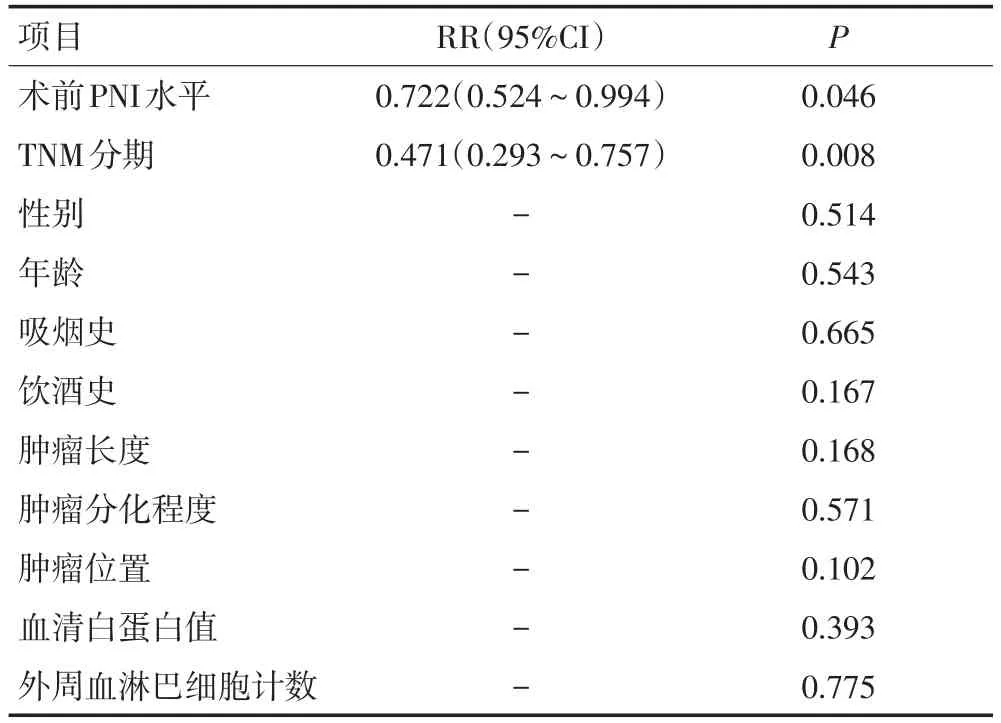
表4 影响患者预后的临床病理资料多因素分析
3 讨论
免疫因素和营养状态与肿瘤患者的手术风险关系密切,近期研究发现这两个因素与多种实体肿瘤的远期预后也存在一定的相关性[9]。近年来出现较多用于评估肿瘤患者免疫营养状态的指标,如中性粒细胞/淋巴细胞计数比值、血小板/淋巴细胞计数比值、Glasgow预后评分和PNI等。其中,PNI的研究最为成熟。许多研究表明,PNI与多种腹部肿瘤的手术风险评估和远期预后判断存在一定的相关性[5−8],但其在胸部肿瘤中的研究相对较少。本研究发现,术前PNI水平与食管癌患者术后并发症发生率和远期生存率显著相关,术前PNI水平低的患者术后并发症发生率明显增高,且远期生存率明显降低。论证术前PNI状态与食管癌患者近远期预后也存在一定的相关性。
肿瘤引起的系统性炎症和恶性消耗会导致患者免疫状态下降和营养的丢失,而患者的营养和免疫状态低下又会加速肿瘤的进展。胃癌和肠癌的研究报道,PNI与肿瘤侵犯深度、淋巴结转移度和TNM分期显著相关,术前PNI处于低水平的患者远期预后也明显差于 PNI水平正常者[10−11]。本研究发现,术前PNI状态是影响患者远期生存的独立预后因素,与上述的研究结果类似。其原因可能为:1)淋巴细胞在肿瘤细胞免疫应答中主要通过启动细胞毒性免疫反应和抑制肿瘤细胞增殖与转移来发挥作用[12−13],低淋巴细胞计数可导致亚临床肿瘤病灶细胞和外周血循环肿瘤细胞增殖分化更为活跃;2)血清白蛋白是最简单有效的反映机体营养状况的指标,而营养状态是癌细胞免疫反应的决定性因素,低蛋白血症会导致肿瘤细胞免疫修复功能下调[14]。因此,综合了免疫和营养两个方面指标的PNI在综合评估患者远期预后方面具有一定的意义。
食管癌为慢性消耗性疾病,由于肿瘤位于消化道,存在一定程度的局部梗阻和慢性失血现象。因此,消化道肿瘤患者的营养不良要比其他实体肿瘤患者更为严重。在临床工作中多采用体质量、体表面积和血清白蛋白值等指标来评估患者的营养状态。但上述指标的敏感性均不强,尤其在部分早期病例中,多数患者均为正常。本组病例中绝大多数患者的血清白蛋白值在正常范围,PNI是结合了血清白蛋白值和总淋巴细胞计数的校正指标。文献报道,术前PNI水平与胃癌和肠癌的术后并发症发生率显著相关[5−6]。Filip等[15]报道,术前低PNI状态与食管癌患者术后死亡率和Clavien−DindoⅢ级以上并发症呈显著相关性。本研究发现,术前PNI水平低的患者术后总并发症、肺部并发症和吻合口瘘发生率均明显高于正常水平患者。因此,相对于单纯的血清白蛋白值和体表面积等监测,术前PNI水平是评估食管癌患者术后风险更佳的临床指标。
选取PNI的最佳截断值可通过绘制受试者ROC曲线来评估5年生存率的敏感性和特异性,并通过计算Youden指数来决定PNI的最佳截断值。目前绝大多数的文献报道[11,16],通过绘制ROC曲线得到消化道肿瘤的PNI最佳截断值的为45左右。Nakatani等[16]通过绘制ROC曲线得到的食管癌患者最佳截断值为45。Jian−Hui等[11]通过1 321例肠癌绘制ROC曲线得到最佳截断值为45。亦有部分学者直接选取45作为最佳截断值[10]。在实际工作中,即使同一治疗组不同时期患者的最佳截断值也可能不同。本研究直接采用45作为PNI的最佳截断值,结果与其他消化道肿瘤研究得到的结果类似。因此,在临床工作中,建议对于术前PNI低于45的食管癌患者术后和远期给予更为密切地观察,较早给予相应的临床干预。
本组病例中,低PNI组患者吸烟史和饮酒史较多。根据目前文献报道,吸烟史和饮酒史是食管癌发病的危险因素,具有吸烟史和饮酒史的人群患食管癌的风险明显高于普通人群[17−18]。但多数研究认为,吸烟史和饮酒史与食管癌患者的远期预后无关[19−20],主要原因为有吸烟和饮酒史的患者肿瘤分期较无烟酒史更晚所致。本研究同时发现,吸烟史、肿瘤长度、血清白蛋白值在单因素分析中与患者预后相关,但Cox多因素回归分析差异并无统计学意义。可能由于有吸烟史和肿瘤直径>3 cm的患者,其本身的TNM分期较晚,而血清白蛋白值低的患者PNI较低,最终TNM分期和PNI因素掩盖了上述3个因素的作用所致。
综上所述,术前PNI水平与食管鳞癌患者的术后并发症发生率和远期生存率显著相关,术前PNI水平低的患者手术风险高于正常水平患者,且远期预后相对欠佳。因此,对术前PNI水平低的食管癌患者术后应给予更为密切的观察,以预防术后近期并发症的发生。同时应给予更为密切的远期随访,旨在获得早期复发或转移时干预的机会。因本研究为单中心回顾性分析,存在一定的病例选择性偏倚。另外,本研究所涉及病例并非同一外科医生和病理医生完成手术和诊断,也一定程度上影响了研究结果。因此,其结果有待于更大样本量的研究进一步验证。

