44例rhTNFR:Fc治疗类风湿关节炎发生肺结核风险研究
李 楠,罗 娇,焦建明,顾 伟*
(1.大理大学临床医学院,云南大理 671000;2.大理大学第一附属医院,云南大理 671000)
类风湿关节炎(rheumatoid arthritis,RA)是一种以侵蚀性对称性多关节炎为主要临床表现的慢性全身性自身免疫性疾病。其病理改变为滑膜炎、血管翳形成,逐渐出现关节软骨和骨破坏,最终关节畸形和丧失功能。RA的发病机制至今仍在不断阐述完善中,据相关文献报道〔1-2〕,IL-1、IL-2、IL-6、IL-8、IL-17、TNF-α(肿瘤坏死因子)等细胞因子导致的免疫损害,是引起RA慢性炎症的关键环节。其中有研究结果显示〔3-4〕,TNF-α全程参与RA滑膜组织增生、炎症和自身免疫反应等过程,是RA发病机制中居中心地位的促炎症因子,而且TNF-α基因亦与RA发病的遗传相关。在患者体内,TNF-α参与了内皮细胞激活、细胞因子诱导、白细胞聚集、破骨细胞活化与软骨破坏等病理过程,且患者血清中TNF-α的水平与关节炎的严重程度呈正相关,故抑制TNF-α的表达能有效阻止炎症的发生,此外TNF拮抗剂还通过诱导细胞凋亡对RA发挥治疗作用〔5-6〕。因此,TNF-α拮抗剂自1998年上市以来,广泛应用于RA患者,给RA患者带来了新的希望。有数据显示,美国约有20%的RA患者接受TNF-α拮抗剂治疗,并取得了满意的疗效〔7〕。重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白(rhTNFR:Fc,商品名:益赛普)是一种采用重组DNA技术生产的融合蛋白,它可特异性地阻断TNF-α与其细胞表面受体结合,从而在RA的治疗中发挥重要作用。近年来国内接受rhTNFR:Fc治疗的RA患者越来越多,患者的生存质量得到了大幅改善。但因为TNF在抗结核杆菌感染的过程中发挥着重要作用,抑制其活性可能会增加结核的发病风险,有研究表明TNF拮抗剂的Ⅲ期临床试验中有结核发病率增高的现象〔8-9〕。我国是结核病高负担国家之一,且云南省肺结核的发病率在60∕10万~120∕10万不等,明显高于其他省份〔10〕,故rhTNFR:Fc治疗RA的远期安全性值得引起广大风湿科医生的关注。本文结合大理大学第一附属医院风湿免疫科近年来RA患者治疗情况,对rhTNFR:Fc治疗类风湿关节炎致肺结核发病进行回顾性分析,以期能为临床用药提供参考。
1 资料与方法
1.1 研究对象及入选标准收集2015年9月至2017年9月大理大学第一附属医院收治的RA患者的病历资料,根据排除标准和诊断标准,共有352例入选,入选患者均接受规范治疗,院外遵医嘱持续用药,并定期复诊(4周)进行相关检查。使用rhTNFR:Fc的患者均接受过48周以上的治疗。按治疗药物分为DMARDs(抗风湿药)组(308例)和rhTNFR:Fc组(44例)。
1.2 排除标准①入院前1个月内服用过激素的患者;②入院前1个月内服用过免疫抑制剂的患者;③入院检查存在活动性结核的患者;④正在或短时间内从事过煤矿、矿场、面粉厂等高危致病职业的患者;⑤不能明确确诊肺结核的患者;⑥未规律定期复诊(4周)的患者及失访的患者。
1.3 诊断标准①类风湿关节炎诊断标准:初诊诊断均符合2010年美国风湿病学会(ACR)和欧洲抗风湿病联盟(EULAR)提出的RA分类标准和评分系统,6分以上可确诊RA。②肺结核诊断标准:肺结核诊断标准(WS288-2008)及《肺结核诊断和治疗指南》〔11〕。
1.4 治疗方法与分组①DMARDs组:计入该组患者口服来氟米特和甲氨蝶呤。用法用量:来氟米特10 mg∕d,甲氨蝶呤10 mg∕周,并同时补充叶酸5 mg∕周。②rhTNFR:Fc组:皮下注射25 mg∕次,2次∕周。
1.5 统计学分析采用SPSS 19.0对相关数据进行分析,计数资料行χ2检验,确定α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果
24周后DMARDs组肺结核发生率为5.84%,rhTNFR:Fc组肺结核发生率为4.55%,差异无统计学意义(P>0.05);48周后DMARDs组肺结核发生率为8.12%,rhTNFR:Fc组肺结核发生率为6.82%,差异无统计学意义(P>0.05)。见表1。
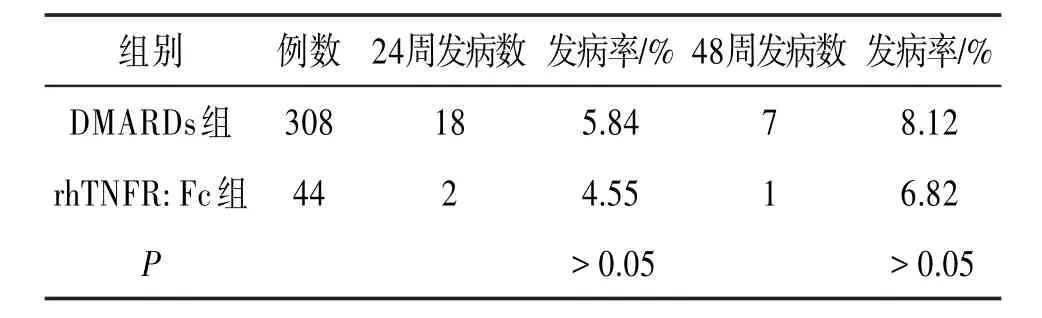
表1 2015年至2017年大理大学第一附属医院352例RA患者发生肺结核情况
24周后DMARDs组陈旧性肺结核者的肺结核复发率为11.76%,rhTNFR:Fc组陈旧性肺结核者的肺结核复发率为0.00%,差异无统计学意义(P>0.05);48周后DMARDs组陈旧性肺结核者的肺结核复发率为17.65%,rhTNFR:Fc组陈旧性肺结核者的肺结核复发率为20.00%,差异无统计学意义(P>0.05)。见表2。
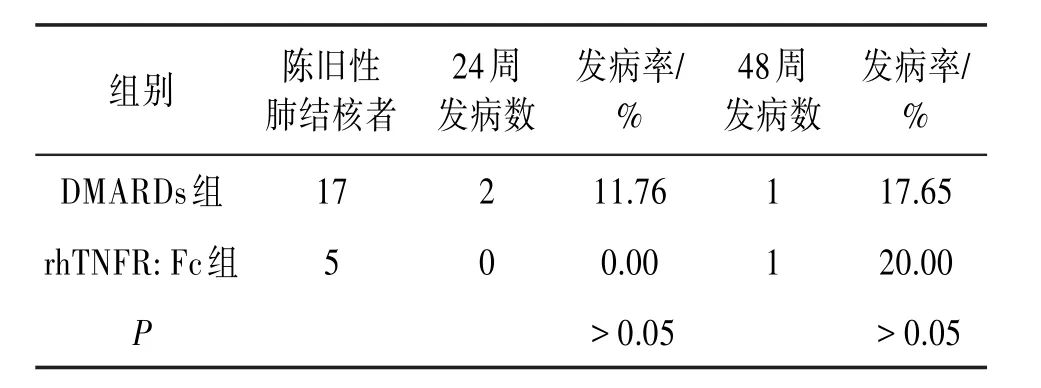
表2 2015年至2017年大理大学第一附属医院陈旧性肺结核RA患者发生肺结核情况
3 讨论
TNF-α作为机体重要的免疫调节因子,在抗结核过程中发挥着至关重要的作用。据相关文献报道〔12〕,TNF-α主要从以下方面参与对抗结核分枝杆菌:①直接参与抵抗结核杆菌的入侵;②促进结核性肉芽肿形成;③诱导感染结核杆菌的巨噬细胞凋亡;④参与铁介导的结核杆菌生长抑制;⑤促发结核杆菌的休眠。其中,促进结核性肉芽肿形成可能是最重要的环节〔13-16〕。同时,TNF-α可诱导产生多种细胞因子并间接调节其免疫活性,从而增加保护能力,它对其他细胞因子有趋化和黏附作用,使其他细胞因子黏附在结核感染部位形成肉芽肿,防止结核杆菌的扩散〔17〕。TNF-α还能修饰内皮,诱导趋化因子表达,促进单核细胞和T淋巴细胞从血液中渗出并迁移到感染部位,同时,TNF-α激活T细胞及其亚群,促进细胞因子或细胞毒效应分子的产生和持续表达,并促进树突状细胞分化,加强IL-12的产生和抗原递呈〔18〕。若TNF-α的作用被阻断,这些保护作用就会减弱或消失,从而增加结核病的发生风险〔19〕。有研究表明RA患者本身结核病的患病率就比普通人群高4倍〔20〕,若接受TNF拮抗剂治疗相关患病率会增加到12~20倍〔21〕。美国和瑞典的相关研究也得到了与上述相似的结论〔19,22〕,同时国内亦有相关个案报道〔23-24〕。本次研究结果与国外报道不相符,考虑存在以下原因:①国外研究的大部分为单克隆抗体类TNF拮抗剂,如英夫利西单抗、阿达木单抗等,而本研究中44例患者均使用rhTNFR:Fc,rhTNFR:Fc为国内对依那西普的仿制药,Tubach研究表明〔25〕,经过有效的用药前结核筛查以及相应的预防性抗结核治疗后,依那西普治疗并未增加结核病发生风险,而英夫利西单抗与阿达木单抗治疗的患者,其结核病发生风险分别为健康人群的18.6倍与29.3倍,这可能与其作用机制不同有关,单克隆抗体类TNF拮抗剂会引起表达跨膜TNF的免疫细胞裂解,从而降低了机体对结核分枝杆菌的防御能力,而依那西普并未检测到有此类作用〔13,26-28〕。②结核包括肺结核和肺外结核,本研究只把肺结核纳入了研究范围,而有研究报道,抗TNF-α治疗引发的结核病亦有大量的肺外结核〔29-30〕。不过王莉莎、鲍春德等对重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗引起肺结核的研究结论〔31-34〕与本次研究结果基本一致。
结合本次研究结果和相关文献资料,虽然国外报道及国内专家共识〔35〕均认为应用单克隆抗体类TNF-α拮抗剂治疗RA存在结核感染的风险,但国内应用较广的融合蛋白类TNF拮抗剂(rhTNFR:Fc),安全性好,引发结核的风险较小,经过有效的用药前结核筛查以及相应的预防性抗结核治疗后,RA患者可以放心使用。对于具有结核高危因素、经病情评估后需使用TNF拮抗剂治疗的患者,推荐使用融合蛋白类TNF拮抗剂。而对于陈旧性肺结核的RA患者,在接受TNF拮抗剂治疗后,其陈旧性的结核病灶存在活化的可能,亦应进行用药前排查和治疗后监测。

