牦牛IGF-IR基因克隆及其序列分析
梁春年,王宏博,吴晓云,褚 敏,郭 宪,阎 萍
(1.中国农业科学院 兰州畜牧与兽药研究所,甘肃 兰州 730050;2.甘肃省牦牛繁育重点实验室,甘肃 兰州 730050)
胰岛素样生长因子家族(Insulin-like growth factors,IGFs)由IGF-1、IGF-2、IGF-1R、IGF-2R及IGFBP1~IGFBP6共10个蛋白因子组成[1],其相互作用调节生物学过程,是胚胎正常发育和出生后机体生长必需的生长因子[2]。IGF-IR是跨膜酪氨酸激酶成员之一,最初由美国科学家Megyesi从小鼠的肝血浆组织分离获得[3],它可以和IGF-1密切结合,启动对配体的生理反应,也可以和IGF-2松散结合,在胎儿发育期间起到促有丝分裂作用[4-5]。IGF-IR蛋白是由2个α链和2个β链通过二硫键连接在一起的同型二聚体。对于IGF1R基因结构、功能以及在信号通路中作用的研究,在人类医学方面研究较多,在其他动物如绵羊、小鼠、鸡等中也展开过许多研究[6]。人的IGF-IR基因的cDNA在1986年被克隆并测序,包含4 989个核苷酸,编码1 367个氨基酸前体蛋白[7]。该蛋白前体包含一个30个残基的信号肽结构和在残基707-710位点的Arg.Lys.Arg.Arg酶切割点,切割形成α链(残基1-707)、β链(残基712-1 337)[8],前体蛋白还包含一个跨膜序列(残基906-929)和一个含有酪氨酸激酶的408个残基细胞质结构域[9]。IGF-IR基因DNA序列全长约310 kb,包含21个外显子,其中α链上10个外显子,β链上11个外显子[10]。IGF-IR基因α亚基富含半胱氨酸,具有配体结合区,主要与IGF-I结合;β亚基的基质结合位点在胞内区950残基处,主要与IRS-1、She结合[11]。研究表明,IGF-IR与多种因子相互作用,对动物生长发育、细胞凋亡和增殖以及肿瘤细胞的发生密切相关[12-15]。牦牛是适应高寒牧区的独特牛种之一,是当地畜牧业的主导畜种,但是生产性能较低。IGF-IR基因介导IGF发挥生物学功能,深入开展牦牛IGF-IR基因的结构和功能研究,可为该基因功能挖掘利用及筛查基因多态性和牦牛生产性能的关联分析等提供研究基础。
1 材料和方法
1.1 试验材料
1.1.1 样品采集 大通牦牛背最长肌采集于青海省大通牛场屠宰场。用干净刀片切取新鲜肌肉样品,分装,10 g/份,立即投入液氮中冻存备用。
1.1.2 试剂 RT-PCR反转录试剂盒、DNA Marker、LATaqDNA聚合酶、胶回收试剂盒和pGME-T Easy Vector Systems均购自大连宝生物工程有限公司。总RNA提取试剂盒和JM109感受态细胞购自兰州天根生物有限公司。
1.2 试验方法
1.2.1 牦牛肌肉总RNA提取及反转录 按照总RNA提取试剂盒提取牦牛肌肉组织总RNA,琼脂糖凝胶检测RNA完整性。以牦牛肌肉总RNA为模板,采用RNA反转录试剂盒合成cDNA第一链。根据GenBank数据库中登陆的黄牛IGF-IR基因序列信息(登录号为NM_001244612),与其他物种IGF-IR基因序列进行比对,选择保守区,设计牦牛IGF-IR基因扩增引物。扩增引物见表1。
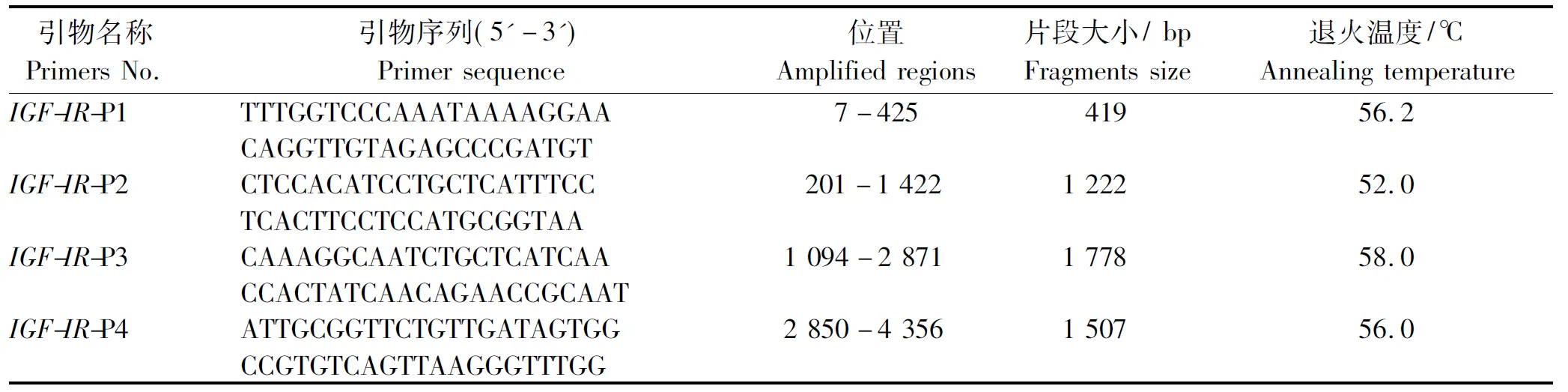
表1 设计的引物序列信息Tab.1 Sequence and information of primers for yak IGF IR
1.2.2 牦牛IGF-IR基因分段扩增及鉴定 PCR反应体系(50 μL):10×PCR Buffer 5 μL,dNTP(10 mmol/L)2 μL,cDNA模板 2.5 μL,上下游引物各3 μL(20 μmol/L),LATaqDNA聚合酶2.5 μL,无菌蒸馏水32 μL,混匀。
PCR反应条件:94 ℃ 2 min;94 ℃ 30 s,退火30 s(退火温度见表1),65 ℃ 1 min,35个循环;65 ℃ 10 min。利用1%琼脂糖凝胶电泳检测PCR产物,凝胶回收纯化目的片段,连接至pGME-T Easy载体。将连接产物转化到JM109感受态细胞,通过菌液PCR及双酶切鉴定阳性克隆,送上海生工生物公司进行测序。利用DNAStar和SeqMan软件进行目的基因序列拼接。
1.2.3 牦牛IGF-IR基因生物信息学分析 利用DNAman、DNAStar、ClustalX 及MEGA 4等生物信息学软件,结合有关基因和蛋白序列、结构信息分析的各种在线工具,对牦牛IGF-IR基因序列进行生物信息学分析。预测该基因序列特征、编码蛋白质的理化特性及功能域等。蛋白结构预测采用Sopma(https://npsa-prabi.ibcp.fr/)和SMART(http://smart.embl-heidelberg.de/)在线分析进行;跨膜结构分析通过TMHMM Server v. 2.0和TMpre(http://www.ch.embnet.org/software/TMPRED_form.html)进行;SignalP 3.0 Server分析信号肽。采用ClustalX 及MEGA 4进行序列比对,构建系统进化树。
2 结果与分析
2.1 RNA的检测
利用总RNA提取试剂盒提取牦牛肌肉组织总RNA,经0.8%的凝胶电泳检测。从图1可以看出,有3条清晰的条带,分别为28S、18S和5S,条带边界清晰,表明提取的总RNA质量完好,可用于后续试验。
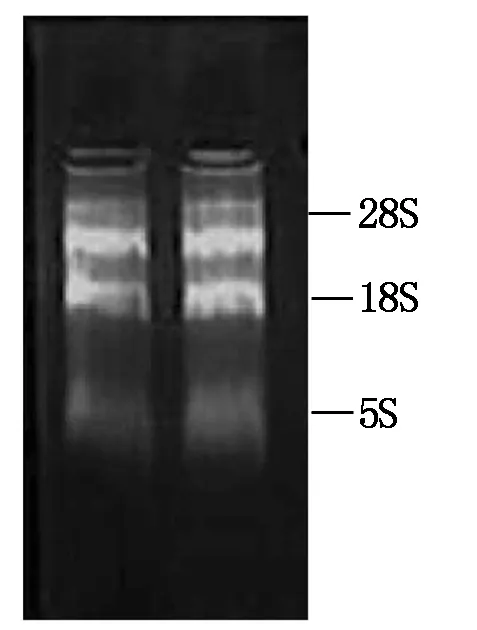
图1 牦牛肌肉组织总RNA的电泳图谱Fig.1 Gel electrophoresis for total RNA of yak muscle
2.2 牦牛IGF-IR基因分段PCR分析
根据表1中设计的引物,以牦牛肌肉cDNA为模板,特异性扩增获得IGF-IR基因各片段;各片段扩增产物大小分别为419,1 222,1 778,1 507 bp,与预期片段大小相符(图2)。
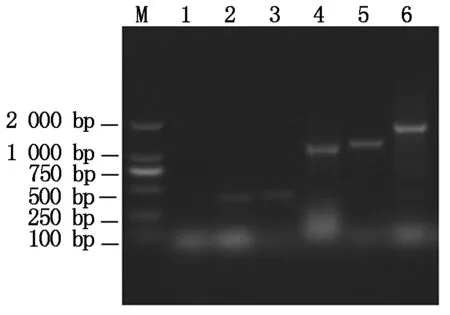
M.DNA Marker;2和3.引物1扩增产物;4.引物2扩增产物;5.引物4扩增产物;6.引物3扩增产物。M.DNA Marker;2 and 3.Amplified product by primer 1;4.Amplified product by primer 2;5.Amplified product by primer 4;6.Amplified product by primer 3.
2.3 牦牛IGF-IR基因序列分析
测序结果表明,牦牛IGF-IR基因ORF长约4 104 bp,编码1 367个氨基酸;理论分子量约154.95 ku,等电点pI值约5.71。亮氨酸的含量最高,达到8.3%,谷氨酸次之,为8.2%。该基因编码的蛋白含有179个带正电荷残基,174个带负电荷的残基,蛋白水溶液在280 nm处的消光系数约210 630,不稳定系数是48.20,蛋白稳定性较低,平均亲水系数是0.402。与黄牛IGF-IR基因(GenBank登录号:NM_001244612)序列比对发现,牦牛IGF-IR基因共有20处发生碱基改变,其中,G到T碱基颠换2次,G到A碱基转换2次,C到T碱基转换7次,A到G碱基转换3次,T到C碱基转换6次。
2.4 牦牛IGF-IR基因系统进化分析
根据Blast同源搜素结果,将牦牛IGF-IR氨基酸序列与GenBank登陆的黄牛、猪、人、狗、小鼠、鸡、猩猩等7个物种IGF-IR氨基酸序列进行同源性分析。结果表明,牦牛IGF-IR基因编码区发生9个碱基变异,造成3个氨基酸改变,即第6位由精氨酸(Arg)代替甘氨酸(Gly),第29位由异亮氨酸(Ile)代替苏氨酸(Thr),第30位由异亮氨酸(Ile)代替丝氨酸(Ser)(图3)。在比较的8个物种中,牦牛与黄牛IGF-IR氨基酸序列间相似性最高,达到99.8%,与鸡的相似性最低,仅为82.3%(表2)。系统进化分析表明(图4),牦牛IGF-IR与黄牛IGF-IR聚为一类,猩猩和人的IGF-IR聚为一类后,再与猪IGF-IR等共同聚为一大类,最后与鸡IGF-IR聚为一类,这与生物进化的历程相一致,说明IGF-IR相对比较保守性,对生物的进化起到重要作用。
2.5 牦牛IGF-IR二级结构预测及蛋白质跨膜结构分析
SOPMA预测结果表明,牦牛IGF-IR蛋白中α-螺旋占26.12%,β-折叠占20.92%,β-转角占4.61%,随机卷曲占48.35%。TMHMM Server v.2.0分析显示牦牛IGF-IR蛋白存在跨膜结构(图5),分别位于6-26位,938-958位,1 188-1 209位氨基酸,理论值分别为1 794,3 264和1 068,显著高于阈值(500)。利用SignalP-NN和SignalP-HMM软件预测表明,IGF-IR蛋白具有信号肽序列(图6),位于30-31位氨基酸之间最有可能存在剪切位点。SMART分析表明,牦牛IGF-IR具有IGF受体蛋白特征性结构域(图7),包括1个酪氨酸蛋白激酶区(Tyrkc,999-1 266),3个纤连蛋白型结构域(FN3,489-914),1个跨膜区(936-958)和1个半胱氨酸富集区(FU,227-270)。
2.6 牦牛IGF-IR三级结构分析
将牦牛IGF-IR氨基酸序列提交至蛋白质结构数据库用同源建模的方法得到985-1 286位氨基酸的序列,比对显示牦牛IGF-IR氨基酸序列与人的该序列(PDB ID 3nw5A)相似性达到98.68%,其预期模型精度为2.14 AÅ,E-Value为2.32e-180,以3nw5A序列为同源建模模板获得牦牛IGF-IR基因编码蛋白的三级结构[16](图8)。利用Protfun在线分析软件对牦牛IGF-IR基因编码蛋白进行功能预测表明,该蛋白具有受体功能的可能性为0.327,具有细胞信号转导功能的可能性为0.329,因此,牦牛IGF-IR基因可能主要作为受体在细胞信号转导过程中发挥重要的生物学功能。


图3 不同物种间IGF-IR氨基酸序列比较Fig.3 Alignment of amino-acid sequences of IGF-IR between different species

表2 牦牛与部分物种间 IGF-IR基因编码区氨基酸序列相似性Tab.2 Aligment report of the IGF-IR protin between yak and 7 species
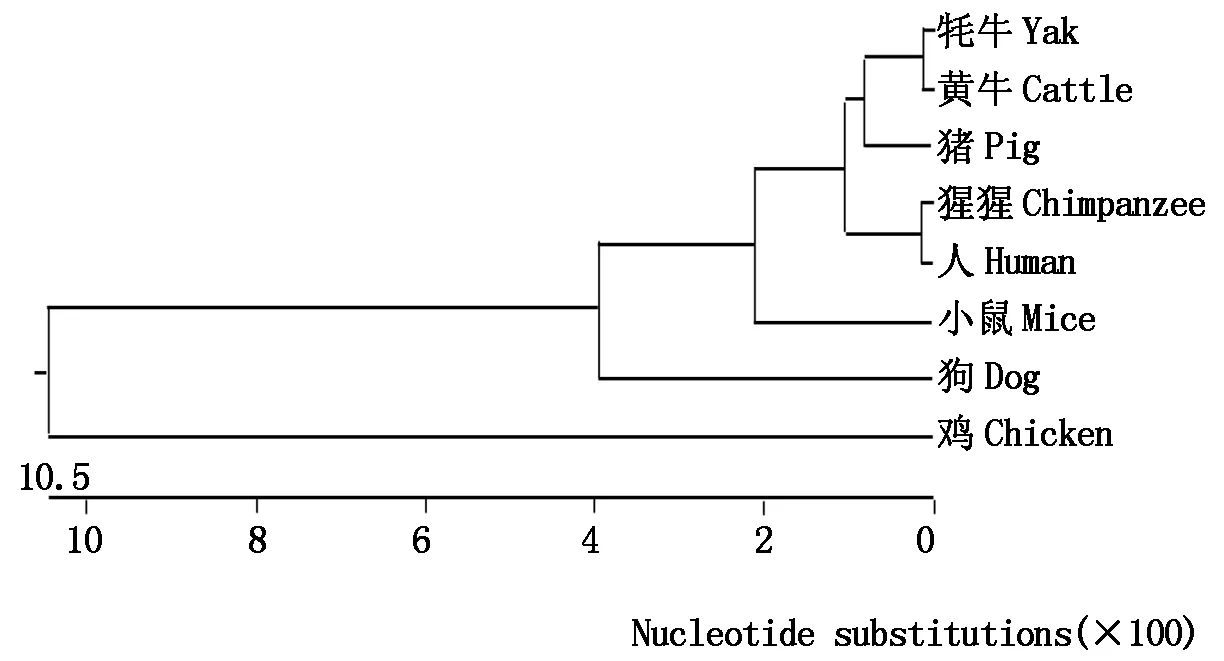
图4 不同物种IGF-IR蛋白的系统进化树Fig.4 Phylogenetic tree of the predicted amino acid sequence of IGF-IR from different specises
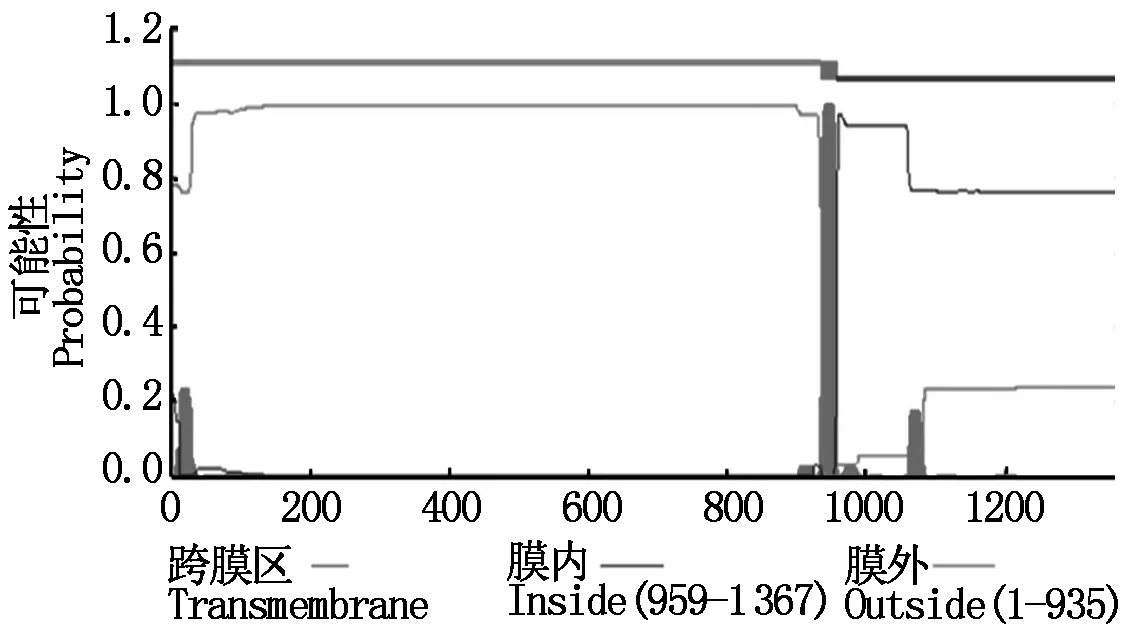
图5 牦牛 IGF-IR 基因编码的蛋白质跨膜结构分析Fig.5 The transmembrane analysis of yak IGF-IR gene
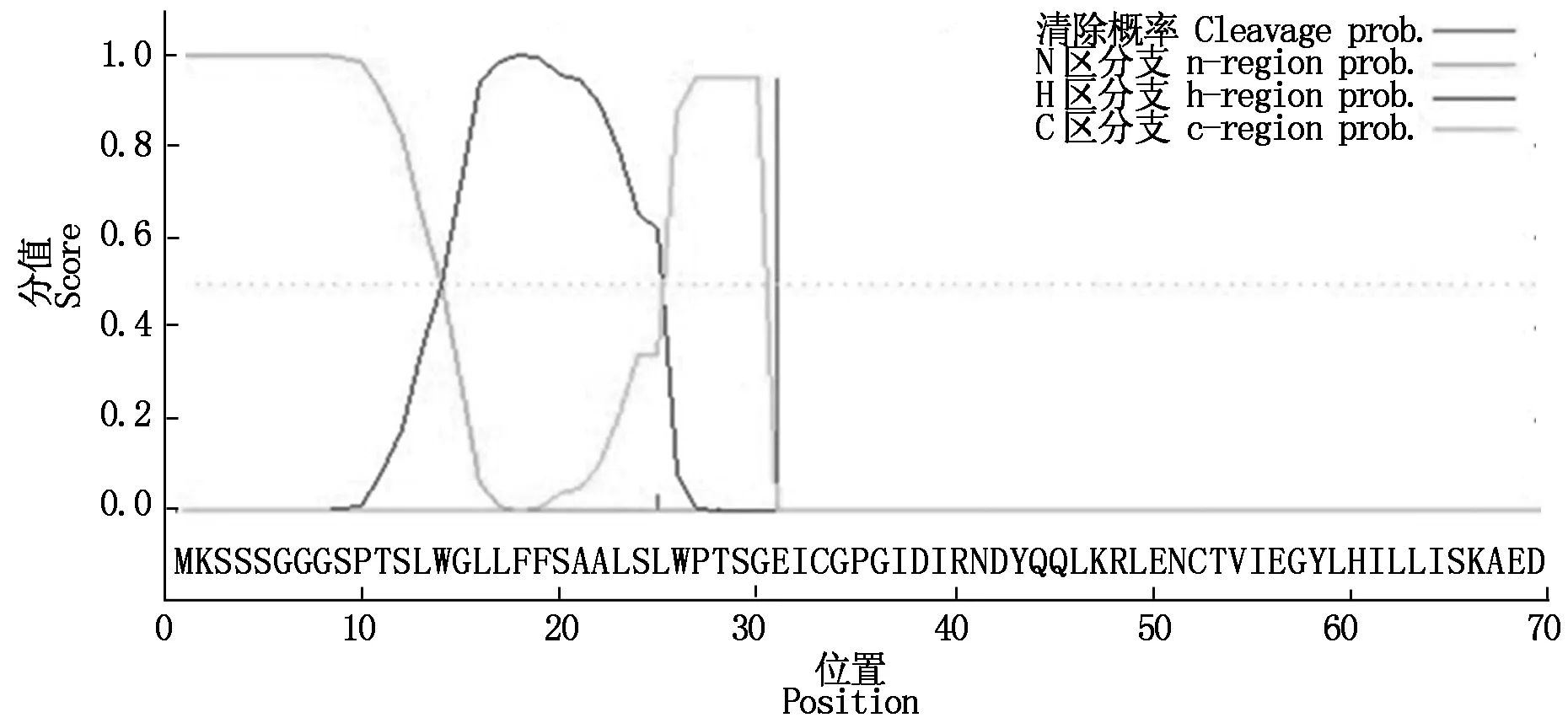
图6 IGF-IR蛋白具有信号肽序列Fig.6 The signal peptide analysis of yak IGF-IR
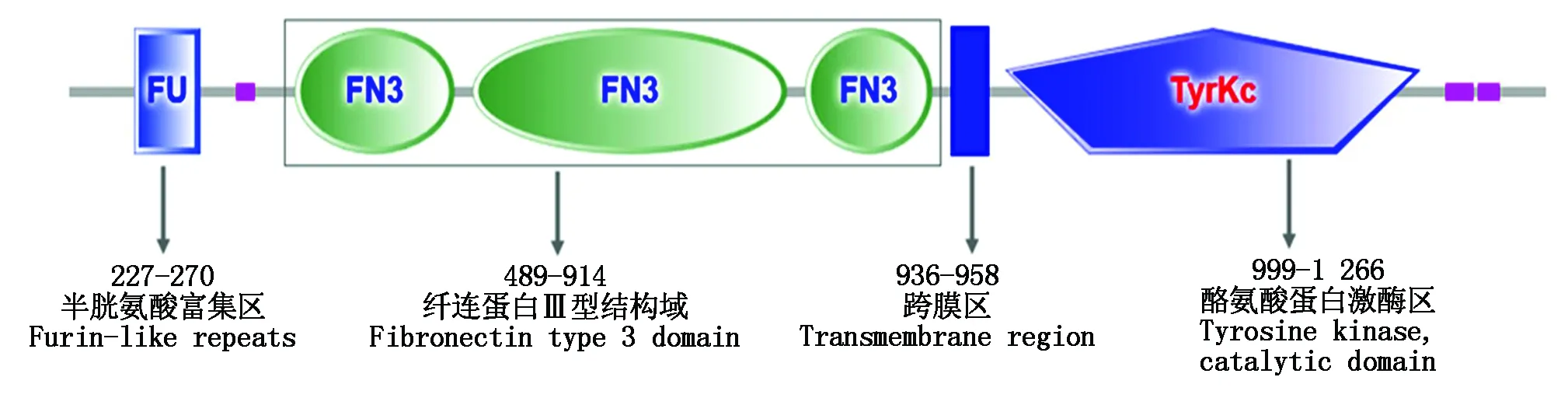
图7 牦牛IGF-IR结构域分析Fig.7 Analysis of domain for yak IGF-IR
胰岛素样生长因子是动物生长轴上重要的生长因子之一,对动物的生产性能、体态发育具有重要的调控作用,而IGF-1R作为IGF的受体,在胎儿期和出生后的各种组织中广泛的表达,是IGF在机体生命过程中发挥作用的主要介导者[17-18]。目前的研究证明,动物IGF-IR基因相对比较保守。张金玉等[19]在草原红牛IGF-IR基因3′非翻译区发现一个多态位点。Akis等[20]对安那托利亚红牛IGF-IR基因的研究发现一个TaqⅠ酶切多态位点。
本研究通过分段克隆牦牛IGF-IR基因编码区,将拼接获得的序列与黄牛的IGF-IR基因进行比对,发现共有20处发生碱基改变。对比牦牛与黄牛IGF-IR氨基酸序列,相似性为99.8%,仅第6位由精氨酸(Arg)代替甘氨酸(Gly),第29位由异亮氨酸(Ile)代替苏氨酸(Thr),第30位由异亮氨酸(Ile)代替丝氨酸(Ser)。牦牛与猪、人、狗、小鼠、猩猩等物种IGF-IR氨基酸相似性均大于92%,但与鸡的相似性较低,仅为82.3%。在本研究比较的8个物种中核苷酸和氨基酸水平的变异来看,各物种间氨基酸水平的变异程度要明显小于核苷酸水平的变异。这可能是由于牦牛与各物种在核苷酸水平上的多数碱基替代或转换并没有引起编码氨基酸的改变,属于同义突变。因此,笔者认为,牦牛作为一个较为原始的牛种,与黄牛及其他物种在核苷酸和氨基酸水平的这种保守型和差异性,正好说明牦牛与其他物种间的分化和物种的形成历史,这种基因的差异可用于物种系统进化的研究。基于IGF-IR基因编码区氨基酸序列聚类分析结果表明,牦牛IGF-IR与黄牛IGF-IR聚为一类,猩猩和人的IGF-IR聚为一类后,再与猪IGF-IR等共同聚为一大类,最后与鸡IGF-IR聚为一类,这与生物进化的历程相一致,说明该基因相对比较保守性,对生物的进化起到重要的作用[21]。
本研究还利用生物信息学分析工具对牦牛IGF-IR蛋白质二级结构、三级结构进行预测分析。牦牛IGF-IR蛋白质二级结构主要以α-螺旋、β-折叠、β-转角及随机卷曲为主,蛋白存在跨膜结构,分布于6-26位,938-958位和1 188-1 209位氨基酸位点,且该蛋白具有信号肽序列,最可能的剪切位点位于30-31位氨基酸,说明IGF-IR蛋白可能在跨膜运输中起信号识别作用。这些结果为进一步研究该基因的结构和功能及用于牦牛分子育种打下了良好基础。

