5336例利奈唑胺用药人群相关血小板减少的自动监测与评价研究
郭代红,胡鹏洲,朱 曼,贾王平,王啸宇(.解放军总医院临床药学中心,北京 00853;.重庆医科大学药学院,重庆 4033)
利奈唑胺是用于革兰阳性菌感染的首个 唑烷酮类抗生素,2004年获美国FDA批准上市,国内2007年获批,临床常用于肝肾功能不全及老年患者的重症感染。但因该药可致较高发生率的血小板减少药品不良反应(ADR)而引发重点关注。近年来国人相关安全性研究报道很多,但涉及病例人群的样本数至多仅数百例[1-4]。本研究借助自行研发的专项自动监测软件,回顾性提取我院引进使用利奈唑胺注射液9年来电子医疗数据库中所有用药人群信息数据,旨在获取该药大样本用药人群中血小板减少发生率及相关趋势研究,为临床合理用药提供详实的参考依据。
1 资料与方法
1.1 研究方法
采用真实世界研究方法(real world study,RWS)[5],利用“医疗机构ADE主动监测与智能评估警示系统”(以下简称“自动监测系统”)[6-7],回顾性自动监测我院2008年1月1日– 2016年12月31日期间使用利奈唑胺注射液(0.6 g/300 mL/支)的所有住院患者电子信息;自动监测系统的各项排除条件设置为禁用,以获取最大纳入样本。自动监测系统筛查出的报警病例由研究人员分别进行双人盲评逐一甄定。
1.2 阳性病例判断标准
1.2.1 药源性血小板减少判定标准(ADR组) 依据标准为国家药品不良反应监测中心发布《药品不良反应术语使用指南》[8],用药后血小板连续两次检测< 100×109·L-1。血小板减少严重程度分级:1级:<正常值下限 ~ 75×109·L-1;2级:<(75 ~ 50)×109·L-1;3级:<(50 ~ 25)×109·L-1;4级:< 25×109·L-1;5级:死亡;其中1、2级为轻度,3级及以上为重度。
1.2.2 药源性血小板减少趋势判断标准(趋势组) 用药后血小板较用药前检查值基数出现≥25%的下降幅度[9]。
1.2.3 关联性评价标准 参照我国《药品不良反应报告和监测管理办法》中五项判定标准,六级关联性评价结果中“可能”及以上病例为阳性病例。
1.3 数据处理
患者一次住院期间用药间隔大于72 h计为2个用药例次。同一患者不同用药时间段出现ADR,计为一个再暴露阳性病例。ADR发生率按照阳性病例除以纳入监测患者例数计算。应用Excel 2010、SPSS 22.0进行统计学汇总分析,检验水准α= 0.05,计量资料用均数±标准差表示。比值比(OR)用于反映暴露因素与疾病的强度,结果>1时说明暴露因素可能是ADR的风险因素;95%的置信区间(CI)是样本总体参数的估值区间,反映OR值的可信赖度。
2 结果
2.1 用药人群概况
研究纳入利奈唑胺注射液用药患者5336例,用药5666例次;其中男性3371例(63.17%),女性1965例(36.83%);年龄1 ~ 111岁,平均年龄(54.34±20.12)岁;用药时间1 ~ 44 d,平均(6.22±4.80) d。
2.2 监测评价结果
ADR组阳性266例(4.99%),发生ADR用药时间为1 ~ 26 d,平均(6.42±4.25) d,用药时间为2 ~ 36 d,平均(8.51±4.89) d;排除血小板基础值较低、下降幅度未达到基值25%的56例,为210例(3.94%)。趋势组阳性422例(7.91%),用药时间为3 ~ 28 d,平均(9.20±4.42) d;两组合计阳性结果为478例(8.96%)。详见表1。
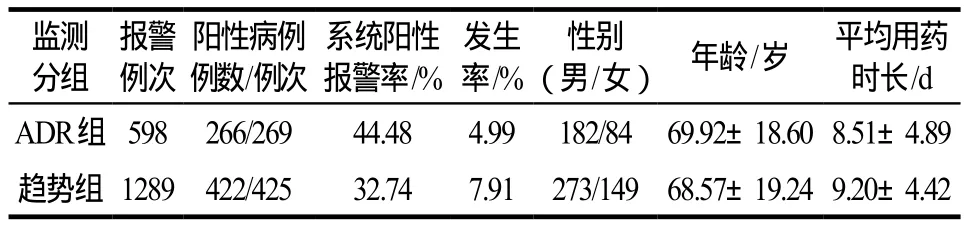
表1 ADR组和趋势组的利奈唑胺相关血小板减少监测数据Tab 1 Monitoring data of linezolid associated thrombocytopenia in ADR group and trend group
2.3 年度分布情况
年度分布情况详见表2。
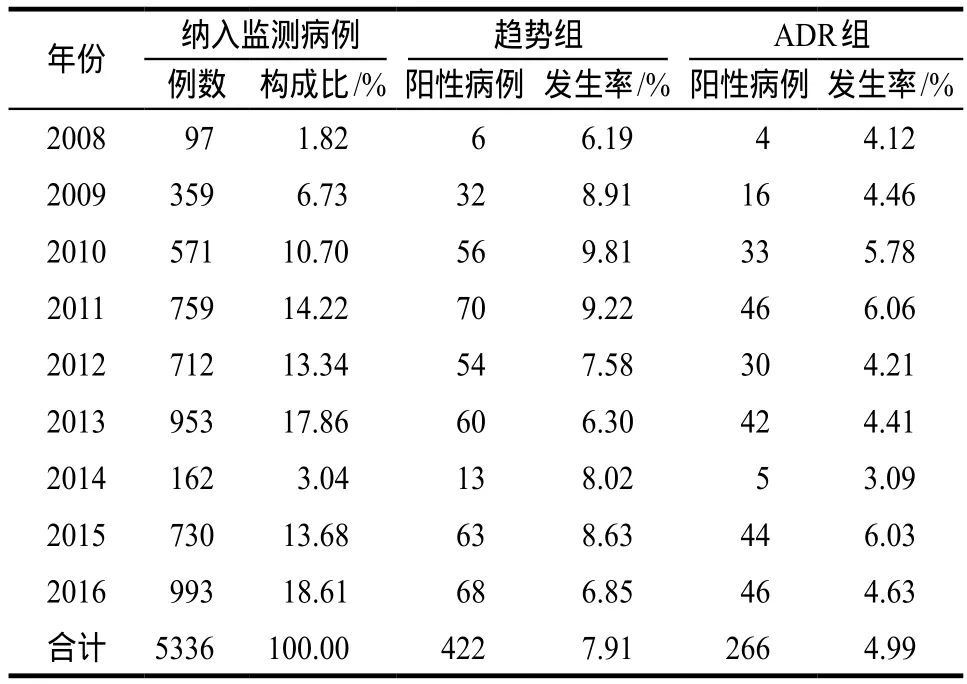
表2 按年度统计的入组病例及阳性病例Tab 2 Inclusion cases and positive cases according to annual statistics
2.4 年龄分布情况
年龄分布情况详见表3。
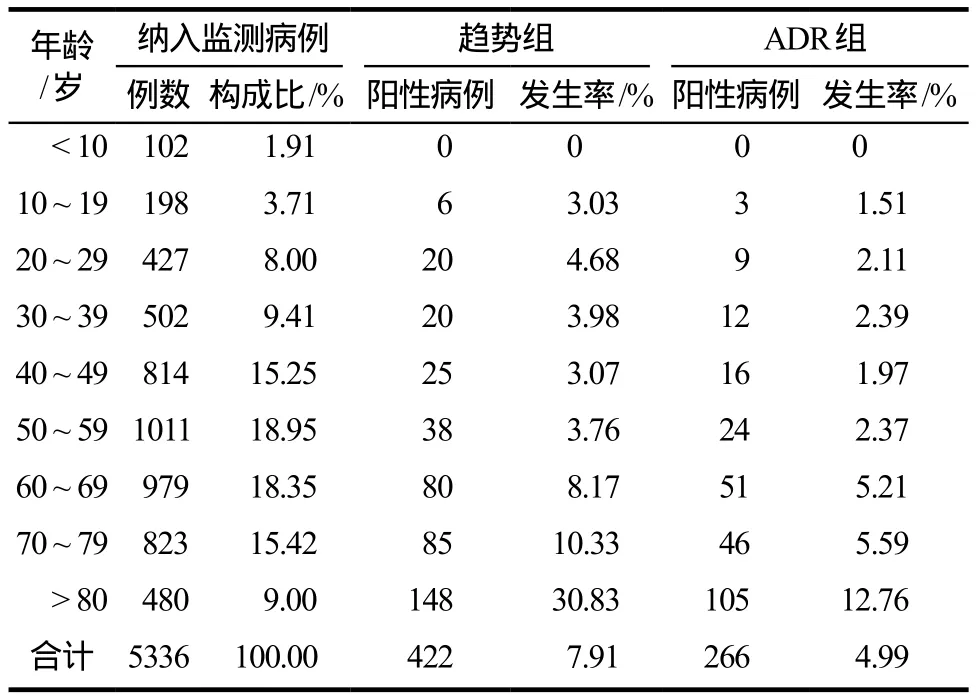
表3 按年龄分段统计的入组病例及阳性病例Tab 3 Inclusion cases and positive cases according to age group statistics
2.5 ADR组阳性病例结果分析
ADR组阳性266例的关联性评价结果中有3例为肯定,其中2例是患者在1次住院中两次用药后皆发生血小板减少且无其他明确干扰因素,另1例患者为2次住院皆在用药后发生血小板减少。有药物过敏史38例(14.29%)。严重程度属于1、2级的轻度ADR 93例(34.96%),3级及以上重度ADR 173例(65.04%)。关联性评价结果与最后结局详见表4。
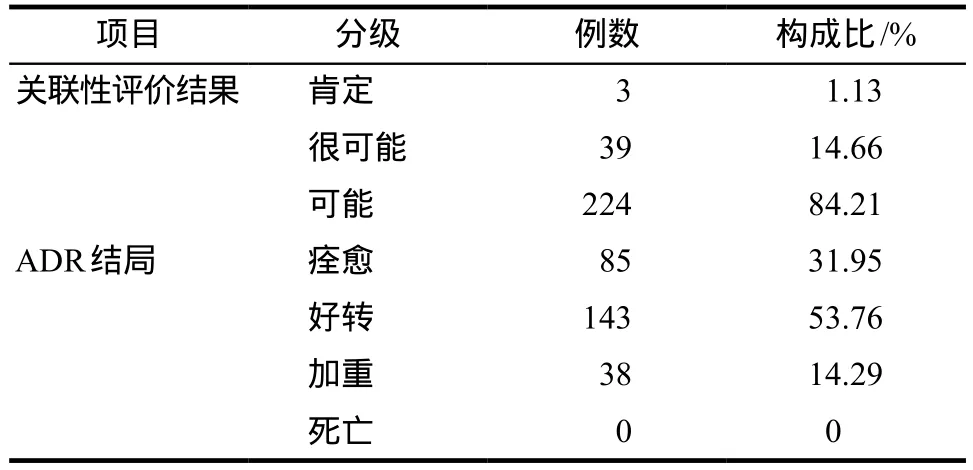
表4 ADR组阳性病例统计结果Tab 4 Statistical results of positive cases in ADR group
2.6 趋势组阳性病例结果分析
2.6.1 用药后血小板降幅与降速情况分析 将用药后血小板降低较用药前检查值基数下降幅度大于等于25%病例进行分组分析;同时按照不同的日降低幅度分组检验,见表5。
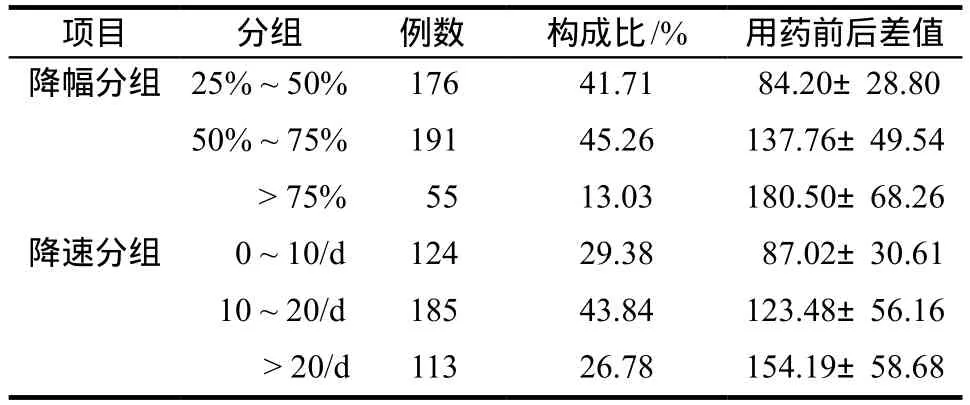
表5 阳性病例各数据类型分组统计检验结果Tab 5 Statistical test results of different data types of positive cases
2.6.2 用药时间与剂量分组分析 将趋势组阳性病例按发生时的用药时长进行分段统计,结果见表6。7 d内发生的日降幅最大,且其中有80例发生在用药后1 ~3 d。不同剂量分组之间则无显著性差异。
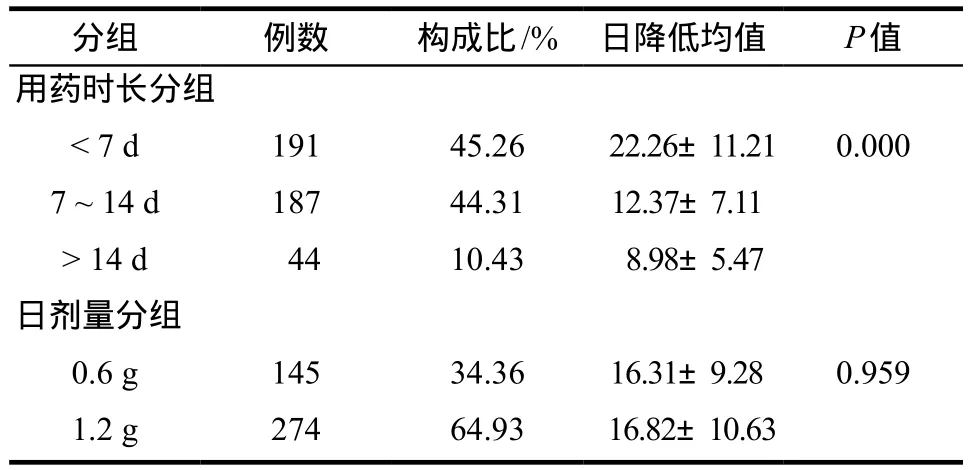
表6 阳性病例用药时长与剂量分组统计检验结果Tab 6 Statistical test results of medication duration and dose groups of positive cases
2.6.3 相关影响因素的差异性检验 对阳性病例的年龄、性别、日剂量进行组间差异性检验,见表7。
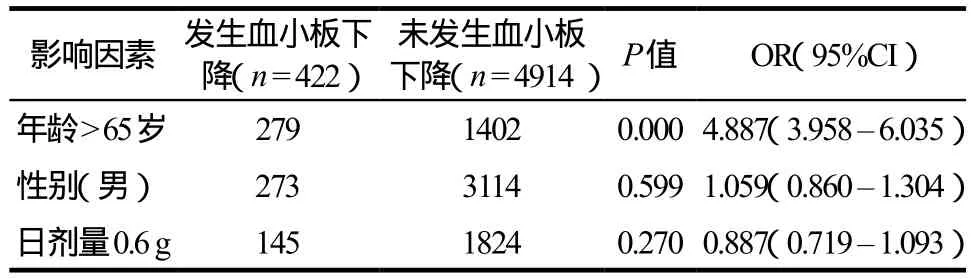
表7 影响因素差异性检验Tab 7 Difference test of in fl uencing factors
3 讨论
3.1 血小板减少的不同监测指标选择
药源性血小板减少标准为用药开始后确定出现血小板<100×109·L-1,本研究结果显示其ADR发生率为4.99%,高于药品说明书中2.4%的发生率,低于国内外文献报道的7.4% ~ 64.7%[10-12],可能与本研究用药人群年龄分布更为广范有关(60岁以下占57.23%)。有56例的血小板< 100×109·L-1但降低幅度< 25%属于轻微ADR;两组合计的阳性结果为478例,总发生率8.96%。文献中报道用药患者血小板基数值偏低是危险因素[4,9],但实际上血小板降幅大、进展快的严重ADR因其损害重、恢复慢更应受到关注。表5数据显示,随降幅上升用药前后血小板减少差值相应增加(25% ~ 50%组为84.20±28.80,> 75%组为180.50±68.26);而日减少值越大,用药前后血小板减少差值越高(0 ~ 10/d组为87.02±30.61,> 20/d组为154.19±58.68)。因此本研究重点围绕趋势组阳性病例开展分析更具参考意义。
3.2 阳性病例的年度分布和年龄分布
按年度分布进行统计的结果显示,ADR组及趋势组的血小板减少发生情况总体波动不大,比较平缓。但是按照用药人群的年龄分布情况进行统计,则随着年龄上升血小板减少发生率两组均呈现非常显著的上升趋势;80岁以上人群ADR组及趋势组的发生率分别高达12.76%、30.83%。ADR组及趋势组阳性病例的平均年龄分别为(69.92±18.60)岁、(68.57±19.24)岁,明显高于总用药人群的年龄构成(54.34±20.12)岁,正如文献报道所分析,老年人因正常的生理功能衰退导致应对改变是重要原因[9];相关影响因素的进一步分析结果也显示年龄为显著影响因素(P= 0.000),其OR(95%CI)为4.887(3.958 –6.035)。
3.3 血小板减少趋势的发生机制分析
药源性血小板减少发病机制复杂,往往是多种机制先后或共同作用的结果。文献中报道关于利奈唑胺导致的血小板减少症很可能与免疫介导有关,而非完全骨髓抑制所致[13-15]。通常直接骨髓抑制作用的表达,应当与血小板的生长周期5 ~ 7 d相一致;而免疫介导相关则相对会表现的发展快而严重。研究中对趋势组阳性病例用药后发生时间分段统计结果表明,不同用药时长的血小板日降低均值有显著性差异(P=0.000),尤以7 d内发生的日降幅最大,且有80例是发生在用药后的1 ~ 3 d。提示临床应用利奈唑胺时应全程关注;对于用药后较短时间发生血小板减少的更应及时干预,以免出现严重后果。
3.4 基于HIS大数据开展的真实世界研究具备现实意义
随着贯穿药品全生命周期的管理制度日趋严格,开展新药上市后大样本用药人群真实世界安全性再评价日趋必要。本研究中“医疗机构ADE主动监测与智能评估警示系统”应用多年渐趋规范[16-17],对接医院信息系统(HIS)历史数据库后,可围绕长达十多年的电子医疗信息开展大样本用药人群ADR主动监测,尤其适于因控制使用导致用药人群较少的重点监测品种。不仅可以实施大样本用药人群的回顾性分析,还能够体现对持续来院治疗患者开展连续监测优势,本研究中即有1例患者是在2次住院期间均出现同样ADR,关联性评价结果为肯定。
3.5 基于自动监测系统开展药物安全性评价精准快俭
自动监测系统排除条件选项与设置的选择颇费思量,排除条件严苛会导致部分阳性预警病例漏报,放宽又会使阳性报警率降低,人工甄别量增加;本研究设置了最少排除条件,最终用药人群100%入组,完成5336例用药人群的全部数据提取与自动评估并列出报警病例仅用数小时,虽然阳性报警率降低至32.74%和44.48%,导致后期人工甄别工作量有所增加,但较之传统的人工主动监测仍然极大地缩短了研究周期、降低了研究成本;而与本团队前期研究19.47%的纳入率相比[9],ADR发生率更为精确可信,相关数据更能反映临床的真实情况、也更具参考价值。

