尼罗罗非鱼CRTC2基因克隆及其表达规律分析
钟艺文 褚武英 许友卿 丁兆坤 张建社 李玉珑 成嘉 陈亨德 安晓玲 王利香


摘要:【目的】掌握尼罗罗非鱼活化环磷酸腺苷效应元件结合蛋白调节转录共激活因子2(CRTC2)基因的表达变化规律,并探究饥饿对其表达的影响,为研究尼罗罗非鱼CRTC2基因功能打下基础。【方法】采用RACE-PCR从尼罗罗非鱼肌肉组织中克隆CRTC2基因,对其进行生物信息学分析,并采用实时荧光定量PCR(qRT-PCR)分析不同组织/器官中CRTC2基因的表达量。【结果】尼罗罗非鱼CRTC2基因全长6927 bp,其开放阅讀框(ORF)2388 bp,5'端非编码区(5'UTR)343 bp,3'端非编码区(3'UTR)4196 bp,编码795个氨基酸,具有保守的CORC-N、CORC-M和CORC-C结构域。由基于CRTC2氨基酸序列同源性构建的系统发育进化树可知,尼罗罗非鱼与红鳍东方鲀的亲缘关系最近。尼罗罗非鱼的白肌、红肌、心脏、脾脏、肝脏、肾脏、脑组织和肠道等8个不同组织/器官中均有CRTC2基因表达,但以脑组织和白肌中的表达量较高;与正常投喂的尼罗罗非鱼相比,饥饿7 d的尼罗罗非鱼白肌CRTC2基因表达无显著变化(P>0.05),但饥饿15 d后CRTC2基因表达显著上调(P<0.05)。【结论】尼罗罗非鱼各组织/器官中CRTC2基因的表达具有一定规律性,长期饥饿会影响CRTC2基因表达,即CRTC2可能与糖代谢密切相关,直接或间接影响尼罗罗非鱼的能量吸收和代谢。因此,尼罗罗非鱼CRTC2基因可作为信号转导调控糖代谢的候选基因。
关键词: 尼罗罗非鱼;CRTC2 基因;表达规律;饥饿;糖代谢
中图分类号: S965.125 文献标志码: A 文章编号:2095-1191(2018)12-2539-06
Cloning and expression features of CRTC2 gene in Nile tilapia
ZHONG Yi-wen1, CHU Wu-ying2, XU You-qing1*, DING Zhao-kun1*, ZHANG Jian-she2, LI Yu-long2, CHENG Jia2, CHEN Heng-de1, AN Xiao-ling1, WANG Li-xiang1
(1Institute for Fishery Sciences, Guangxi University, Nanning 530004, China; 2Changsha University,
Changsha 410000, China)
Abstract:【Objective】The purpose of this study was to clone cyclic adenosine monophosphate responsive element-binding protein regulated transcription coactivator 2(CRTC2) gene from Nile tilapia and analyze its variation regulation. And effects of starvation on the gene expression were also studied to provide references for studying CRTC2 gene function in Nile tilapia. 【Method】The RACE-PCR technique was used to clone the CRTC2 gene from Nile tilapia muscle tissue, and bioinformatics analysis was conducted. The expression of CRTC2 gene in Nile tilapia tissues was analyzed by real-time fluorescent quantitative PCR(qRT-PCR) technique. 【Result】The full-length of CRTC2 gene of Nile tilapia was 6927 bp. Its open reading frame(ORF) region was 2388 bp, encoding 795 amino acids, 5' noncoding region(UTR) 343 bp and 3' UTR 4196 bp. It contained conserved CORC-N, CORC-M and CORC-C domains. Phylogenetic tree analysis based on CRTC2 amino acid sequence homology showed that the relationship between Nile tilapia and red fin oriental oyster was the closest. CRTC2 gene was expressed in the white muscle, red muscle, heart, spleen, liver, kidney, brain and intestine of Nile tilapia, and the expression level was the highest in brain and white muscle. There was no significant difference in the expression of white muscle CRTC2 gene in 7 d of starvation group compared with non-starved group(P>0.05). The expression of CRTC2 gene of white muscle increased significantly after starvation for 15 d(P<0.05). 【Conclusion】 The expression of CRTC2 gene in all tissues/organs of Nile tilapia has certain regularity. Long-term starvation treatment can affect the expression of CRTC2 gene, indicating that CRTC2 may be closely related to glucose metabolism, directly or indirectly affecting the Nile Tilapia energy absorption and metabolism. Therefore,the CRTC2 gene of Nile tilapia can be used as one of the candidate genes for signal transduction regulation of glucose metabolism.
Key words: Nile tilapia; CRTC2 gene; expression regularity; starvation; glucose metabolism
0 引言
【研究意义】活化环磷酸腺苷效应元件结合蛋白调节转录共激活因子(CRTCs)是2003年利用基因组高通量筛選技术发现的一个调节环磷酸腺苷应答元件结合蛋白(CREB)转录因子活性的真核蛋白家族(Iourgenko et al.,2003),高度保守的卷曲—螺旋结构域是CRTCs家族的结构特征,能与CREB的碱性亮氨酸拉链结构域(bZIP)相结合,从而增加CREB的活性(Conkright et al.,2003)。哺乳动物CRTCs家族基因由CRTC1、CRTC2和CRTC3组成,其中,CRTC1基因主要存在于小鼠的脑组织中,CRTC2和CRTC3基因在多个组织中普遍分布(徐怀超,2016)。CRTC2是CREB的转录共激活因子,也是cAMP应答中糖异生基因表达的中枢调控因子(Cheng and Saltiel,2006)。罗非鱼是我国的主要养殖水产品,蛋白质含量高,且富含人体所需的8种必需氨基酸,尤其是谷氨酸和甘氨酸含量特别高(郝淑贤等,2006;郝志明等,2006),但有关罗非鱼糖代谢的分子途径尚未清楚,因此明确CRTC2基因在罗非鱼组织/器官中的表达规律,可为研究罗非鱼糖代谢的分子机制提供参考依据。【前人研究进展】CRTC2是调节糖异生相关基因转录的关键因子,在小鼠肌肉组织中的表达量最高,而在肝脏组织中的表达量最低(徐怀超,2016)。在饥饿状态下,CRTC2基因去磷酸化能促进小鼠空腹葡萄糖的生成;但恢复喂食后其磷酸化加速糖异生的发生,说明CRTC2在小鼠葡萄糖稳态中发挥重要作用(Koo et al.,2005)。CRTC2是空腹与内质网应激的双传感器,通过防止肝糖原异生过度增加,而有效预防肥胖症的慢性高血糖症发生(Wang et al.,2009);敲除CRTC2基因的小鼠经饥饿处理后有效降低了循环血糖浓度,进而提高喂食导致肥胖的胰岛素敏感性(Wang et al.,2010)。说明CRTC2基因不仅在甘油三酯动态平衡中发挥作用,还是空腹葡萄糖代谢的关键调节剂(Saberi et al.,2009;Han et al.,2015)。韩锦铂等(2015)研究证实,CRTC2介导mTOR调控且依赖于COPII复合物的固醇调控元件结合蛋白1(SREBP1)的成熟,揭示了CRTC2介导的信号通路在调控肝脏脂肪代谢过程中的重要作用。此外,Epstein-Barr病毒通过CRTC2与BZLF1蛋白间的相互作用而从潜伏期重新激活(Murata et al.,2009),表明CRTC2有望开发成病毒的激活剂。【本研究切入点】目前,有关CRTC2基因的研究主要集中在人类和小鼠上,在鱼类中鲜有报道。【拟解决的关键问题】采用RACE-PCR从尼罗罗非鱼肌肉组织中克隆CRTC2基因,对其进行生物信息学分析;采用实时荧光定量PCR(qRT-PCR)分析不同组织/器官中CRTC2基因的表达量,掌握CRTC2基因的表达变化规律,并探究饥饿对CRTC2基因表达的影响,以期为研究尼罗罗非鱼CRTC2基因功能打下基础。
1 材料与方法
1. 1 试验材料
成年尼罗罗非鱼由湖南省水产科学研究所提供,共18尾,规格500±10 g/尾。每尾鱼均采集白肌、红肌、心脏、脾脏、肝脏、肾脏、脑组织和肠道等8个样品,采集后立即放入液氮中迅速冷冻,-80 ℃保存备用。Oligotex mRNA提取试剂盒购自QIAGEN公司,琼脂糖凝胶纯化回收试剂盒购自OMEGA公司,反转录试剂盒及DNA酶试剂盒购自Fermentas公司,pMD19-T载体、大肠杆菌DH5α感受态细胞及LA Taq@购自TaKaRa公司。
1. 2 尼罗罗非鱼CRTC2基因克隆
1. 2. 1 提取总RNA及反转录 肌肉总RNA采用Trizol试剂进行提取,利用超微量紫外分光光度计测定OD,再以1.2%琼脂糖凝胶电泳检测其浓度和纯度。总RNA样品的OD260/OD280在1.8~2.0时,使用Oligotex mRNA提取试剂盒分离纯化mRNA,然后以获得的mRNA为模板,利用反转录试剂盒Super Script?Ⅱ-RT合成cDNA第一链。
1. 2. 2 引物设计与合成 从GenBank下载与尼罗罗非鱼亲缘关系最近的红鳍东方鲀CRTC2基因全序列,与本课题组前期克隆获得的CRTC2部分基因序列进行保守性分析,采用Primer Premer 5.0在其保守性较高的区域设计CRTC2基因的3'端和5'端克隆引物及通用引物(表1)。所有引物均由生工生物工程(上海)股份有限公司合成。
1. 2. 3 CRTC2基因片段克隆与测序分析 以cDNA为模板进行RACE-PCR扩增(赵献芝等,2009),扩增产物采用1.2%琼脂糖凝胶电泳进行浓度和纯度分析,然后与pMD19-T载体连接过夜后转化DH5α感受态细胞,先37 ℃正置培养1 h再倒置培养过夜,挑取白色菌斑进行培养液扩大培养,以1.2%琼脂糖凝胶电泳检测是否成功插入目的片段。获得的目的产物送至铂尚生物技术(上海)有限公司测序,测序结果进行BLAST比对分析,待全部目的基因片段确定后,将所有基因片段序列拼接在一起即得到目的基因。
1. 2. 4 CRTC2基因生物信息学分析 利用DNAMAN对克隆获得的CRTC2基因序列进行氨基酸推导和核苷酸序列分析,使用ProtParam推测其蛋白质的理论等电点、分子量及氨基酸组成,运用PROSITE进行蛋白功能区预测,同时采用ClustalW进行氨基酸序列比对分析,以MEGA 7.0构建基于氨基酸序列同源性的系统发育进化树。
1. 3 尼罗罗非鱼CRTC2基因表达规律分析
1. 3. 1 不同组织/器官总RNA提取及cDNA第一链合成 采用Trizol试剂提取正常投喂(对照组)尼罗罗非鱼白肌、红肌、心脏、脾脏、肝脏、肾脏、脑组织和肠道的总RNA及饥饿7和15 d后的白肌总RNA,测定其OD,同时采用1.2%琼脂糖凝胶电泳检测其浓度和纯度。cDNA单链由加入poly(T)引物和Super Script Ⅱ阴性逆轉录酶的反转录试剂盒合成。
1. 3. 2 引物设计与合成 依据测序获得的目的基因开放阅读框(ORF)序列,设计CRTC2基因的qRT-PCR引物,以β-actin内参基因为管家基因,所有引物均由生工生物工程(上海)股份有限公司合成。
1. 3. 3 qRT-PCR 选用SYBR GreenⅠ染料法,在qRT-PCR仪上进行扩增分析。以最高荧光值及最小Ct为标准,分别优化引物浓度、退火温度和循环条件。反应体系25.0 μL:SYBR? Premix Ex TaqTM 12.5 μL,上、下游引物各0.5 μL,cDNA模板2.0 μL,以ddH2O补足至25.0 μL。扩增程序:95 ℃预变性30 s;95 ℃ 5 s,58 ℃ 30 s,进行40次循环;72 ℃延伸15 s。同时绘制熔解曲线:设65~95 ℃,每隔0.05 ℃读1次板;反应结束后对试验结果进行观察及数据处理分析。
1. 3. 4 数据处理 依据内参基因及目的基因的Ct,利用2?△△Ct计算目的基因的相对表达量(Livak and Schmittgen,2001)。基因表达丰度采用SPSS 17.0进行单因素方差分析(One-way ANOVA),并利用最小显著差数法(LSD)进行多重比较。
2 结果与分析
2. 1 尼罗罗非鱼CRTC2基因序列分析结果
将CRTC2基因的3'端、5'端及编码区重叠区域间拼接即获得目的基因全长序列。测序结果表明,CRTC2基因全长6927 bp,GenBank登录号为MH279546,包括ORF 2388 bp,5'端非编码区(5'UTR)343 bp,3'端非编码区(3'UTR)4196 bp,编码795个氨基酸,分子量约84.69 kD,理论等电点6.86。使用http://www.molbiol-tools.ca/Motifs.htm分析其结构域,发现CRTC2基因具有保守的CORC-N、CORC-M和CORC-C结构域(图1)。
2. 2 氨基酸序列比对及系统发育进化树分析结果
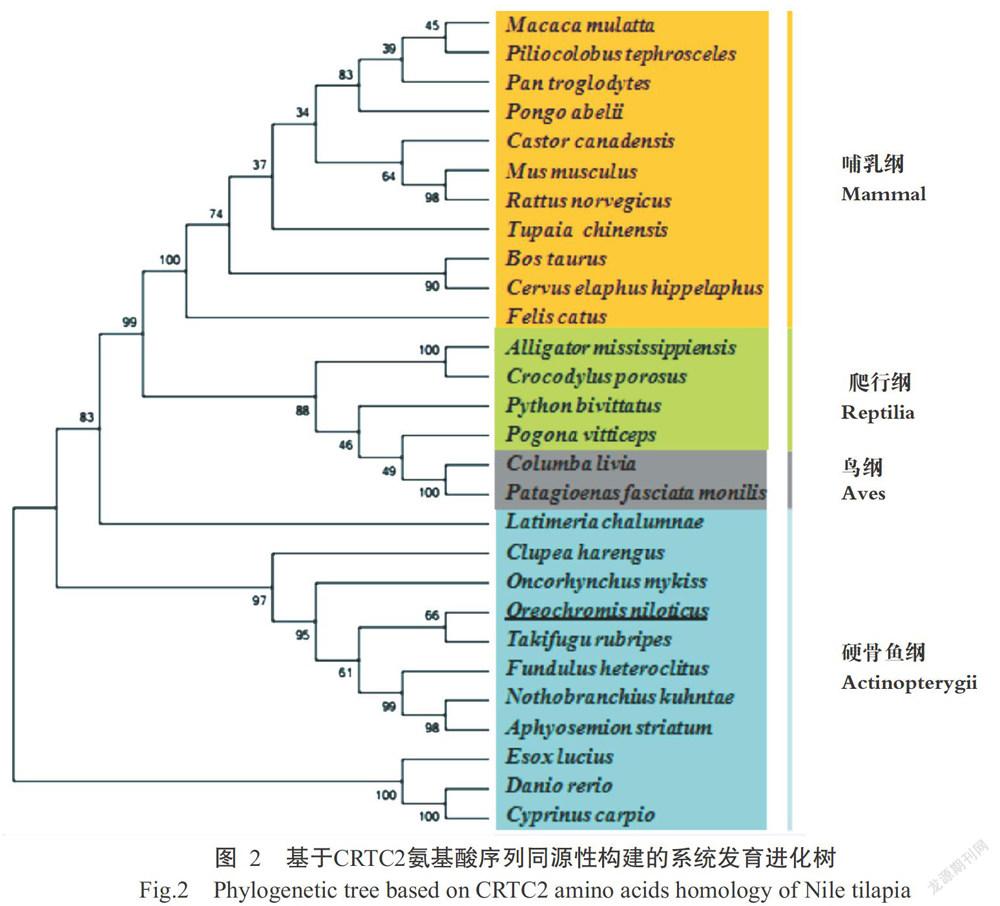
参照物种的CRTC2基因序列(表2)在NCBI中搜索,使用BioEdit比对分析CRTC2氨基酸序列的同源性,再以MEGA 7.0构建基于CRTC2氨基酸序列同源性的系统发育进化树(图2),结果显示,尼罗罗非鱼与红鳍东方鲀(Takifugu rubripes)聚在同一分支上,表明二者的亲缘关系最近;然后与其他大部分鱼类构成一个大的分支,爬行纲、鸟纲和哺乳纲等物种则形成另一个分支,可能是在进化过程不同物种所含的氨基酸数目差异化所致。
2. 3 不同组织/器官中CRTC2基因表达分析结果
采用qRT-PCR检测分析尼罗罗非鱼白肌、红肌、心脏、脾脏、肝脏、肾脏、脑组织和肠道中CRTC2基因mRNA的表达情况,结果表明,CRTC2基因在脑组织中的表达最高(图3),在白肌、肠道、脾脏、红肌和心脏组织也有较高的表达,但在肝脏和肾脏等组织的表达相对较弱,显著低于在脑组织和白肌中的表达量(P<0.05,下同),说明CRTC2基因在尼罗罗非鱼的各组织/器官中均有表达,且有可能参与调节其摄食机能。
2. 4 饥饿胁迫对尼罗罗非鱼白肌CRTC2基因表达的影响
采用qRT-PCR检测分析正常投喂及饥饿7和15 d后尼罗罗非鱼白肌中CRTC2基因mRNA的表达情况,结果(图4)表明,与正常投喂的尼罗罗非鱼相比,饥饿7 d的尼罗罗非鱼白肌CRTC2基因表达无显著变化(P>0.05),但饥饿15 d后CRTC2基因mRNA的表达显著上调,因此推测CRTC2基因参与调节尼罗罗非鱼的能量代谢。
3 讨论
CRTC2在哺乳动物中的研究较多,尤其在人类和小鼠中。有关小鼠的研究主要探讨CRTC2是否与糖代谢和脂肪代谢等生理功能有关(Dentin et al.,2008;Altarejos and Montminy,2011;Sun et al.,2015)。李慧阁和傅力(2016)研究认为,CRTC2基因是小鼠空腹饥饿状态下血糖代谢的调控因子。而在针对人类的相关研究中,主要探析CRTC2基因与癌症的关系(张雅雅等,2010;Han et al.,2014;Li et al.,2017)。本研究采用RACE结合常规PCR克隆获得尼罗罗非鱼CRTC2基因的全长序列为6927 bp,包括ORF 2388 bp,5'UTR 343 bp,3'UTR 4196 bp,编码795个氨基酸。利用BioEdit和MEGA 7.0分别进行氨基酸序列比对分析及构建基于CRTC2氨基酸序列同源性的系统发育进化树,结果显示28个物种分别归属于四大类(哺乳纲、爬行纲、鸟纲和硬骨鱼纲),表明CRTC2氨基酸序列在不同种属间高度保守,其中尼罗罗非鱼与红鳍东方鲀的亲缘关系最近。
为掌握尼罗罗非鱼CRTC2基因的表达规律,本研究首先用qRT-PCR检测正常投喂尼罗罗非鱼白肌、红肌、心脏、脾脏、肝脏、肾脏、脑组织和肠道等8个不同组织/器官中CRTC2基因mRNA的表达情况,结果发现CRTC2基因在尼罗罗非鱼的各组织/器官中均有表达,但以脑组织和白肌的表达量较高;同时对比分析正常投喂及饥饿7和15 d后尼罗罗非鱼白肌中CRTC2基因的表达量,结果显示饥饿7 d的尼罗罗非鱼白肌CRTC2基因表达量与正常投喂尼罗罗非鱼无显著差异,但饥饿15 d后CRTC2基因的mRNA表达显著上调,表明长期饥饿会增强CRTC2基因在尼罗罗非鱼中的表达,推测CRTC2基因通过影响尼罗罗非鱼摄食而调节糖代谢和脂肪代谢,直接或间接影响其能量吸收和代谢,但具体机理有待进一步探究。
4 结论
尼罗罗非鱼各组织/器官中CRTC2基因的表达具有一定规律性,长期饥饿会影响CRTC2基因表达,即CRTC2可能与糖代谢密切相关,直接或间接影响尼罗罗非鱼的能量吸收和代谢。因此,尼罗罗非鱼CRTC2基因可作为信号转导调控糖代谢的候选基因。
参考文献:
韩锦铂,李二伟,陈力群,张元元,魏方超,劉洁媛,邓海腾,王一国. 2015. CRTC2在肝脏脂内稳态中的作用[J]. 中国细胞生物学学报,37(9):1193-1196. [Han J B,Li E W,Chen L Q,Zhang Y Y,Wei F C,Liu J Y,Deng H T,Wang Y G. 2015. The role of CRTC2 in hepatic lipid homeostasis[J]. Chinese Journal of Cell Biology,37(9):1193-1196.]
郝淑贤,石红,李来好,杨贤庆,岑剑伟,刁石强,周婉君. 2006. 茄汁罗非鱼软包装罐头加工技术研究[J]. 南方水产,2(6):49-54. [Hao S X,Shi H,Li L H,Yang X Q,Cen J W,Diao S Q,Zhou W J. 2006. Studies of the processing technology of soft package tomato sauce tilapia can[J]. South China Fisheries Science,2(6):49-54.]
郝志明,吴燕燕,李来好. 2006. 罗非鱼内脏中酶的筛选[J]. 南方水产,2(2):38-42. [Hao Z M,Wu Y Y,Li L H. 2006. A selection of enzyme in the tilapia internal organs[J]. South China Fisheries Science,2(2):38-42.]
李慧阁,傅力. 2016. CREB辅活因子CRTC2在调节糖、脂代谢及应激反应中的作用[J]. 中国运动医学杂志,35(1):94-98. [Li H G,Fu L. 2016. The role of CREB cofactor CRTC2 in regulating sugar and lipid metabolism and stress response[J]. Chinese Journal of Sports Medicine,35(1):94-98.]
徐怀超. 2016. CRTC家族3个基因SNP检测及其与秦川肉牛生长性状和胴体性状的关联性分析[D]. 杨凌:西北农林科技大学. [Xu H C. 2016. Singie nucleotide polymorphism of 3 genes of CRTC and associations with growth and carcass traits in Qinchuan beef cattle[D]. Yangling:Northwest A&F University.]
张雅雅,包传恩,洪节约,陈玉强. 2010. AMPK在肿瘤发生发展中的作用机制研究[J]. 肿瘤,30(8):715-718. [Zhang Y Y,Bao C E,Hong J Y,Chen Y Q. 2010. The action mechanism of AMPK in tumorigenesis and development[J]. Tumor,30(8):715-718.]
赵献芝,李静,李琴. 2009. RACE技术在动物基因克隆中的应用[J]. 上海畜牧兽医通讯,(4):50-51. [Zhao X Z,Li J,Li Q. 2009. Application of RACE technique in animal gene cloning[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine,(4):50-51.]
Altarejos J Y,Montminy M. 2011. CREB and the CRTC co-activators:Sensors for hormonal and metabolic signals[J]. Nature Reviews. Molecular Cell Biology,12(3):141-151.
Cheng A,Saltiel A R. 2006. More TORC for the gluconeogenic engine[J]. Bioessays,28(3):231-234.
Conkright M D,Canettieri G,Screaton R,Guzman E,Mirag-lia L,Hogenesch J B,Montminy M. 2003. TORCs:Transducers of regulated CREB activity[J]. Molecular Cell,12(2):413-423.
Dentin R,Hedrick S,Xie J,Yates J,Montminy M. 2008. Hepatic glucose sensing via the CREB coactivator CRTC2[J]. Science,319(5868):1402-1405.
Han H S,Jung C Y,Yoon Y S,Choi S,Choi D,Kang G,Park K G,Kim S T,Koo S H. 2014. Arginine methylation of CRTC2 is critical in the transcriptional control of hepatic glucose metabolism[J]. Science Signaling,7(314):ra19. doi: 10.1126/scisignal.2004479.
Han J,Li E,Chen L,Zhang Y,Wei F,Liu J,Deng H,Wang Y. 2015. The CREB coactivator CRTC2 controls hepatic lipid metabolism by regulating SREBP1[J]. Nature,524(7564):243-246.
Iourgenko V,Zhang W,Mickanin C,Daly I,Jiang C,Hexham J M,Orth A P,Miraglia L,Meltzer J,Garza D,Chirn G W,McWhinnie E,Cohen D,Skelton J,Terry R,Yu Y,Bodian D,Buxton F P,Zhu J,Song C,Labow M A. 2003. Identification of a family of cAMP response element-binding protein coactivators by genome-scale functional analysis in mammalian cells[J]. Proceedings of the National Academy of Sciences of the United States of Ame-rica,100(21):12147-12152.
Koo S H,Flechner L,Qi L,Zhang X,Screaton R A,Jeffries S,Hedrick S,Xu W,Boussouar F,Brindle P,Takemori H,Montminy M. 2005. The CREB coactivator TORC2 is a key regulator of fasting glucose metabolism[J]. Nature,437(7062):1109-1111.
Li Y,Song Y,Zhao M,Guo Y,Yu C,Chen W,Shao S,Xu C,Zhou X,Zhao L,Zhang Z,Bo T,Xia Y,Proud C G,Wang X,Wang L,Zhao J,Gao L. 2017. A novel role for CRTC2 in hepatic cholesterol synthesis through SREBP-2[J]. Hepatology,66(2):481-497.
Livak K J,Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2?ΔΔCT method[J]. Methods,25(4):402-408.
Murata T,Sato Y,Nakayama S,Kudoh A,Iwahori S,Isomura H,Tajima M,Hishiki T,Ohshima T,Hijikata M,Shimotohno K,Tsurumi T. 2009. TORC2,a coactivator of cAMP-response element-binding protein, promotes Epstein-Barr virus reactivation from latency through interaction with viral BZLF1 protein[J]. The Journal of Biological Che-mistry,284(12):8033-8041.
Saberi M,Bjelica D,Schenk S,Imamura T,Bandyopadhyay G,Li P,Jadhar V,Vargeese C,Wang W,Bowman K,Zhang Y,Polisky B,Olefsky J M. 2009. Novel liver-specific TORC2 siRNA corrects hyperglycemia in rodent models of type 2 diabetes[J]. American Journal of Physio-logy,297(5):E1137-E1146.
Sun X,Dang F,Zhang D,Yuan Y,Zhang C,Wu Y,Wang Y,Liu Y. 2015. Glucagon-CREB/CRTC2 signaling cascade regulates hepatic BMAL1 protein[J]. The Journal of Bio-logical Chemistry,290(4):2189-2197.
Wang Y,Inoue H,Ravnskjaer K,Viste K,Miller N,Liu Y,Hedrick S,Vera L,Montminy M. 2010. Targeted disruption of the CREB coactivator Crtc2 increases insulin sensitivity[J]. Proceedings of the National Academy of Sciences of the United States of America,107(7):3087-3092.
Wang Y,Vera L,Fischer W H,Montminy M. 2009. The CREB coactivator CRTC2 links hepatic ER stress and fasting gluconeogenesis[J]. Nature,460(7254):534-537.

