营养强化混养条件下提高色绿藻生物量和虾青素产量
姜雪亚,陈俊辉,魏东
(华南理工大学食品科学与工程学院,广东广州 510640)
虾青素(Astaxanthin),化学名称为3,3’-二羟基 -4,4’-二酮基-β’β-胡萝卜素,是一种酮式类胡萝卜素。虾青素巨大的经济应用价值在于其具有超高的抗氧化活性,其抗氧化能力是β-胡萝卜素的10倍,维生素E的500倍,被誉为“超级维生素E”,可延缓皮肤衰老、提高机体免疫力等,因而在化妆品、医药等方面具有较好的应用前景[1~3]。虾青素的来源主要包括化学合成与天然提取,而天然提取的虾青素在稳定性、安全性和抗氧化性等明显优于合成虾青素。
天然虾青素的来源主要有三方面:从甲壳类动物中提取、从真菌或细菌中获得、从藻类细胞提取[4]。雨生红球藻被认为是生产天然虾青素的最佳来源,但是其缺点是细胞产率低、生长迟缓、易污染等,而色绿藻因其生长速率快、细胞产率高,不易污染等,因而近年来色绿藻被认为是大规模生产虾青素的潜在选择。
色绿藻Chromochloris zofingiensis是一种淡水单细胞绿藻,细胞直径范围2~15 μm,通过无性繁殖形成孢子分裂产生子细胞[5]。色绿藻既进行光自养,亦可以利用有机碳源进行异养,同时还可以利用光照与有机碳源进行混养生长。色绿藻胞内富含多种高价值的产物如初级类胡萝卜(主要包括叶黄素、β-胡萝卜素和玉米黄质等)、次级类胡萝卜素(主要包括虾青素、角黄质和金盏花黄质等)以及用于光合作用的叶绿素,因而近年来色绿藻受到国内外学者的广泛关注。
目前国内外对于色绿藻培养的研究大多集中在异养发酵方面,对于混养方便报道相对较少,但是混养条件下色绿藻的生物量浓度、生长速率均高于异养条件下的培养[6]。本实验则是选择混养条件下进行实验,主要分析了混养条件下,五种不同氮源种类、葡萄糖浓度和碳氮比对色绿藻生长和虾青素积累的影响,以期获得最高生物量浓度和相对较高的虾青素含量。
1 实验材料与方法
1.1 实验材料
1.1.1 藻种
本实验所采用的色绿藻(Chromochloris zofingiensisATCC 30412)购自美国模式培养物集存库(American Type Culture Collection,ATCC)菌种保藏中心。
1.1.2 主要仪器与设备
生物传感分析仪 SBA-40D购自山东省科学院生物研究所;高效液相分析仪购自美国 Dionex公司;BD Accuri C6流式细胞仪购自美国 BD 公司;ModulyoD-230冷冻干燥机购自 Thermor Electron Corporation;GLZ-A光量子计购自浙江托普仪器有限公司等。
1.2 实验方法
1.2.1 种子液的制备
从改良 Bristol’s medium[7]斜面上挑取一小环色绿藻藻苔,转接到含有 10 g/L 葡萄糖的 Bristol’s medium的平板上。在光照为 10 µmol/(m2·s),温度为 26 ℃的条件下,置于光照培养箱中培养7 d。再从培养基平板上挑取一个单藻落,接种至含有 10 g/L葡萄糖的Bristol’s medium 中,在光照为 10 µmol/(m2·s)、温度为26 ℃、转速为150 r/min 的恒温培养箱中连续培养4 d。
1.2.2 不同氮源种类对色绿藻生物量以及色素积累的影响
以不含氮源的Bristol’s medium为基本培养基,在同一葡萄糖浓度(30 g/L)条件下,按照相同的碳氮比(C/N比为34)在培养基中分别加入硝酸钠、胰蛋白胨、酵母膏、尿素、碳酸氢铵。每组设三个平行,并将pH调至6.50,分装至250 mL的三角瓶中,装液量为 100 mL,在 121 ℃条件下灭菌15 min。按照 10%的接种量进行接种,在光照为 10 µmol/(m2·s),温度为26 ℃,转速为 150 r/min 的条件下培养 8 d。
1.2.3 不同低碳氮比碳氮比对色绿藻生物量以及色素积累的影响
以不含氮源的Bristol’s medium为基本培养基,初始葡萄糖浓度为20 g/L,按照碳氮比分别为22、34、42加入硝酸钠,每组三个平行,进行试验。将pH调至6.50、分装并在 121 ℃条件下灭菌 15 min。按照10%的接种量进行接种,在光照为 10 µmol/(m2·s)、温度为26 ℃、转速为 150 r/min 的条件下培养 8 d。
1.2.4 不同葡萄糖浓度以及碳氮比对色绿藻生物量以及色素积累的影响
以不含氮源的Bristol’s medium为基本培养基,以葡萄糖、硝酸钠作为唯一碳氮源。在培养基中加入葡萄糖浓度(以下简写为 Glu.)分别为 10 g/L、20 g/L、30 g/L,同时每组葡萄糖浓度条件下按照碳氮比为 22、34,分别加入硝酸钠,共六组实验,其实验条件设置具体如下:每组葡萄糖浓度(10 g/L、20 g/L、30 g/L)条件下,均设置碳氮比分别为22、34,进行实验。
调节pH至6.50并分装,装液量为100 mL,在121 ℃条件下灭菌15 min。在接种量为10%,光照为10 µmol/(m2·s)、温度为 26 ℃、转速为 150 r/min 的条件下培养 8 d。
1.3 分析方法
1.3.1 生物量浓度的测定[8]
色绿藻生物量采取干重法进行测定。吸取 2 mL色绿藻培养液,置于干燥已称重的2 mL离心管中,离心、洗涤。将上清液与藻泥分离,将藻泥置于真空干燥箱中在60 ℃烘干至恒重,用分析天平称量并计算差值,每个样品重复测三次,取平均值。
1.3.2 干重得率(g/g)
干重得率α=(m1-m2)/(x1-x2)
其中:m1、m2为t1、t2时间对应的生物量浓度,x1、x2为t1、t2时间对应的葡萄糖浓度。
1.3.3 细胞的平均比生长速率
平均比生长速率的计算方法参考梁英等人的计算方法[9]。
1.3.4 葡萄糖浓度的测定
采用 SBA生物传感分析仪测定培养过程中的葡萄糖浓度。SBA校正量程为0.5~1.0 g/L[8]。测定前用1.0 g/L的葡萄糖标准品定标,取待测上清液,稀释至量程范围内,并移取25 μL样品进行测定。测定读数×稀释倍数即为每个样品的葡萄糖浓度。
1.3.5 总氮的测定
总氮(Total Nitrogen,TN)的测定采用购自哈希公司的DRB 200消解器和DR 2700分光光度计测定,其中DR 2700分光光度计的校正量程为0.5~25 mg/L与2~150 mg/L,取待测上清液,稀释至校正量程内,将加入Total Nitrogen Persulfate粉枕包的空白样与待测样置于DRB 200消解器中进行消解30 min,待冷却至室温后,加粉剂包(TNA、TNB)反应后,用DR 2700分光光度计测定。
1.3.6 细胞密度的测定
色绿藻细胞密度采取流式细胞仪测定,吸取1 mL培养过程中的藻液,稀释至校正量程。流式细胞仪测定细胞数稀释范围为700~1000个/μL。测定前样品要用超纯水清洗、过滤。
1.3.7 细胞中的色素的提取以及测定
准确称量冻干的藻粉10 mg于振荡管中,并加入适量的研磨珠。加入1 mL含有0.1%(m/V)的2,6-二叔丁基-4-甲基苯酚(BHT)的甲醇与二氯甲烷提取溶剂(3:1,V/V),高速振荡30 s,之后迅速置于液氮中冷却,离心收集上清液。如此反复提取直至藻细胞变成无色。收集上清液,用氮气吹干,加入1 mL甲醇与甲基叔丁基醚(MTBE)混合溶剂(1:1,V/V)定容。最后用0.22 μm的微孔有机滤膜进行过滤,转至棕色瓶中,低温保存用于液相分析。以上所有操作要在避光的条件下进行,以避免操作过程中色素被降解。色素含量的测定参照参考文献的液相测定方法进行测定[10]。色素校准品虾青素(41659)、叶绿素a(96145)、叶绿素b(00538)、叶黄素(07168)、角黄素(11775)均购自美国Sigma-Aldrich公司,将上述色素校准品配制成不同浓度的标准溶液,依据上述HPLC的测定条件,建立相应的色素标准曲线,进而进行样品中色素含量的定性和定量分析测定。
1.3.8 数据统计分析
采用 Microcal Origin 9.0 Software、SPSS 统计分析数据。
2 结果与讨论
2.1 不同氮源对色绿藻生物量浓度与色绿藻色素含量的影响
2.1.1 不同氮源对色绿藻生物量浓度影响
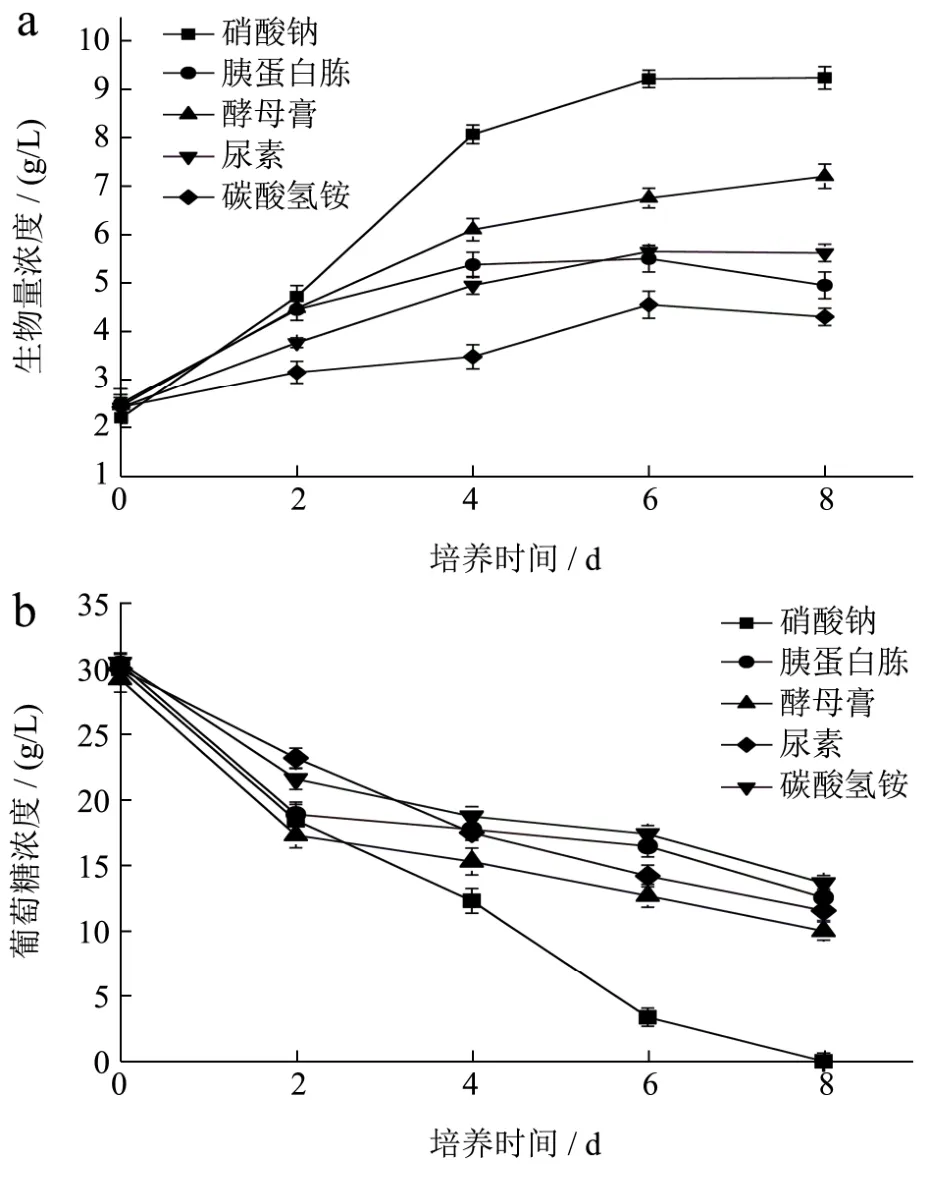
图1 不同氮源条件下色绿藻的生长曲线(a)以及葡萄糖的消耗曲线(b)Fig.1 Biomass concentrations (a) and time courses of glucose concentrations (b) in the cultures of C. zofingiensis with different nitrogen sources
不同氮源种类对色绿藻生长过程中葡萄糖消耗以及生物量浓度的影响如图1所示。如图1b所示,细胞生长初期葡萄糖消耗变化曲线基本一致,主要由于此时细胞生长处于延滞期,从第 2~6 d,葡萄糖消耗迅速,此时细胞处于对数增长期。而其中硝酸钠实验组消耗最快,葡萄糖在第8 d基本消耗完全。如图1a所示,在以硝酸钠为氮源的条件下,色绿藻生物量浓度显著优于其他四组(p<0.05)且硝酸钠组的生物量浓度最高可达到9.23 g/L。杨勋等人的研究了在以硝酸钠、尿素、氯化铵为氮源对色绿藻的生长的影响,其研究结果表明,培养时间为8 d时,硝酸钠组生物量浓度最优,与本实验结果类似[11]。而王忠明等人研究则是认为尿素是色绿藻的最佳氮源,且低浓度的尿素利于藻类生长[12]。与本实验结果产生差异主要原因可能由于尿素浓度以及培养基的差异。
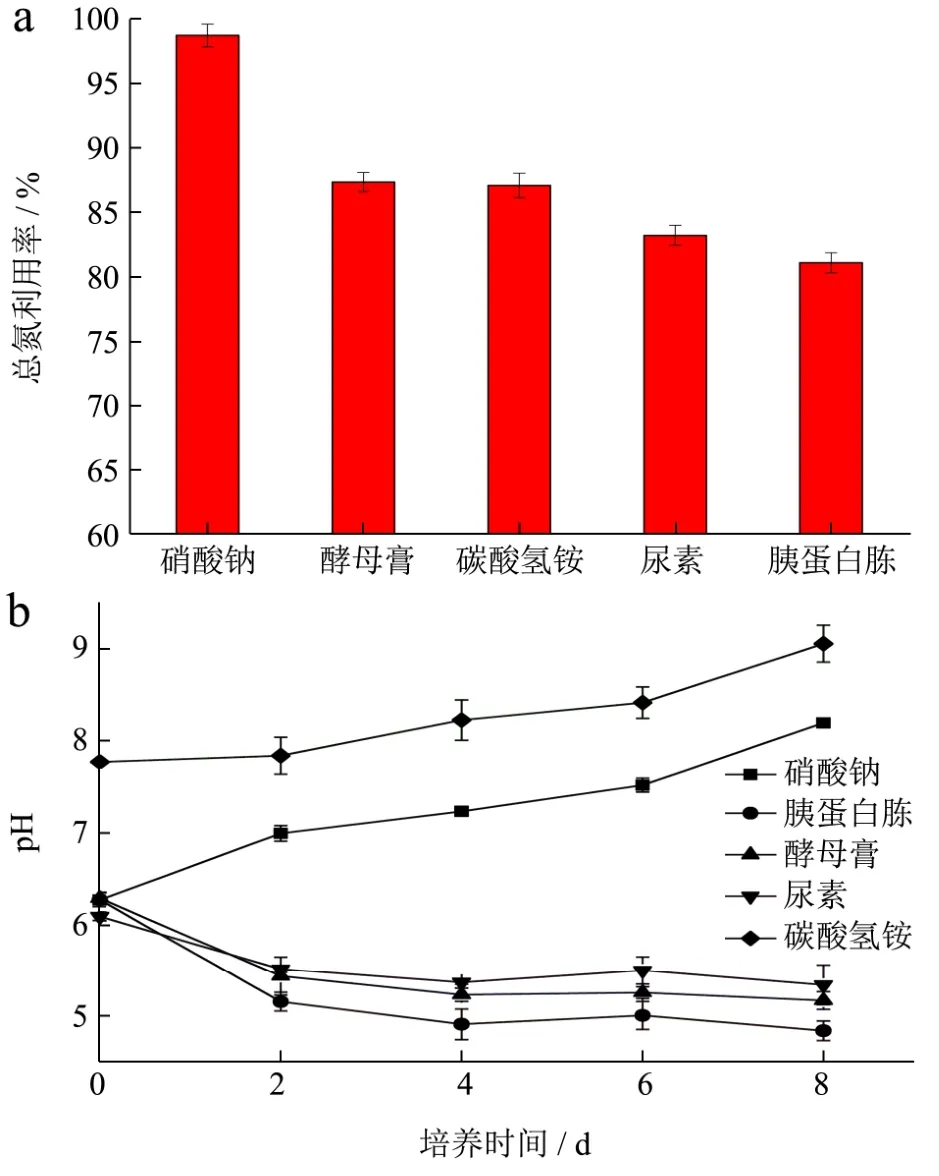
图2 不同氮源条件下色绿藻总氮利用率(a)以及pH的变化曲线(b)Fig.2 Total nitrogen utilization (a) and time courses of pH (b) in the cultures of C. zofingiensis with different nitrogen sources
不同氮源种类对色绿藻生长过程中总氮的利用率如图2a所示,总氮利用率从高至低为硝酸钠>酵母膏≈碳酸氢铵>尿素>胰蛋白胨,利用SPSS进行分析,以硝酸钠为氮源时消耗量显著高于其他处理组(p<0.05),因此实验结果表明色绿藻对硝态氮的利用率较高。
研究表明色绿藻生长的pH范围是5.5~8.5[5],由图2b所示,以硝酸钠为氮源,其pH值的变化处于适宜范围内,这也可能是硝酸钠实验组优于其他的原因之一。以碳酸氢铵为氮源时,pH一直处于增长状态,超过色绿藻生长的pH范围,不利于藻细胞生长,不适宜作为色绿藻的氮源,且碳酸氢铵极不稳定受热遇光分解。其他三组实验的pH变化处于先降低后趋于稳定,这可能由于此时光合作用变化的影响,光合作用减弱会引起藻类pH降低,而且三者的pH的变化范围低于色绿藻生长的pH范围,这也是其生物量浓度相对较低的原因之一。
如图1a所示,色绿藻前6 d生长速率较快,在第6 d之后生长基本趋于稳定。王天鹏等人研究了异养、混养条件下色绿藻的生长变化,与本实验研究结果基本一致[6]。
培养结束时干重得率如表1所示,由统计检验得到,硝酸钠组与酵母膏组的干重得率无显著性差异,但是硝酸钠组与其他组有极显著差异(p<0.05),结合图2a,实验结果表明,以硝酸钠为氮源的条件下,色绿藻能够获得更高的生物量浓度。综上,最适宜色绿藻生长的氮源为硝酸钠,其次是酵母膏、尿素、胰蛋白胨,而碳酸氢铵不利于色绿藻的生长。
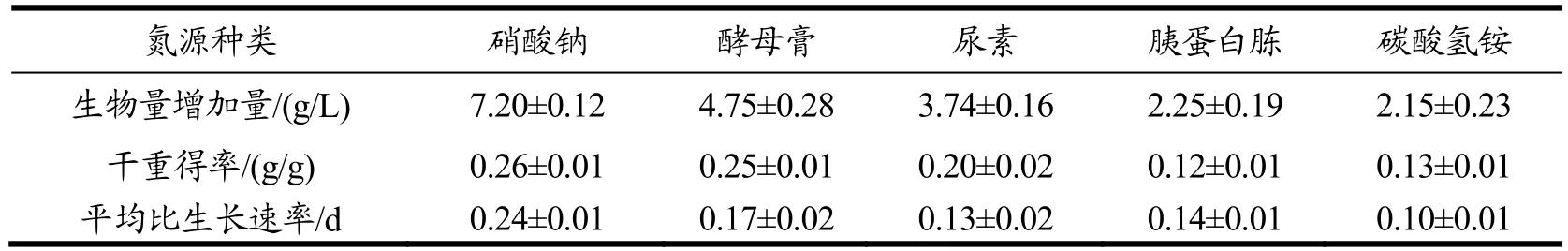
表1 不同氮源种类条件下的色绿藻干重得率及平均比生长速率Table 1 Yield ratios of biomass to glucose and specific growth rate of C. zofingiensis in the cultures with different nitrogen sources
2.1.2 不同氮源条件下对色绿藻积累色素的影响

图3 色绿藻培养过程中的颜色变化Fig.3 Color changes of C. zofingiensis during different culture stages
色绿藻含有叶绿素a和叶绿素b,合成并积累初级类胡萝卜素(如β-类胡萝卜素、叶黄素等)以及次级类胡萝卜素色绿藻(如虾青素、角黄素等),研究表明,色绿藻在绿色细胞阶段主要以叶绿素a、叶绿素b、叶黄素为主[13],而虾青素则在红色细胞阶段积累含量较高。本实验培养期间藻细胞的变化如图3所示。不同氮源条件下对色绿藻积累虾青素及其他色素的影响如图4a所示。

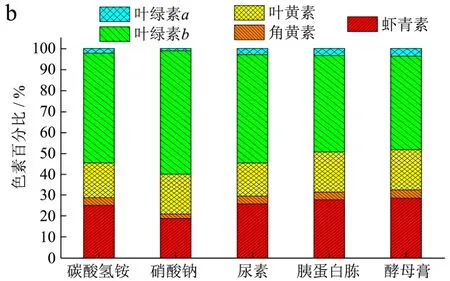
图4 不同氮源种类对色绿藻色素含量(a)及色素所占百分比(b)的影响Fig.4 Effects of different nitrogen sources on the pigment accumulation(a)and percent of pigments(b)of C. zofingiensis
由图4可知,虾青素的含量由高至低依次为胰蛋白胨>硝酸钠≈酵母膏≈尿素>碳酸氢铵,其中胰蛋白胨组虾青素含量最高可达到2.24 mg/g,产量可达16.13 mg/L(如表2所示),虾青素所占总类胡萝卜色素比例为 60.78%;而硝酸钠组虾青素组含量最高可达到1.34 mg/g,产量可达12.38 mg/L,虾青素所占总类胡萝卜素的比例为46.94%。如图4a、4b所示,培养结束时,色绿藻虽为红色细胞状态(如图3所示),但是其积累的色素仍以叶绿素(包括叶绿素a、叶绿素b)为主,五组实验叶绿素占总色素含量的50%以上,其中硝酸钠组叶绿素所占比例最大约为60%,而此时虾青素所占总色素的19.30%,刘学铭等[14]人研究表明随着叶绿素含量增加,生长速度加快,最终生物量与叶绿素含量呈现正相关。这也是硝酸钠组生物量远高于其他组的原因之一。以硝酸钠、胰蛋白胨为氮源时,叶黄素含量较高,且无显著相差异,其中以硝酸钠为氮源时,叶黄素含量可达到 1.37 mg/g,产量最高为12.64 mg/L,且叶黄素的含量约占总色素含量的19.10%。五组实验条件下,角黄素的含量均相对较少,其占总色素百分比不超过5%,如图4b所示。
不同氮源种类条件下,色素含量从高至低依次为叶绿素、虾青素、叶黄素、角黄素,而角黄素含量最少。综上,以胰蛋白胨为氮源时,色绿藻积累虾青素含量最高为2.24 mg/g,但是生物量浓度为7.20 g/L;以硝酸钠为氮源时,色绿藻积累虾青素的含量为1.34 mg/g,占总类胡萝卜素的46.94%,但生物量浓度最高为9.23 g/L;而以碳酸氢铵为氮源时,几种色素含量均是较少,且生物量亦是最少,因此碳酸氢铵不利于色绿藻的生长以及色素的积累。

表2 不同氮源种类条件下色绿藻的色素产量、产率及虾青素所占总类胡萝卜素的百分比Table 2 Pigment yield, productivity and percentage of astaxanthin in total carotenoids of C. zofingiensis in the cultures with different nitrogen sources
2.2 不同葡萄糖浓度以及碳氮比对色绿藻生物量以及色素积累的影响
2.2.1 不同碳氮比对色绿藻生物量浓度的影响
不同碳氮比对色绿藻生物量的影响如图5a所示,实验结果表明在碳氮比不同的情况下,随着碳氮比的降低,色绿藻的生物量浓度呈现先升高后降低,葡萄糖的消耗量逐渐降低(如图 5b所示),碳氮比为 22时,生物量浓度为8.08 g/L,剩余葡萄糖浓度是最低即是对葡萄糖利用率较高,但总氮的利用率显著低于其他两组(p<0.05)。
当碳氮比为42时,生物量浓度最低为5.70 g/L。当碳氮比为34时,生物量浓度为8.35 g/L且对总氮的利用率显著较高。
综上,当碳氮比高于34时,生物量浓度会显著降低(p<0.05),培养基中剩余葡萄糖浓度会随着碳氮比升高而增加,总氮利用率随着碳氮比的升高呈现先增大后减小。


图5 不同碳氮比条件下色绿藻的生物量(a)、葡萄糖的剩余量(b)及总氮利用率(c)Fig.5 Biomass concentrations(a), residue glucose concentrations(b) and total nitrogen utilization (c) of C.zofingiensis in the cultures with different C/N ratios
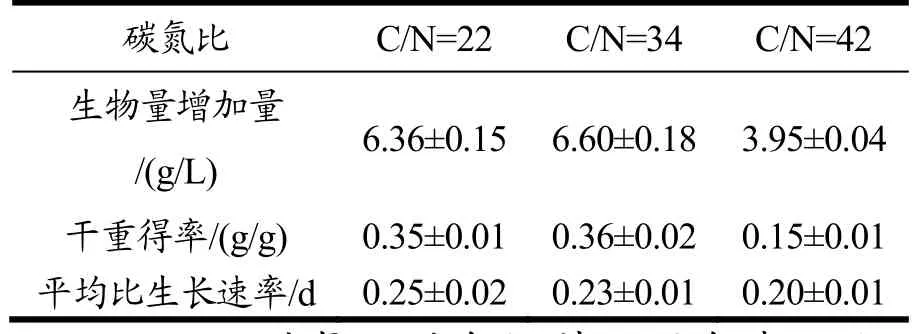
表3 不同碳氮比条件下的色绿藻干重得率及平均比生长速率Table 3 Yields of biomass to glucose and specific growth rate ofC. zofingiensis in the cultures with C/N ratios sources
2.2.2 不同低碳氮比对色绿藻积累色素的影响
不同碳氮比对色绿藻积累色素的影响如上图6所示,如图6a所示,随着碳氮比的升高,虾青素含量升高,所占总类胡萝卜素的百分比逐渐升高。当碳氮比为22时,虾青素含量最低,所占总色素百分比也是最低(如图6b所示),约占总类胡萝卜素的35.10%,产量为5.72 mg/L,而当碳氮比为34时,积累的虾青素约占总类胡萝卜的40.53%,产量为7.64 mg/L。碳氮比为 42时,积累的虾青素约占总类胡萝卜素的58.38%,产量为6.62 mg/L。结合图5、表4,实验结果表明,在本实验条件下,随着碳氮比的升高,虾青素含量逐渐升高,虾青素占总类胡萝卜素的百分比也逐渐升高。

图6 不同碳氮比对色绿藻色素含量(a)及色素所占总色素百分比(b)的影响Fig.6 Effects of different C/N ratios on the pigment accumulation(a) and pigment percentage(b) of C. zofingiensis under different C/N ratios and glucose concentrations
综上,本实验研究不同低碳氮比对色绿藻生物量浓度和积累色素的影响,考虑到后续高密度快速扩种和虾青素积累的户外大规格培养实验,因此,此阶段的重要技术指标为生物量浓度、剩余葡萄糖浓度、氮源浓度。因为葡萄糖的剩余会影响后续户外培养引起染菌,而总氮余量过高会影响后续的诱导积累虾青素。因此选用碳氮比为22和34为最优选择,由于葡萄糖浓度、接种状态影响等的影响,二者的生物量浓度并不很高,因此会在后续试验中针对这两种碳氮比条件下的不同葡萄糖浓度进行进一步优化筛选。
2.2.3 不同葡萄糖浓度以及碳氮比对色绿藻生物量浓度的影响


图7 不同葡萄糖浓度和碳氮比条件下色绿藻的生物量(a)、葡萄糖的消耗状况(b)、细胞数的变化曲线(c)及总氮利用率(d)Fig.7 Biomass concentrations(a), glucose concentrations(b), cell densities (c) and total nitrogen utilization (d) of C. zofingiensis in the cultures with different glucose concentrations and C/N ratios
上述低碳氮比试验证明低碳氮比利于生物量浓度的增加,由于后续高密度快速扩种扩大要求,因此要对上步筛选碳氮比进行进一步的优化筛选,以期获得较高的生物量的浓度,同时培养结束时剩余葡萄糖浓度较低。不同葡萄糖浓度以及碳氮比对色绿藻生物量浓度以及葡萄糖消耗的影响如图7所示。在细胞生长延滞期,六组实验条件下的色绿藻对葡萄糖的消耗速率基本一致。进入对数期后,在同一碳氮比的条件下,当碳氮比为34时,初始葡萄糖浓度为30 g/L在第8 d消耗完全;当碳氮比为22时,初始葡萄糖浓度分别为20 g/L和10 g/L,两组的葡萄糖消耗也是在第6 d耗尽,而初始葡萄糖浓度为30 g/L一组在第8 d葡萄糖依然有剩余(7.34 g/L)。如表5所示,利用SPSS分析数据,六种实验条件下的干重得率无显著性差异,但是当碳氮比34,葡萄糖浓度为30 g/L一组平均比生长速率有显著性差异(p<0.05)同时获得较高生物量(11.28 g/L),可能由于在此条件下色绿藻对葡萄糖的利用率更高。结合图7a,实验结果表明,在本实验条件下,当碳氮比相同时,色绿藻生物量浓度随着初始葡萄糖浓度的增加而增加且在初始葡萄糖浓度为30 g/L时,生物量浓度达到最大,与Po-Fung Ip等人研究结果类似[7,15]。
如图7c所示,不同实验条件下的细胞数变化曲线如图所示,生物量浓度最大的两组即是实验条件分别为碳氮比为22,葡萄糖浓度为30 g/L和碳氮比为34,葡萄糖浓度为30 g/L的两组,但其细胞数均是相对较少。培养结束时,实验条件分别为碳氮比为22,葡萄糖浓度为10 g/L和碳氮比为34,葡萄糖浓度为10 g/L的两组处于绿色细胞状态;而实验条件分别为碳氮比为22,葡萄糖浓度为20 g/L和碳氮比为34,葡萄糖浓度为20 g/L组处于黄绿色细胞状态;实验条件分别为碳氮比为22,葡萄糖浓度为30 g/L和碳氮比为34,葡萄糖浓度为30 g/L的两组则是处于红色细胞状态,而培养过程中细胞颜色的变化主要由于次级类胡萝卜素特别是虾青素的合成与积累,这与雨生红球藻培养过程中颜色变化类似[15~17]。研究报道色绿藻培养过程中红色细胞体积大于绿色状态的细胞,这也可能是在实验条件均为葡萄糖浓度为30 g/L,碳氮比不同的两组虽然细胞数少但生物量浓度却很大的原因之一[6]。
在不同葡萄糖浓度以及碳氮比的情况下,在培养结束时色绿藻的生物量浓度如图7a所示,在实验条件为碳氮比为34,葡萄糖浓度为30 g/L时,色绿藻生物量浓度最大,可达到11.28 g/L,而Po-Fung Ip等[15]人研究在混养条件下,葡萄糖浓度为30 g/L时生物量最高达到9.45 g/L。利用SPSS分析,碳氮比为34,葡萄糖浓度为30 g/L一组的生物量显著优于其他各组(p<0.05),总氮利用率显著优于碳氮比为 22,葡萄糖浓度为30 g/L一组(p<0.05),结果表明,当葡萄糖浓度分别为20 g/L和10 g/L时,在本实验条件下,同一葡萄糖浓度下,不同碳氮比对色绿藻生物量的影响无显著性差异;在葡萄糖浓度为30 g/L时,不同碳氮比对色绿藻生物量的影响有显著性差异(p<0.05),且葡萄糖浓度为30 g/L、碳氮比为34组条件下的生物量浓度最高为11.28 g/L,此时其总氮利用率为 97.37%(如图7d所示),平均比生长速率是碳氮比为22、葡萄糖浓度为30 g/L组的1.2倍、葡萄糖浓度为20 g/L条件下的两组的1.23倍,是葡萄糖浓度为10 g/L条件下的两组的1.85倍。
综上,色绿藻在碳氮比为34,葡萄糖浓度为30 g/L实验条件下生长最优,其生物量浓度达到最大(11.28 g/L),较低碳比优化试验中,生物量浓度提高了35%,平均比生长速率亦是最大(0.32/d)且此条件下色绿藻能够更好的利用葡萄糖以及氮源。

表4 不同碳氮比条件下色绿藻的色素产量、产率及虾青素所占总类胡萝卜素的百分比Table 4 Pigment yield, productivity and percentage of astaxanthin in total carotenoids of C. zofingiensis in the cultures with different C/N ratios
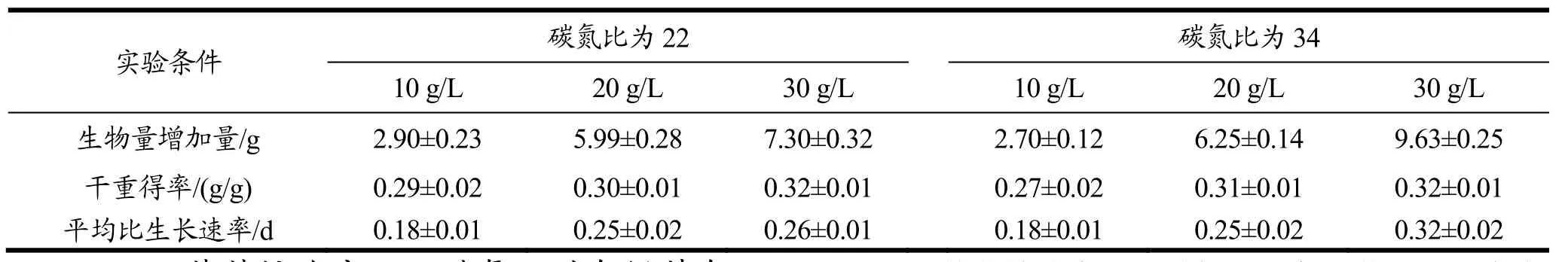
表5 不同碳氮比以及不同葡萄糖浓度条件下色绿藻的干重得率及平均比生长速率Table 5 Yield ratios of biomass to glucose and specific growth rate of C. zofingiensis in the cultures with different under different C/N ratios and glucose concentrations
2.2.4 不同葡萄糖浓度以及碳氮比对色绿藻色素积累的影响

图8 不同葡萄糖浓度以及碳氮比对色绿藻色素含量(a)及色素所占总色素百分比(b)的影响Fig.8 Effects of different C/N ratios on the pigment accumulation(a) and pigment percentage(b) of C. zofingiensis.in the cultures with different glucose concentrations and C/N ratios
不同葡萄糖浓度以及碳氮比对色绿藻积累虾青素及其他色素的影响如图8所示,相同葡萄糖浓度下,碳氮比越高,虾青素含量越高;相同碳氮比条件下,葡萄糖浓度越高,虾青素含量越高且在葡萄糖浓度为30 g/L时最大。如表6所示,随着葡萄糖浓度的增加,当碳氮比为22时,虾青素含量最高达到1.89 mg/g,产量能达到16.89 mg/L产率为2.11 mg/L/d,其中虾青素占总类胡萝卜素比例的57.56%;当碳氮比为34时,虾青素含量最高达到 1.93 mg/g,产量能达到 21.77 mg/L,产率能达到2.74 mg/L/d,其中虾青素占总类胡萝卜素比例的52.71%;同一葡萄糖浓度下,碳氮比越高,虾青素含量越高;实验结果表明在本实验条件下,提高葡萄糖的浓度能够促进色绿藻积累虾青素。与Po-Fung Ip等[7]人研究色绿藻积累虾青素的研究结果类似。结合图7c,实验结果表明:培养结束后,细胞数越少,而虾青素含量反而越高,这与 Zhang等[18]人的研究结果是一致的,其研究表明当细胞开始缓慢裂解时,开始积虾青素。
不同葡萄糖浓度以及碳氮比对色绿藻积累叶黄素、角黄素以及叶绿素的影响如表6所示,同一碳氮比条件下,角黄素的含量均是随着葡萄糖浓度的升高而升高,叶黄素的含量变化则随着葡萄糖浓度的升高而降低。叶黄素含量在葡萄糖浓度为10 g/L时最大且碳氮比为22时,叶黄素最大可达到2.56 mg/g,此时产量最高可达到11.40 mg/L,占总色素的32.39%。而角黄素含量则是最少,最大值为0.42 mg/g。研究报道氮是组成叶绿素的基本元素,同时氮含量不足会阻碍细胞内蛋白质的合成,从而使得叶绿素下降[19]。同一碳氮比条件下,随着葡萄糖浓度增加,氮含量降低,从而致使叶绿素含量下降。
综上,同一碳氮比条件下,虾青素的含量随着葡萄糖浓度的升高而升高,且当碳氮比为34,葡萄糖浓度为30 g/L时虾青素含量最高为1.93 mg/g,且生物量浓度最高为11.28 g/L,虾青素产量亦是最高为21.77 mg/L。这为后续实现色绿藻的高密快速扩种以及虾青素积累的户外大规格培养实验提供了良好的基础。

表6 不同葡萄浓度和碳氮比条件下的色绿藻色素产量、产率及虾青素所占总类胡萝卜素的百分比Table 6 Pigment yield, productivity and percentage of astaxanthin in total carotenoids of C. zofingiensis in the cultures with different glucose concentration and C/N ratios
3 结论
本实验主要研究了混养条件下,不同氮源种类、葡萄糖浓度、碳氮比对色绿藻生物量浓度以及虾青素积累的影响结果。表明混养条件下,硝酸钠为色绿藻生长所需的最优氮源,其次是酵母膏、尿素、胰蛋白胨,而碳酸氢铵不适合作为培养色绿藻的氮源。同时以硝酸钠为氮源,碳氮比为34,葡萄糖浓度为30 g/L,是色绿藻生长所需的最优条件,此时色绿藻可获得较高的生物量浓度及虾青素产量,同时能够较好的利用葡萄糖,为后续实验包括高密度快速扩种,诱导实验及室外大规模放大实验奠定基础。

