饲粮NDF水平对山羊营养物质表观消化率及瘤胃古菌结构与组成的影响研究
张雪娇,王立志,王之盛,薛 白,彭全辉
(四川农业大学动物营养研究所,成都 611130)
反刍动物瘤胃内生活着大量的细菌、原虫、真菌和古菌等厌氧微生物[1-3],这些微生物与它们的宿主之间是一种互利互惠的共生关系[4-5]。宿主摄入的饲料是这些微生物生长繁殖唯一的营养来源,而微生物将饲料在瘤胃中进行发酵又促进了宿主对日粮中营养素的利用。在反刍动物消化利用饲粮纤维的过程中,瘤胃微生物的作用尤其重要[6]。饲料中的纤维类物质在反刍动物日粮中的比例一般在30%以上,动物自身没有分泌纤维降解酶的能力,它们对日粮纤维的利用完全依赖于瘤胃微生物[7]。
已有的研究表明,瘤胃微生物的结构与组成直接影响宿主利用纤维的能力[8]。就细菌而言,瘤胃中降解纤维的微生物主要有白色瘤胃球菌、黄色瘤胃球菌和产琥珀酸拟杆菌等[9],提高它们在瘤胃中的相对丰度能显著提高饲料纤维的消化率[10]。疣微菌科的细菌与纤维代谢的关系也非常密切,这类菌瘤胃数量的减少会导致日粮纤维消化率的显著降低[11]。栖瘤胃普雷沃氏菌虽不能直接降解纤维素,但是它能够通过与黄色瘤胃球菌、溶纤维丁酸弧菌这类纤维分解菌共生,从而提高日粮中纤维素的降解[12]。但反之,目前人们对于日粮纤维水平对瘤胃微生物,尤其是对山羊瘤胃古菌结构与组成的影响了解还很少。这方面知识的缺乏,限制了人们对宿主与瘤胃微生物互作关系的理解。针对这一问题,本试验以山羊为试验动物,采用高通量测序技术主要研究了饲粮NDF水平对山羊营养物质表观消化率及瘤胃古菌的影响。
1 材料和方法
1.1 试验设计
本试验采用3×3拉丁方设计,按照日粮NDF浓度设3个处理组,将山羊生产中常用日粮的NDF浓度设为中浓度组(MN组∶NDF值=40.10%),在此基础上将日粮NDF水平增加或减少5%,即高浓度NDF水平组(HN组∶NDF=45.16%)和低浓度组(LN组∶NDF值=35.01%)。试验动物为6只8月龄健康雄性山羊,平均体重为(28.33±3.77)kg。日粮配方参照中国肉羊饲养标准(2004)以每天每头羊增重0.1 kg进行配制(表1)。将6只山羊按照两两一组分成3组,分3期进行代谢试验。每期试验为期20 d,其中前14 d为预试期,后6 d为正试期。每期试验均有2头羊饲喂3个处理组中的一组日粮。
1.2 饲养管理
试验羊在全期单笼饲养,自由饮水。根据预试期动物的采食量,正试期每天每只羊饲喂由粗料和精料组成的全混合日粮1.2 kg,分别于每日09:00及17:00分两次进行等量饲喂。记录每天每头羊的饲料供给量和余料量。
1.3 样品采集
在正试期收集每只羊每天排泄的全部粪便和尿液,加10%的盐酸固氮,-20℃低温冰箱中保存备用。每组羊在每期代谢试验结束后的次日晨饲后两小时抽取50 mL瘤胃内容物,具体步骤参照王立志等[13]描述的方法进行。将得到的瘤胃内容物装入充满氮气的集气袋中,置于冰上,反复拍打以确保和固相结合的微生物能充分进入瘤胃液中,然后再用4层纱布过滤得到瘤胃液,-80℃超低温冰箱中保存,用于后续瘤胃液微生物DNA的提取。

表1 饲粮组成及营养水平(干物质基础)Table1 Composition and nutrient levels of experimental diets(basis on DM)
1.4 饲料、粪尿指标检测
饲料中的干物质(DM)、有机物(OM)、粗蛋白(CP)、粗脂肪(EE)、粗灰分(Ash)、NDF及粪氮和尿氮等常规营养成分均参照《饲料分析及饲料质量检测技术》中方法进行测定[14]。饲料、粪尿中能量采用氧弹测热仪(Parr 1281,America)测定。
1.5 微生物总DNA的提取和高通量测序
瘤胃液微生物总DNA的提取:用天根生化科技(北京)有限公司生产的粪便基因组DNA提取试剂盒,按说明书介绍的步骤提取。以提取的瘤胃微生物总DNA为模板,采用古菌的特异性引物对(Arch519F和Arch915R),针对古菌16S rRNA的V4+V5区进行PCR扩增。具体扩增步骤参照文献[15-16]描述的方法进行。检测合格的扩增产物送北京诺禾致源生物科技有限公司用IlluminaHiSeq 250 PE平台进行高通量测序。
1.6 生物信息学分析
将测序所得reads使用FLASH软件进行双端merge后,用QIIME软件按照barcode序列进行不同样品的区分,去除低质量序列得到有效序列。去低质量序列标准如下:去除所有含有N的reads;去除含有连续3个小于Q20碱基的reads;去除与barcode序列不一致的reads;去除连续Q20碱基长度小于序列总长75%的reads。使用UCLUST[17]软件对有效序列进行聚类,根据相似性≥97%将序列聚类成为OTUs(operational taxonomic units),并挑选丰度最高的序列作为OUT的代表性序列;使用QIIME软件将OTU代表序列与古菌的SILVALVA(http://www.arb-silva.de/)的SSUrRNA数据库[18]进行比对,然后用Mothur方法对古菌的代表序列进行物种注释分析(阈值设定在0.8~1之间),统计每个样品在各分类水平上(门,纲,目,科,属)的构成;采用QIIME软件(Version 1.7.0)计算各个样品Alpha多样性指数(Shannon 指数、ChaoI指数、The_observed_species指数)并做rarefaction分析,利用R语言工具[19]绘制稀释曲线。
1.7 数据统计分析
试验结果用一般线性模型Yij(k)=μ+αi+βj+γ(k)+εij(k)(i=j=k=1,2,3)表示,其中Y为某指标的观测值,μ为试验全部观测值总体平均数;α,β,γ分别为本研究中试验期、羊组别和日粮NDF水平,ε为随机误差。用SPSS 21.0软件中的ANOVA模块用以NDF水平为主要影响因素,且与其他两种影响因素无互作效应的方法对处理组间观测值平均数(μ)进行差异显著性检验,并用邓肯法进行多重比较;同时,用日粮NDF水平对瘤胃古菌属的相对丰度进行Pearson相关分析。试验结果以平均值±标准差表示。以P<0.05表示显著,P<0.01为极显著。
2 结果与分析
2.1 饲粮NDF水平对山羊生长性能的影响
从表2可看出,处理间山羊的IBM、FBW均无显著差异(P>0.05)。LN组的 ADG显著(P<0.05)高于HN组,但LN组与MN组的差异不显著(P>0.05)。DMI有随日粮NDF水平的升高而降低的趋势,但3组间差异不显著(P>0.05)。LN组和MN组的料重比显著低于HN组(P<0.05),但LN组和MN组的差异不显著(P>0.05)。
2.2 饲粮NDF水平对山羊营养物质表观消化率的影响
从表3可以看出,处理组间山羊日粮DM、OM、CP表观消化率差异均不显著(P>0.05);LN组EE的表观消化率显著高于MN组和HN组(P<0.05);HN组NDF的表观消化率显著高于LN组和MN组(P<0.05)。
2.3 饲粮NDF水平对山羊瘤胃古菌结构与组成的影响
2.3.1 各样品测序深度和OTU数量分析
本次测序总共得到1 002 079条有效序列(Clean Data),每个样品的平均序列数为334 026±15 321,按照相似性≥97%的标准把得到的有效序列进行聚类,共得到6 997个OTUs,每个样品的平均OTUs数为2 332.3±453.5,3个处理组间共享OTUs数为441个,LN组与MN组间共享OTUs数为554个,LN组与HN组间共享OTUs数为523个,MN组与HN组间共享OTUs数为453个(图1)。
2.3.2 OTU稀释曲线
各样品的OTU稀释曲线见图2。由图2可看出,在本次研究的测序深度下(reads:47 650)各样品的稀疏曲线最终都趋于平缓。说明本次研究采用的测序技术基本可以覆盖样品中绝大多数微生物。
2.3.3 Alpha多样性指数
本试验利用QIIMEPipeline在取样深度为47 650时对3个处理组瘤胃液样的Alpha多样性指数进行了比较分析(表4)。从表4可看出,LN组Chao l指数、Shannon指数和Observed species指数值显著(P<0.05)高于MN组和HN组,MN组和HN组间的差异不显著,说明LN组山羊瘤胃内微生物菌群的丰富度和均匀度均最高。

表2 饲粮NDF水平对山羊生长性能的影响Table2 Effects of dietary NDF levels on growth performance of goats

表3 饲粮NDF水平对山羊营养物质表观消化率的影响Table3 Effects of dietary NDF levels on apparent digestibility of dietary nutrients in goats %

图1 OTU维恩图Figure1 OTU Venn diagram

图2 OTU稀释曲线Figure2 The OTU rarefaction curves across all samples
经过物种注释和统计,本次测序的古菌共可分为3个门,5个纲,5个目,5个科,7个属。在门水平上,所有物种的相对丰度在3个处理组间差异均不显著(P<0.05)。广古菌门(Euryarchaeota)在3个处理组中均为优势古菌门,平均相对丰度达(99.99±0.01)%。
各样品在属水平上的物种组成见图3。3个处理组的前3个优势古菌属均依次分别为Methanobrevibacter、Candidatus_Methanomethylophilus和Candidatus_Methanoplasma。其他各属的相对丰度都在1%以下。Methanobrevibacter的相对丰度呈现随日粮NDF水平的升高而增加的变化规律,且LN组与其他两组的差异达到了极显著的水平(P<0.01),其他两组间无显著差异(P>0.05);Candidatus_Methanomethy-lophilus和Candidatus_Methanoplasma的相对丰度随NDF水平的升高呈降低的变化规律,且LN组显著高于其他两组(P<0.05)(表 5),其他古菌属两组间无显著差异(P>0.05);其余各菌属的相对丰度在3个处理组间差异均不显著(P>0.05)。用组间具有显著差异古菌属的相对丰度与日粮NDF浓度进行相关性分析,结果表明,日粮NDF浓度与Candidatus_Methanomethylophilus和Candidatus_Methanoplasma之间没有显著相关性,只与Methanobrevibacter呈极显著正相关(表5)。

表4 在取样深度为47 650时各组α多样性指数的对比Table4 Comparison of alpha diversity of each group calculated at a depth of 47 650 sequences

图3 各个样品瘤胃古菌在属水平上的物种组成Figure3 The composition of rumen archaeal at the genus level across all samples
2.3.4 共享属分析
3个处理组共享的古菌属只有4个,按照菌群相对丰度的高低依次是产甲Methanobrevibacter(74.86±19.86)%,Candidatus_Methanomethylophilus(17.20±9.27)%、Candidatus_Methanoplasma(6.74±10.38)%和 Methanosphaera(0.22±0.07)%。其中,Methanobrevibacter和Candidatus_Methanomethylophilus均为3个处理组的优势核心菌群且都属于广古菌门(Euryarchaeota)。
3 讨论
3.1 饲粮NDF水平对营养物质表观消化率的影响
许多研究都已报道并证明了日粮NDF水平会影响动物日粮的营养物质表观消化率。张立涛等[20]研究表明,随着日粮NDF水平的升高,DM、OM、EE的表观消化率会逐渐降低,并呈现显著性差异。本试验研究表明,LN组的EE表观消化率显著高于MN和HN组,与上述研究结果一致。但本试验中DM和OM表观消化率并未随日粮NDF水平的升高而显著降低,这可能与羊的品种以及饲粮的组成成分的差异有关。周汉林等[21]研究公牛日粮NDF水平在30%~42%之间变化时发现,NDF的表观消化率随NDF水平的升高而升高。K.E.Tjardes等[22]研究表明,与低纤维组相比,高纤维浓度组的奶牛日粮NDF消化率增加了9.4%。孔祥浩等[23]的研究也发现了这种变化规律,这与本试验结果一致。这些试验说明,在一定范围内提高日粮NDF水平,可以提高动物对NDF消化率。理论上分析,随着日粮某种营养素含量的增加,其消化率会随之降低。本试验中CF和NDF的消化率之所以会随其日粮浓度的增加而增加,一方面可能是HN组山羊在采食高NDF水平日粮后,瘤胃排空速度减慢致使食糜在瘤胃内的停留时间延长,这样就使得瘤胃有充分的时间对日粮中CF和NDF进行消化,导致CF和NDF的消化率提高;另一方面从微生物角度来讲,可能是HN组山羊采食高NDF水平日粮,由于底物浓度的增加,在底物诱导效应的作用下,瘤胃内一些能够降解纤维的菌群如瘤胃球菌、溶纤维丁酸弧菌的相对丰度增加(本课题组待发表数据),促进了纤维在瘤胃内的消化,从而使HN组山羊的CF和NDF表观消化率显著高于其他两组。
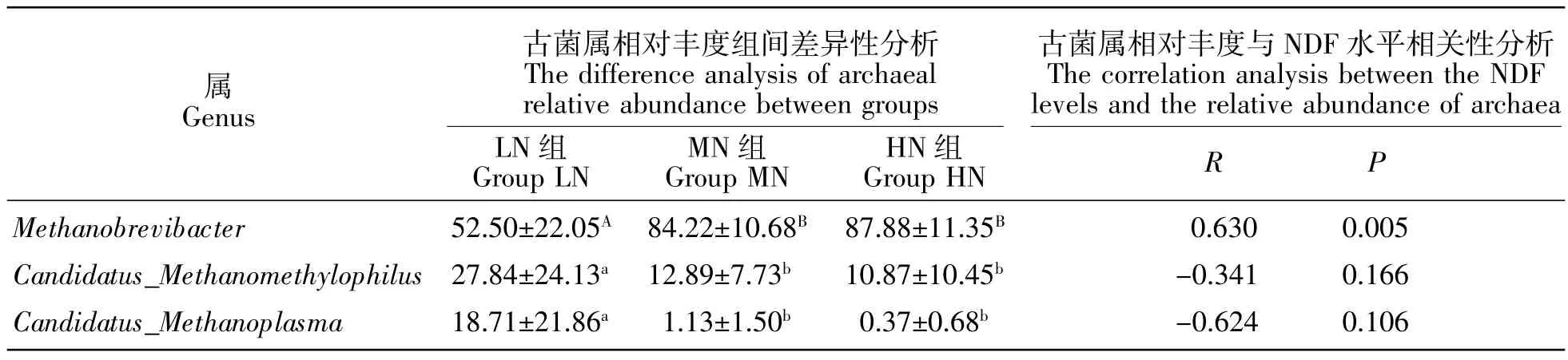
表5 处理组间存在显著差异的古菌属及其与NDF消化率的相关性Table5 The archaeal genera which were significantly different between groups and their correlation with NDF digestibility
3.2 饲粮NDF水平对山羊瘤胃古菌结构与组成的影响
饲粮NDF水平不仅显著影响山羊瘤胃细菌菌群的结构与组成,本试验表明其对山羊瘤胃古菌菌群也会产生显著影响。截至目前,有关NDF水平对瘤胃古菌的影响还未见他人的研究报道,相近的研究主要集中在日粮类型对产甲烷古菌的影响上。Lin C.等[24]证实日粮类型对山羊和牛等瘤胃产甲烷菌群有很大影响,日粮由低精料转变为高精料时,瘤胃内的优势产甲烷菌由产甲烷杆菌目转变为产甲烷微菌目。A.D.Wright等[25]先后分别研究了饲喂不同粗饲料来源的日粮时绵羊和牛瘤胃内古菌的多样性,结果发现以绵羊为研究对象时,不论是在以完全放牧为日粮还是以燕麦-干草和盖氏虎尾干草为基础日粮时,绵羊瘤胃中的优势古菌均是甲烷短杆菌;但以牛为研究对象时,给动物饲喂紫花苜蓿干草为主的日粮,牛瘤胃中的优势古菌主要是可活动的甲烷微菌,其次是甲烷短杆菌。
目前有许多研究学者通过对瘤胃内微生物16S rRNA基因序列的研究发现,瘤胃内古菌占到了瘤胃微生物的0.3%~3.3%[26],主要以产甲烷菌为主,均属于广古菌门[27]。本次研究也发现山羊瘤胃中广古菌门是优势古菌门。但本研究中,3个处理组广古菌门的丰度分别都达到了99%,如此高的相对丰度在以往的研究中还未曾报道过。出现这种结果的原因可能是本次研究所用的引物(瘤胃古菌的特异性引物,Arch519F和Arch915R)和古菌序列比对数据库(瘤胃古菌专用比对数据库,SSUrRNA数据库)与以往研究不同所造成的。本次研究还发现,甲烷短杆菌(Methanobrevibacter)是3个处理组的优势菌属,且LN组该菌的丰度极显著低于其他两组(P<0.01),该菌的丰度随NDF水平的升高呈增加的变化规律。出现以上结果的原因可能与甲烷短杆菌的特性密切相关,该菌是一类典型的氢利用菌。黄色瘤胃球菌和白色瘤胃球菌等在分解纤维的过程中会产生大量氢离子,氢对于绝大多数瘤胃微生物都有生物毒性,高氢分压不利于维持正常的瘤胃微生物生长繁殖。关于甲烷短杆菌的许多研究都表明,其产甲烷的主要发酵底物是H2和CO2,它能将纤维发酵产生的氢合成甲烷后通过嗳气排出瘤胃[28],虽然不利于环保,但对于维持瘤胃中的正常H2分压有着重要的意义[29]。在本试验中,HN组和MN组动物瘤胃内的高纤维含量可能需要更多的甲烷短杆菌来执行对H2的清除作用,因此该菌在LN组极显著低于其他两组。
4 结论
广古菌门是山羊瘤胃优势的古菌。饲粮NDF水平在35%~45%之间变化时,随NDF浓度增加,日粮NDF的表观消化率显著升高,山羊瘤胃古菌在门水平上的结构与组成不会受到显著影响,但属水平上Methanobrevibacter、Candidatus_Methanomethylophilus等古菌的相对丰度会受到显著影响。

