太子参蛋白提取工艺优化及SDS-PAGE分析
晋海军,王海霞,张 涛,向守艳
(贵阳中医学院,贵阳 550025)
太子参(Pseudostellariae Radix)为石竹科植物孩儿参 Pseudostellaria heterophylla(Miq.)Pax ex Pax et Hoffm.的干燥块根,具有益气健脾、生津润肺的功效,用于脾虚体倦、食欲不振、病后虚弱、气阴不足、自汗口渴以及肺燥干咳等症[1]。贵州省施秉县于1992年引种太子参,经过起步、摸索、扩张和发展等阶段,现已形成以太子参为主导品种的中药材生产格局,并跃居成为我国太子参第二大产区[2]。
根据传统的“辨状论质”思想和近几年太子参商品规格等级标准研究进展,太子参的参形是其商品规格等级划分的一个重要量化指标[3-4]。目前尚无有关太子参参形差异形成的研究报道,但有关植物蛋白与根形形成相关的报道较多。R.D.Smith等[5]研究发现蛋白磷酸激酶与拟南芥根毛区细胞生长和根皮层细胞形状形成有关。T.I.Baskin和J.E.Wilson[6]也指出蛋白激酶和磷酸酶与植物根系形态的形成有关。A.Grabov等[7]报道,参与生长素转运、细胞骨架形成的蛋白与植物根形的形成有关。太子参参形的形成,可能也与参与某些细胞代谢通路的关键蛋白有关。因此有必要利用蛋白质组学技术对太子参参形形成的分子机制展开研究。本研究拟通过对不同参形太子参蛋白提取方法的筛选、提取工艺的优化及蛋白条带的分析,为今后在蛋白质组层面揭示不同参形形成的分子机制提供基础资料。
1 材料和方法
1.1 试验仪器与试剂
UPT-II-20T优普UPT系列超纯水器,四川优普超纯科技有限公司;SIM-F124雪花制冰机,北京长流科学仪器有限公司;TOMYEs-315高压蒸汽灭菌锅,日本 TAKARA TOMY股份公司;Centrifuge J810R台式冷冻离心机,德国eppendorf公司;GBC Cintra20/20051254紫外可见分光光度计,澳大利亚GBC科学仪器公司;DYCZ-28A电泳仪,北京市六一仪器厂;XW-80A微型漩涡混合仪,上海驰唐电子有限公司;ME204/02万分之一电子天平,美国梅特勒-托利多公司;BIO-DL移液器,苏州百得实验室仪器有限公司。
预染蛋白质Maker II和SDS-PAGE凝胶试剂盒,武汉博士德生物;0.5 mol/L Tris-HCl(pH 6.8),南宁恒因生物;牛血清蛋白,上海展云化工有限公司;考马斯亮蓝 G250、4%CHAPS和 0.2%Bio-Lyte,美国 Bio-Rad 公司;二硫苏糖醇(DTT)和尿素,美国GE公司;乙二胺四乙酸二钠和十二烷基磺酸钠(SDS),上海申博化工有限公司;无水乙醇,重庆川东化工集团有限公司;甲醇,国药集团化学试剂有限公司;甘氨酸,上海蓝季科技发展有限公司;溴酚蓝,上海三爱思试剂有限公司;乙酸铵,西陇化工股份有限公司;磷酸,重庆川东化工集团有限公司;甘油,上海申博化工有限公司;冰醋酸,西陇化工股份有限公司。
1.2 试验材料
太子参采自贵州施秉县牛大场太子参种植基地,经贵阳中医学院江维克教授鉴定为石竹科植物孩儿参的块根。参照太子参商品规格等级划分[3],太子参参形分为3个等级。一等:长纺锤形(中上部直径≥4.46 mm),单个重量≥0.45 g,直立;二等:长纺锤形(中上部直径3.35~4.45 mm),单个重量0.3~0.44 g,较直立;统货:细长纺锤形或长条形(中上部直径≤3.34 mm),单个重量≤0.29 g,弯曲明显。
1.3 试验方法
1.3.1 蛋白质的提取
采用 Tris-HCl[8-9]、TCA-丙酮法[10-11]和酚抽提法[12-13]提取不同参形太子参的蛋白。
采用Tris-HCl法,取-80℃冰箱冷冻保存的3种参形(一等、二等和统货)太子参块根4.0 g放入研钵中,液氮迅速研磨成粉末,将粉末装入离心管;加入10 mL蛋白质提取缓冲液(65 mmol/L Tris-HCl pH 6.8,0.5%SDS,10%甘油,5% β-巯基乙醇)混匀;将离心管置于冰上10 min左右,每隔2 min震荡一次,确保蛋白粉末与缓冲液充分接触;放入4℃冰箱浸提1 h;4℃,15 000 r/min离心15 min;取蛋白上清液,加入3倍体积-20℃预冷的10%TCA丙酮溶液,充分混匀,置于-20℃冰箱1 h,使蛋白质沉降;4℃,15 000 r/min离心15 min,弃上清;沉淀用预冷丙酮洗涤1次,80%预冷丙酮洗涤2次;4℃,15 000 r/min离心15 min,放于冰上将丙酮自然挥干,置于-20℃冰箱保存备用。
利用TCA-丙酮法,取-80℃冰箱冷冻保存的3种参形太子参块根4.0 g放入研钵,加液氮迅速研成粉末,将粉末装入离心管;加入4 mL预冷的丙酮溶液(含 10%TCA(W/V),0.07% β-巯基乙醇(V/V),混匀后于-20℃下放置2.5 h(其间振荡几次);然后在4℃条件下15 000 r/min离心20 min;弃上清液,用预冷的80%丙酮溶液重悬沉淀,重复以上操作3次,清洗至上清液无色;离心后再用-20℃预冷丙酮重悬沉淀,于-20℃冰箱内静置1 h;4℃条件下15 000 r/min离心30 min,用预冷丙酮重悬沉淀2次,弃上清;沉淀置于冰上,自然挥发干丙酮,置于-20℃冰箱保存备用。
利用酚抽提法,取-80℃冰箱冷冻保存的3种参形太子参块根4.0 g放入研钵中,加入液氮研磨成粉末,将粉末装入离心管中;加入4 mL的饱和酚(pH 8.0,Sigma)和 4 mL 的 SDS(30%蔗糖;2%SDS;0.1 mol/L Tris-HCl,pH8.0;5%的 β-巯基乙醇)缓冲液,振荡 30 s;4 ℃、15 000 r/min,离心 10 min,上层酚相转移到离心管中;加入5倍体积的含有0.1 mol/L乙酸胺的甲醇,混合后在-20℃的条件下沉淀30 min;4 ℃、15 000 r/min,离心 15 min,弃上清;沉淀用冷丙酮漂洗 2次(4 ℃、15 000 r/min,离心 10 min);最后将沉淀置于冰上将丙酮自然挥干,置于-20℃冰箱保存备用。
1.3.2 蛋白质含量测定
将提取的2 mg蛋白干粉加入400 μL裂解液(7 M 尿素,4%CHAPS,2 M 硫脲,0.2%Bio-Lyte和65 mM DTT)中,温控摇床4℃裂解3 h;15 000 g,4℃离心20 min,取上清液即为蛋白样品液。蛋白的定量采用Bradford法[14]。标准蛋白选用牛血清白蛋白(BSA)加入Bradford工作液,测其在595 nm处的吸光值,绘制标准曲线,测量待测样品蛋白的吸光度值,并计算样品蛋白浓度。
1.3.3 蛋白质的SDS-PAGE检测
将Tris-HCl法制备的蛋白干粉室温下用蛋白裂解液(含 100 μmol/L 的 DTT、2%SDS)裂解 1 h,在沸水浴中煮沸5 min,而后进行SDS-PAGE电泳。电泳、染色、脱色、固定采用胡朝敦等[15]的方法。
1.3.4 蛋白提取工艺的响应面优化
选取料液比、提取温度、pH值和提取时间4个因素进行试验,每个因素设计3个水平,用Design Expert V8.0.5b软件的Box-Benhnken试验方案进行响应面优化(见表1)。

表1 Box-Benhnken试验因素水平表Table1 Factors and levels in the Box-Benhnken experimental design
2 结果与分析
2.1 太子参蛋白提取方法筛选
以Tris-HCl、TCA-丙酮法和酚抽提法提取不同参形太子参的蛋白。试验结果显示(见表2)3种植物蛋白提取方法中Tris-HCl法所得蛋白含量较高,TCA/丙酮法次之,酚抽提法得到蛋白含量较低。因此,Tris-HCl法是提取太子参蛋白最佳方法,特别对于一等太子参蛋白的提取效果更佳。
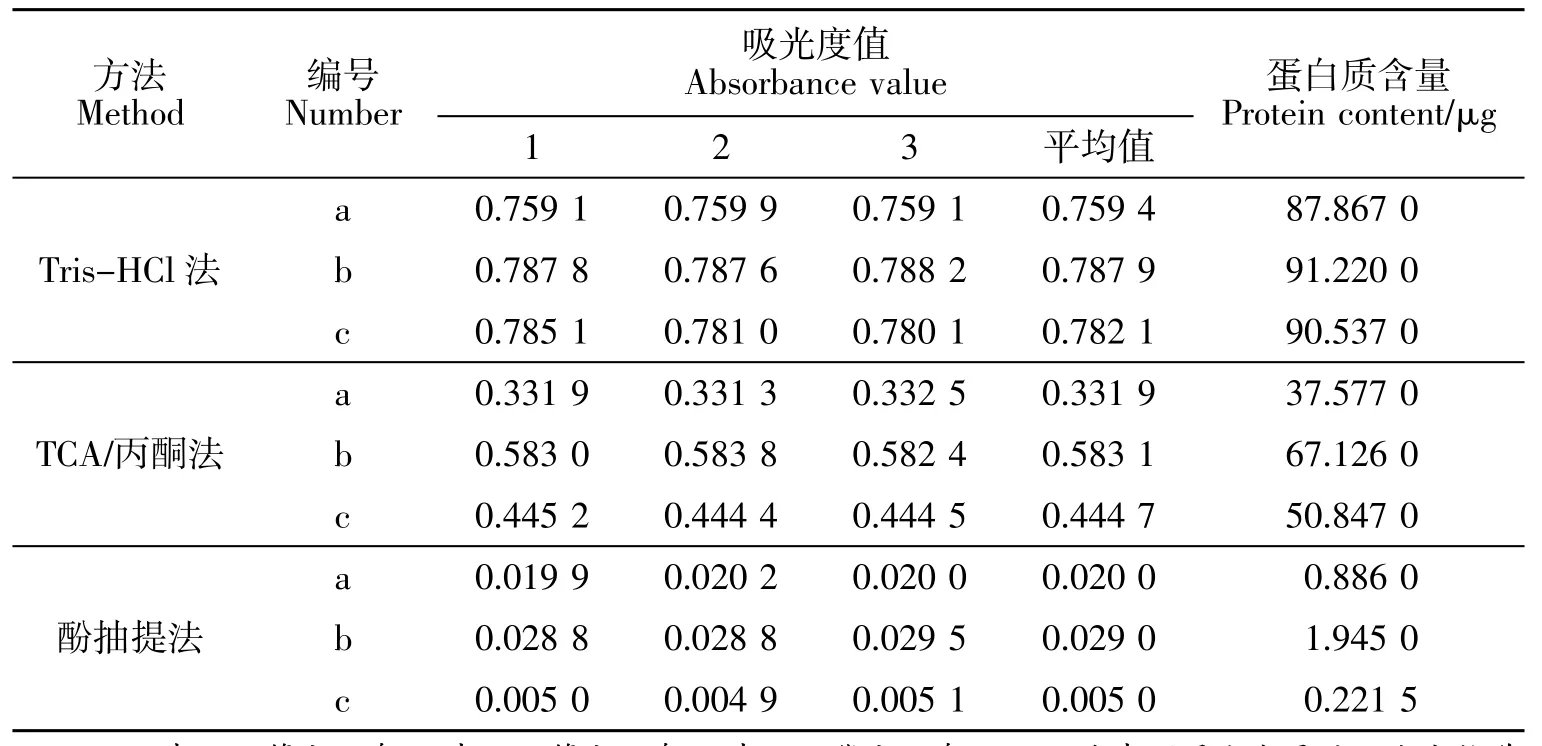
表2 3种方法所提蛋白含量Table2 Protein content for three methods
2.2 太子参蛋白的SDS-PAGE检测分析
由3个等级太子参蛋白SDS-PAGE电泳图(图1)可知,太子参蛋白的分子量大致分布在10 kDa~90 kDa之间,3种等级太子参蛋白条带的分布没有明显差异,但表达量有所区别。一等太子参在15 kDa处的蛋白表达量明显高于其他两个等级太子参,其他分子量的蛋白条带差异不大,唯独此处差异明显,可能此处的蛋白质与不同参形的形成相关。

图1 3个等级太子参蛋白SDS-PAGE电泳图Figure1 SDS-PAGE electrophoresis of three grades of Pseudostellariae Radix protein
2.3 太子参蛋白提取工艺响应面优化
目前,仅有对太子参蛋白提取方法的少量报道[16],尚无对太子参蛋白质提取工艺流程优化的报道。本研究对太子参蛋白提取中筛选的最佳方法Tris-HCl法进行响应面优化实验,依据Box-Benhnken实验原理,响应值为蛋白质定量的吸光度值(OD值),试验方法为4因素(料液比、提取温度、pH值和提取时间)3水平的响应面分析法,24个分析因子(1~24),3个中心试验点(25~27),共有 27个试验点,结果见表3。
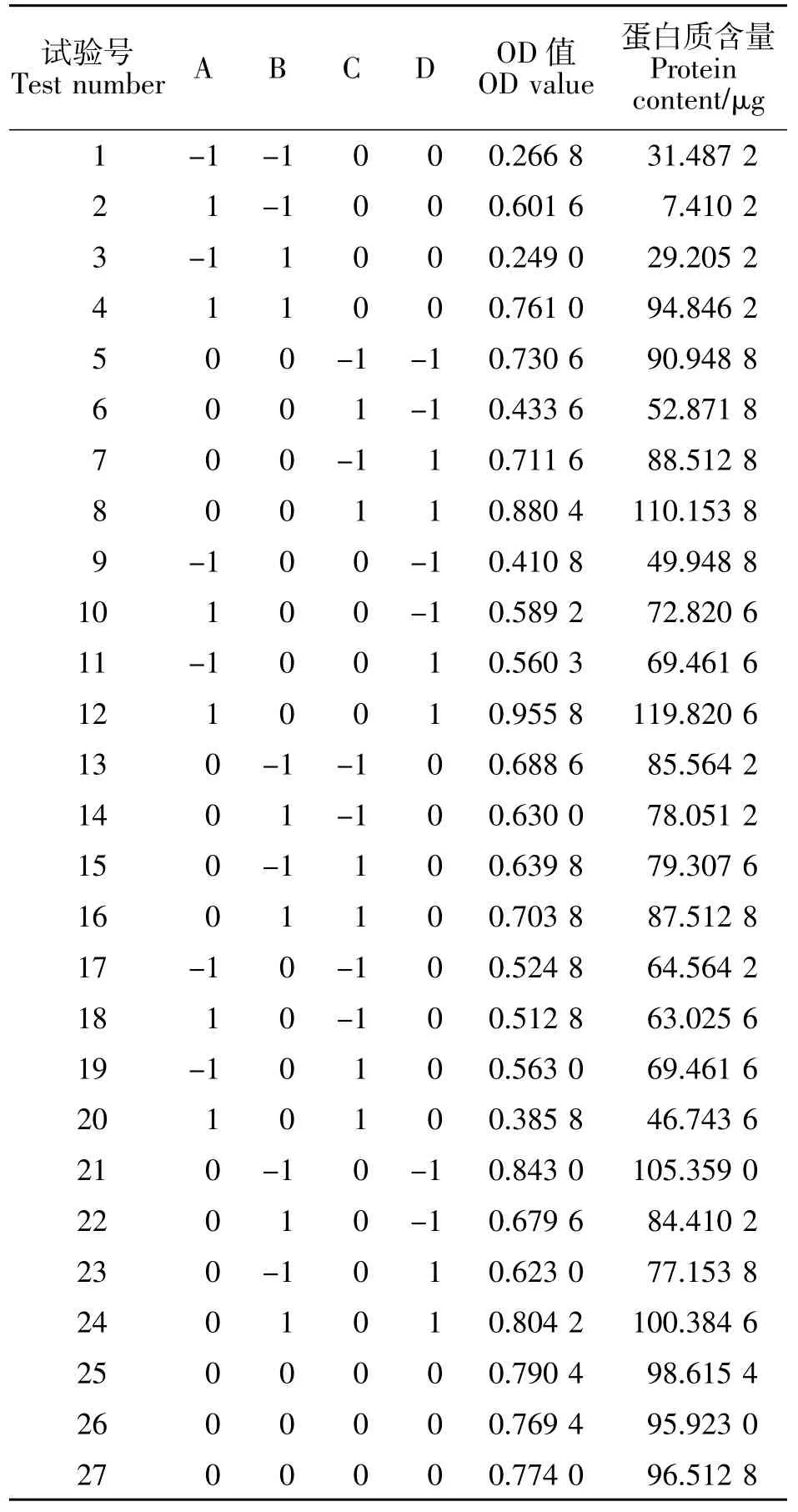
表3 Box-Benhnken试验设计与结果Table3 Box-Benhnken experimental design matrix and results
2.3.1 响应面实验模型的建立与显著性检验
对表3中的数据用Design Expert V 8.0.5b软件进行回归拟合,得吸光度值对4个影响因素的回归方程预测模型:
OD=0.39+0.051A+6.867×10-3B-8.000×10-3C+0.035D+0.022AB-0.021AC+0.027AD+0.015BC+0.043BD+0.058CD-0.10A2-0.034B2-0.040C2+0.011D2。
对此方程进行方差分析,结果如表4所示,预测的回归方程显著性较高,且失拟项不显著(P=0.265>0.05),R2=0.999 2。所以模拟的回归方程具有较高的拟合度与可信度。
2.3.2 响应面分析与优化
响应面曲线图和等高线图是Design Expert V8.0.5b软件根据预测回归方程做出的,可直观反映提取温度、提取时间、料液比和pH值4个因素对吸光度值的影响。响应面曲线图反映了任意两个因素对吸光度值的影响,响应面曲线图所映射的等高线图反映了两个因素之间的相关性,等高线图越接近椭圆形,则两个因素间的相关性越大。如图2中显示,pH值和料液比对吸光度的影响最显著,等高线接近椭圆形,表示温度和料液比具有很大相关性;温度和料液比对吸光度有显著影响,两因素间相关性较大;时间和料液比一定程度上影响着吸光度,两因素间存在一定的相关性但不显著;pH值和温度对吸光度有一定的影响,彼此有一定的相关性但不显著;时间和温度、时间和pH值对吸光度有一定影响,但彼此之间没有相关性。

表4 响应面二次回归方程模型的方差分析Table4 Analysis of variance for each term in the fitted regression model
2.3.3 验证性实验
对预测回归方程求一阶偏导令其为0,得到太子参蛋白的最佳测定条件为:料液比1∶1.32,提取温度25℃,pH值7.47,提取时间1.5 h,预测理论吸光度为0.994 0。用最佳条件对太子参蛋白进行提取,测量吸光度(重复测量3次),结果见表5。吸光度测量值0.983 8与理论值0.994 0之间的相对误差为1.03%,说明Box-Benhnken实验所得最优检测条件准确可靠。
3 讨论与结论
根据太子参商品规格等级划分[3],太子参参形可分为3个等级。目前尚无影响太子参参形的内在分子机制报道,本研究通过筛选太子参蛋白的提取方法及对提取工艺的响应面优化,并对所提不同参形太子参蛋白的SDS-PAGE分析,以期得到太子参蛋白的最佳提取工艺及不同参形太子参蛋白条带差异,为今后在蛋白组层面利用分子植物育种技术选育参形较好的太子参新品种提供基础资料。
本实验用紫外分光光度法,对3种蛋白提取方法(Tris-HCl法、TCA-丙酮法、饱和酚法)所得的不同参形太子参蛋白进行定量,并进行SDS-PAGE检测分析。结果显示,利用Tris-HCl法所提取蛋白质含量较高且蛋白条带清晰。刘杨等[17]也指出,用Tris-HCl法提取黄芪蛋白效果明显优于TCA-丙酮法和饱和酚法。朱燕芳等[18]用Tris-HCl法对地瓜参进行处理,证明Tris-HCl法处理的地瓜参蛋白提取效率最高。与Tris-HCl法相比,TCA-丙酮法需要用80%预冷丙酮和冷丙酮重悬多次,蛋白损失相对较多,导致在SDS-PAGE时即使上样量多于Tris-HCl法,蛋白条带也没有Tris-HCl法清晰;相比之下饱和酚法所提取的蛋白含量较少,原因可能是饱和酚法不适和太子参蛋白的提取。刘楠等[19]利用TCA-丙酮法和饱和酚法提取蒙古沙冬青根蛋白,证明饱和酚法提取蛋白效果最好。可能由于太子参和蒙古沙冬青根中总蛋白成分及含有干扰蛋白提取的成分不同,导致二者选用的蛋白提取方法不同。
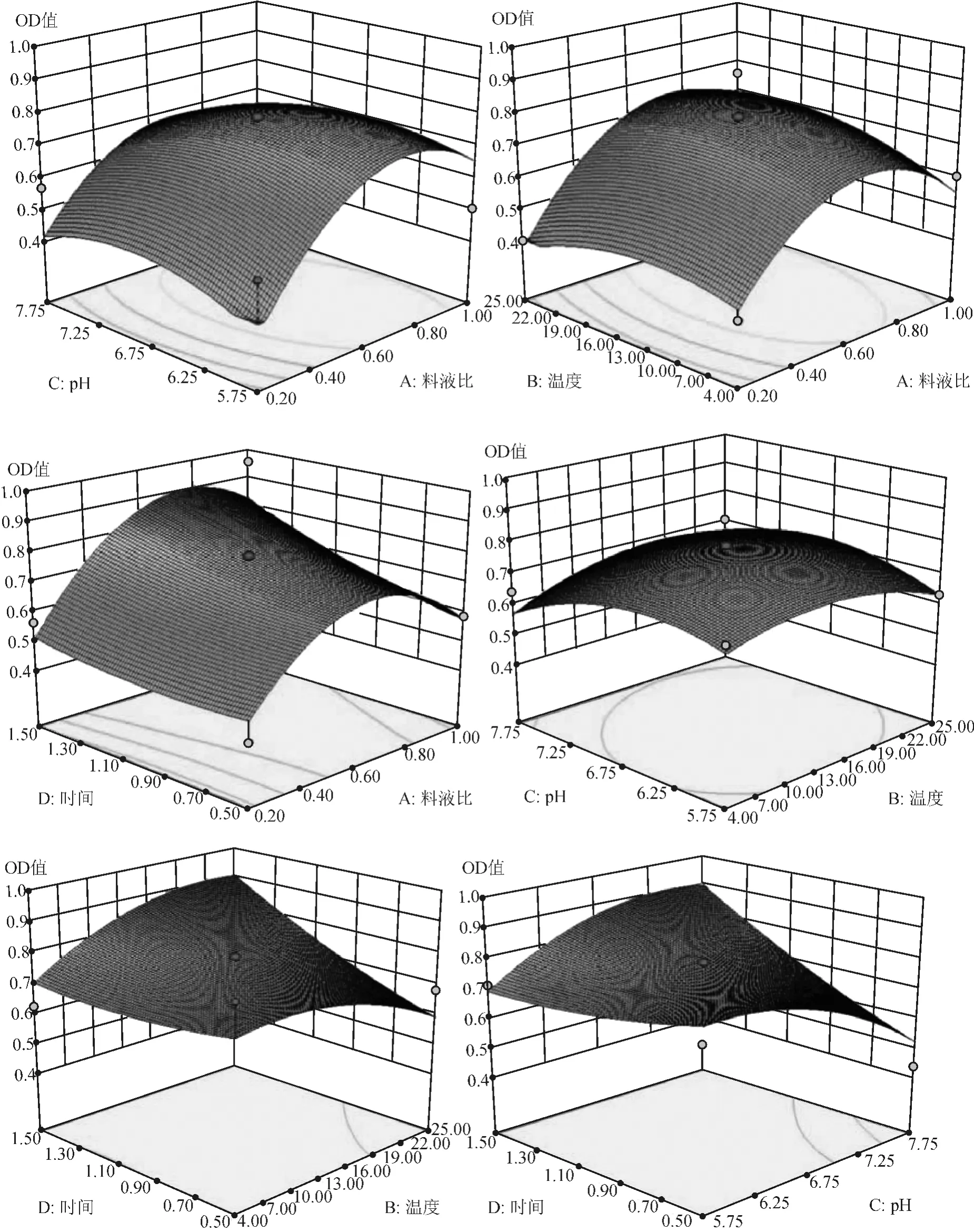
图2 各两因素交互作用的响应面和等高线图Figure2 Response surface and contour of the any two factors on the yield of Pseudostellariae Radix protein

表5 验证试验Table5 Verification experiment
通过对3个不同等级太子参SDS-PAGE电泳图谱分析,发现3个等级太子参蛋白条带分布没有明显差异,但蛋白表达量有一定差异,特别是一等参在15 kDa处的蛋白表达量明显高于二等参和统货,可能此处的蛋白质与不同等级参形的形成有关。Y.Stahl和R.Simon[20]也指出一些低分子量的多肽和受体类蛋白对于植物根的生长发育及根形的形成至关重要。日后本课题组将通过双向电泳、质谱分析与生物信息学技术进一步分析分子量15 kDa处蛋白的种类及其参与的代谢通路,以期进一步阐释不同参形形成的分子机理。
本研究首次采用响应面优化法对太子参蛋白的提取工艺进行优化,得到的最佳优化条件与韩景华等[21]、夏琨[22]利用Tris-HCl缓冲液对植物蛋白提取工艺的优化结果不同,其中的原因可能是:二者选用的实验材料不同、缓冲液的配比不同、提取条件不同等。本次实验得到太子参蛋白的最佳提取工艺条件为:料液比1∶1.32,提取温度25℃,pH值7.47,提取时间 1.5 h。

