猪瘟单克隆抗体制备实验
岳铃钟秀琼杨粘黄耿耿
(1,贵州省贵阳市白云区动物疫病预防控制中心 550014;2,云南省楚雄州动物疫病预防控制中心 675000;3,贵州省贵阳市白云区动物卫生监督所 550014)
猪瘟是由猪瘟病毒引起的一种急性或慢性、热性和高度接触性传染病。猪瘟呈世界性分布,其危害程度高,对养猪业造成经济损失巨大,一直是国际重点检疫对象,尽管我国兔化弱毒疫苗为控制猪瘟起到巨大作用,但猪瘟仍在我国流行严重。猪瘟E2蛋白一直是猪瘟研究的热点。单克隆抗体以其高度的特异性和敏感性而在CSFV生物学研究中起重要作用。为进一步探索基因疫苗制备单克隆抗体的新方法,本实验构建了CSFV E2基因真核表达质,并用其免疫Balb/C小鼠,用原核表达的CSFV E2抗原作为检测抗原筛选,建立了2株杂交瘤细胞株,这2株单克隆抗体与CSFV能特异性反应并具有中和能力。这是利用基因免疫制备动物病毒单克隆抗体的首次报道,为广泛利用这一技术研制单克隆抗体打下坚实基础。
1 材料
1.1 菌种与质粒、细胞和实验动物
大肠杆菌JM101、JM109、和 BL21(DE3)plysS、 DH5α、BL21(DE3)plysS宿主菌、质粒pET-28a(+)和pVAX1由本室保存由本实验室保存。PK-15、SP2/0细胞由本实验室保存。Balb/c小鼠购买于昆明医学院实验动物中心。猪瘟病毒石门株全长结构蛋白基因以ppocsfv.dna由湖南农业大学余兴龙教授馈赠。
1.2 主要试剂
胰蛋白胨(TRYPTONE)、邻苯二胺(OPD)、30%双氧水(H2O2)、牛血清白蛋白(BSA)、Tween-20、琼脂糖、oligo(dT)、dNTP(上海生物工程有限公司);新生牛血清、胎生牛血清、DMEM高糖培养基、PRMI-1640培养基(GIBOCO);HRP标记的兔抗鼠IgG。
2 方法
2.1 猪瘟病毒E2基因真核表达质粒的构建
根据Genbank登录的猪瘟病毒石门株E2基因序列设计扩增E2全长基因的上游引物E2Fp GGATCCACCATGGTATTAAGGGGACAGATCGTGC和下游引物E2RP CGGAATTCCTAGTCAAACCGGTACTGATACTCACC。PCR循环参数为95℃变性5min,95℃ 50s,55℃ 50s,72℃ 20s,25个循环。用Agarose Gel Extraction Kit(B.M)分别回收PCR产物,然后用BamHI和 EcoRI双酶切 PCR产物并回收酶切产物,然后连接到pVAX1的BamHI和EcoRI两位点之间。将连接产物转化DH5αE.coli。从转化平板上挑取单个菌落接种到3ml含有卡那霉素的LB培养基中,培养12h后小量提取质粒。将提取的质粒用BamHI EcoRI双酶切,切出目的片段即为阳性重组子,送样测定序列。
2.2 猪瘟病毒E2基因原核表达质粒的构建和表达
将编码猪瘟病毒囊膜糖蛋白E2基因的表达载体质粒pET-28a-E2,转入受体菌BL21(DE3)plysS中,IPTG诱导表达了具有抗原性的E2蛋白。包涵体提取后用20mM的Tris-HCl(pH8.0)悬浮,与4倍SDS-PAGE上样缓冲液煮沸10~15min待包涵体彻底溶解后,进行PAGE电泳,检测含量和纯度。
2.3 动物免疫
选择8~12周龄Balb/c小鼠6只,每只小鼠后肢胫前肌注射脂质体包被的基因疫苗pVAXE2,注射剂量每只小鼠注射含20μg共100μl的基因疫苗,共注射6只小鼠,免疫5次,每次间隔两周,每次免疫同样剂量的细胞,融合前一周再加强免疫一次。
2.4 基因免疫小鼠的血清抗体检测
免疫2次和3次后5d,从小鼠尾部采血,1:200倍稀释,用重组纯化的E2蛋白(每孔包被量为40μg)为检测抗原,以牛血清白蛋白为封闭剂,间接ELISA检测基因免疫小鼠血清抗体水平。
2.5 饲养细胞的制备
取健康小鼠眼球采血,颈椎脱臼处死,至于75%酒精5~10min,无菌条件下,用剪刀在小鼠腹部剪一小口,两侧撕开腹部皮肤。用一次性无菌注射器向小鼠腹腔内注入5ml 1640完全培养基,并用摄子轻轻摇动小鼠腹腔。用无菌注射器吸出小鼠腹腔内注入的培养基,此过程需注意避免操作污染的发生。加1640完全培养基至15ml,混匀,用移液器将其加入96孔板中,50μl/孔。放置于37℃ 5%CO2培养箱内过夜培养,以备次日融合用。
2.6 杂交瘤细胞融合
将骨髓瘤细胞与免疫脾细胞按1:10或1:5的比例混合在一起,1200rpm离心8min,弃上清。用滴管吸净残留液体,轻轻弹击离心管底,使细胞沉淀略加松动。在室温下融合:30s内加入预热的50%PEG4000,边加边旋转离心离管,使细胞与PEG充分接触;作用90s;加预热的不完全培养液,终止PEG作用,每隔2min分别加入1ml,2ml,4ml,13ml。800rpm离心6min,弃上清,沉淀即为此次融合的细胞。对此细胞再洗一次,尽量除去残余的PEG,以免影响后续实验。加入10ml含20%小牛血清的1640培养液轻轻混悬,勿用力吹打,以免使融合在一起的细胞散开。将融合细胞加入到含有饲养细胞的96孔培养板中,每孔50μl,放入37℃ 5%CO2培养箱中培养。次日换为HAT选择培养基培养两周,而后改为HT选择培养基培养两周。
2.7 杂交瘤细胞克隆
克隆前先用两只健康Balb/C小鼠的腹水作饲养细胞铺板,用完全培养基将阳性孔中的融合细胞吹打,移至无菌小瓶中,计数后,稀释至每50μl中含有一个细胞。然后,将稀释的细胞悬液滴入已铺有饲养细胞培养板内,每孔50μl。置入5%CO2温箱37℃培养,次日补加1滴完全培养基,每天观察一次,发现污染立即用1N NaOH消除污染,3d左右换液一次,换液时要特别小心,每孔一个灭菌好的吸头,观察每孔有几个克隆株,一般1个克隆株的孔占多数,对有两个或没有细胞的孔,分别作出标记。待克隆细胞生长至8~10d时进行检测,标出阳性孔。同时,对所有的孔均换液,2d后,再检测。将两次检测OD值高的孔再次进行克隆,直到所有的孔都为阳性,最后选择OD值高、细胞活力好、只有一个克隆的细胞孔扩大培养,液氮保存,同时收集其上清,放-20℃冰箱冻存。
2.8 腹水的制备
将0.5ml的高压灭菌的石蜡油注射到小鼠腹腔,一周后注入1×106个杂交瘤细胞于小鼠腹腔,7~10d后当小鼠腹部极度膨胀时,抽取腹水,1500r离心10min,取上清,56℃灭活30min,加入50%的甘油,进行小包装分装,放-20℃冰箱冻存,待用。
2.9 杂交瘤细胞上清和腹水效价的测定
将杂交瘤培养的上清分别作64、128、256、512和1024倍稀释,阴性对照为SP2/0培养上清。制备的腹水分别进行1∶103、104、105、106、107倍稀释,阴性对照用SP2/0制备的腹水作同样倍数的稀释,进行间接ELISA检测,P/N值>2的最高稀释倍数即为上清和腹水效价。
3 结果
3.1 pVAXE2的鉴定结果
将连接产物转化E.coli感受态,小提质粒,用BamHI和EcoRI酶切,切出1047bp目的片段,筛选得到阳性克隆。然后双向测定序列,与PPOCSFV.DNA完全符合,证明构建正确。pVAXE2中的E2基因含信号肽无跨膜区(1047bp在兔化弱毒株基因组2379~3425位置),酶切鉴定。猪瘟病毒E2重组质粒的酶切结果,见图1。
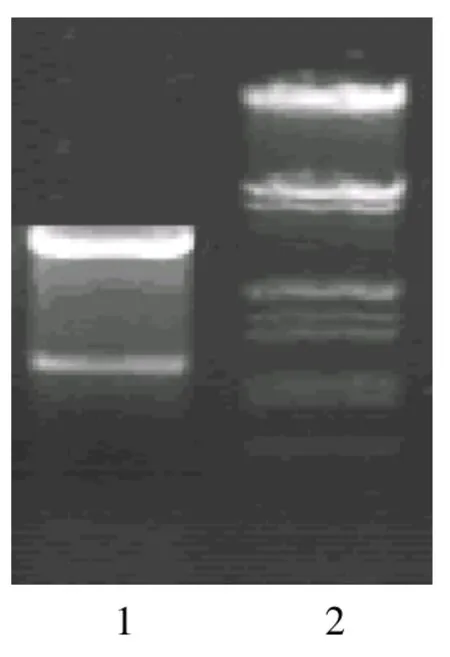
图1 pVAXE0和pVAXE2的酶切鉴定结果
3.2 重组菌、E纯化E2蛋白的PAGE电泳和薄层扫描测定纯度的检测
下页左图可见重组E2菌中呈现于预计分子量大小相同的表达产物,二对照菌则没有;E2蛋白的纯化用BCA蛋白测定试剂盒测定蛋白含量(图中),按Peirce试剂盒说明书进行,中图可见不同含量的纯化的重组E2纯化效果及western bloting特异性检测结果,右图则为薄层扫描测定的纯化E2的纯度达70%。
3.3 免疫小鼠的抗体水平检测结果
以E2抗原为抗原包被酶标板,间接ELISA检测基因免疫小鼠血清,结果表明,6只免疫小鼠均产生明显的抗体应答,第二次免疫后血清中抗体水平明显高于第一次免疫,见表1。
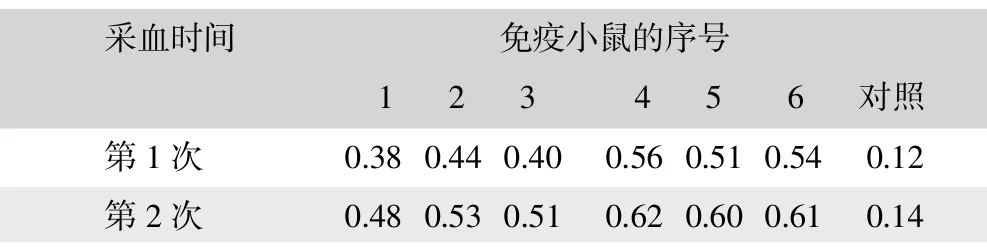
表1 基因免疫Balb/c小鼠血清抗体检测结果
3.4 杂交瘤细胞上清和腹水抗体滴度的检测结果
将获得的17株(10株E2,7株E0)杂交瘤细胞株的细胞培养上清和制备的腹水经间接ELISA检测,上清效价在1∶256~512, 腹水效价在 1: 105~106, 见表 2~3。
4 讨论
E2是瘟病毒的囊膜糖蛋白,在CSFV中E2位于ORF的精氨酸690-谷氨酸1062位,由373个氨基酸残基组成,有5个N端的糖基化位点,这些糖基化位点对CSFV的感染非常重要[1,2];BVDV的E2位于ORF的2077~3198位核苷酸,由374个氨基酸残基组成,含有19个半胱氨酸残基和5个可能的糖基化位点,这些位点在BVDV的不同毒株都是非常保守的[3]。瘟病毒的E2蛋白多以二聚体的形式存在,在细胞信号肽的作用下从多聚蛋白上游离下来,C端含有疏水的膜锚定区域,锚定在囊膜上。CSFV E2蛋白存在4个独特的抗原结构域A、B、C、D,Wensvoort用13株抗CSFV McAb借助竞争结合法和抗原捕捉测定法研究了CSFV的抗原表位[4]和Van Rinjin通过表达确实突变体证实4个抗原结构域位于E2 N端的690~860位氨基酸残基,其中A区是高度集中的抗原表位集中区;B和C是诱导中和抗体产生的主要部位,均为非保守区;而D区既不保守也不诱导中和抗体的产生。E2是瘟病毒主要保护性抗原,长期以来被称为瘟病毒研究的主要对象,是人们研究新型疫苗的主要靶基因,也是建立CSF血清学检测方法首选抗原。猪瘟E2蛋白一直是猪瘟研究的热点。单克隆抗体以其高度的特异性和高度的敏感性而在CSFV的生物学研究中起重要作用。本研究通过过构建的E2基因的真核表达质粒制备成基因疫苗,通过免疫小鼠的脾细胞与SP2/0细胞融合,大量筛选猪瘟病毒杂交瘤细胞株筛选出17株分泌抗E2抗体的杂交瘤细胞株,克隆3次后检测的培养上清和腹水效价分别为1∶256~512和1:105~106。接种猪瘟病毒的PK-15,用17株杂交瘤细胞株的制备的腹水为一抗,以荧光标记的鼠二抗的间接免疫荧光检测结果显示,17株单抗中,有7株呈现强烈的荧光染色,为CSFV的检测和猪瘟病毒的研究提供试剂奠定了物质基础。
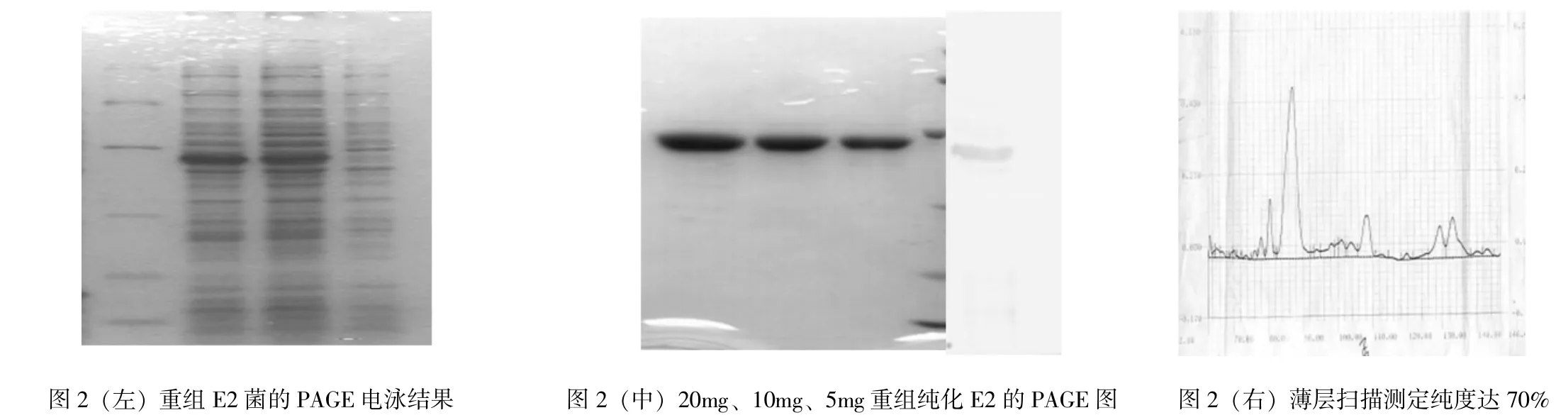
图2 重组E2的SDS-PAGE电泳、western bloting和纯化结果
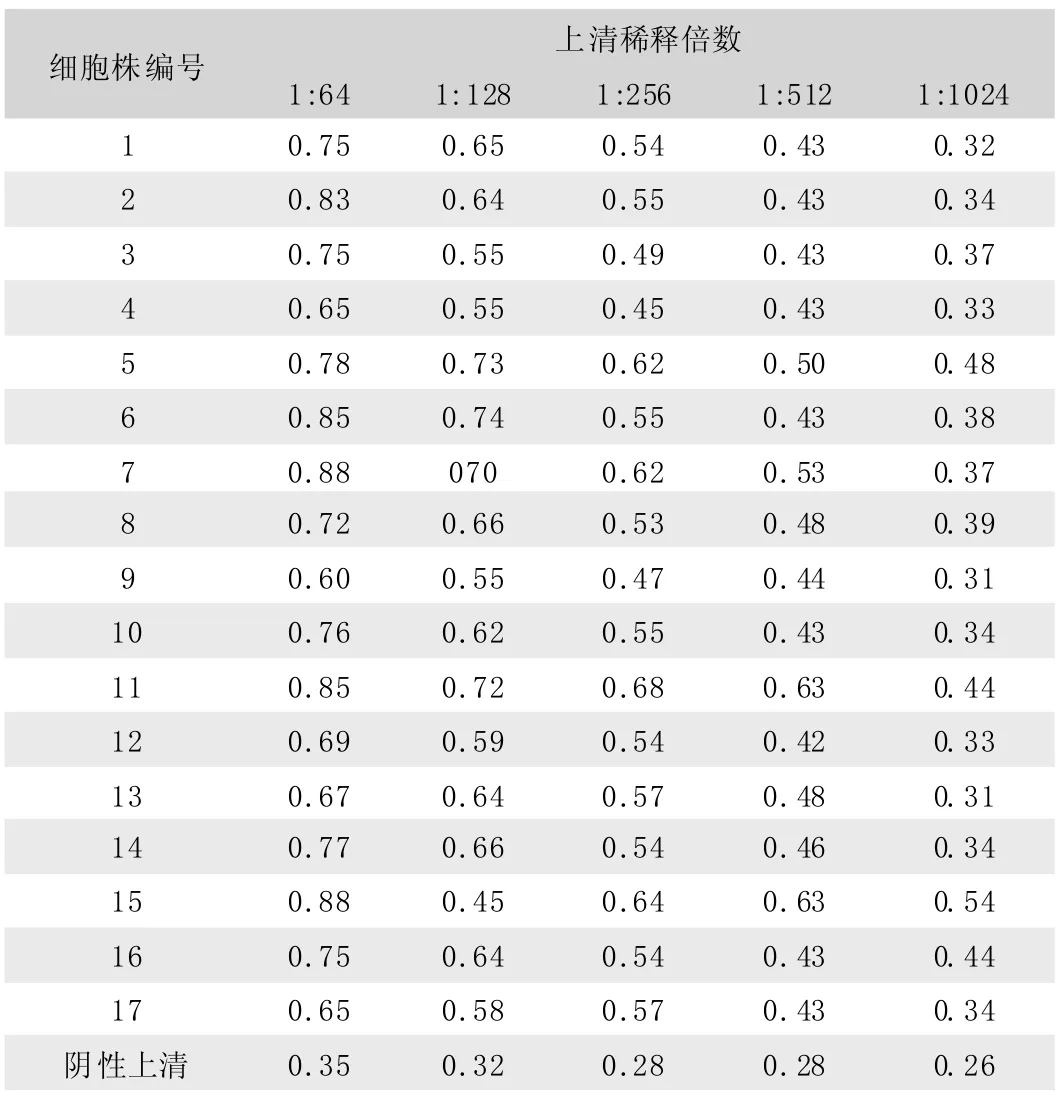
表2 间接ELISA检测杂交瘤细胞上清滴度
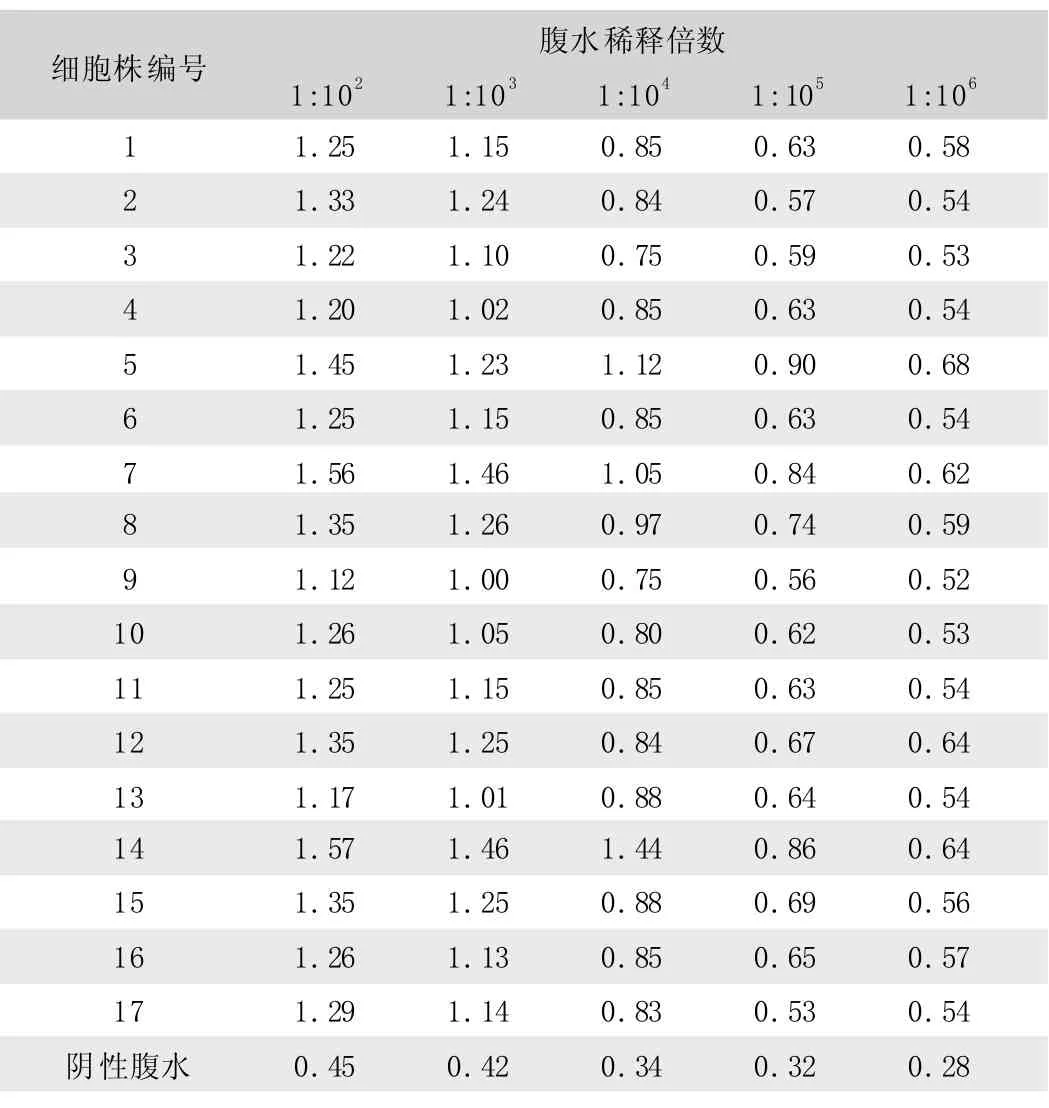
表3 间接ELISA检测腹水滴度

