高效液相色谱分析不同理化因素对血红素辅基稳定性的影响
刘 越, 孙 冲, 李鹏鹏, 张新笑, 徐为民
(1.南京农业大学,江苏南京 2100952; 2.江苏省农业科学院农产品加工研究所,江苏南京 210014)
肉色是肉品的一个外在指标,肉品的色泽可以直观反映其新鲜程度,是其能否被消费者接受的关键因素[1]。新鲜牛肉的颜色为樱桃红色,在空气中放置后会很快变为鲜红色,之后又转变为褐色[2-3],即使在冷藏期间,颜色也会随时间发生改变[4]。在肉品贮藏和加工过程中,肉色的保持并非易事,需要探究肉品色泽变化的机制,采取合适的保护措施以尽可能地减少肉色损失。肉品的色泽主要由肌红蛋白决定,肌红蛋白由珠蛋白和1个血红素辅基构成,而肌红蛋白的颜色主要受血红素辅基结构和氧化状态的影响,如果血红素辅基结构发生改变,肌红蛋白的结构和功能也很可能发生变化。血红素辅基是由(亚)铁离子和原卟啉形成的复合物[5],其中心的铁原子与卟啉环形成4个配位键,铁原子的第5配位位置由组氨酸的咪唑氮原子在轴向结合形成配位键,第6配位位置可同氧或其他小分子结合,铁原子电子状态的变化会直接影响整个血红素的电子状态,从而表现出不同的吸收光谱[6-7]。
在动物从被屠宰到肉品销售过程中,肉品贮藏和运输期间的时间因素、加工过程中温度和pH值的变化,以及常见的食品添加剂氯化钠、消毒剂次氯酸钠[8]等理化因素都可能对肉品的色泽产生一定的影响。以往有研究表明,在时间、pH值、温度等理化因素下,肉品的肉色表现出一定的变化规律[9-10],但是对于血红素辅基稳定性的研究很少。本研究拟更深入地分析肌红蛋白上的关键结构血红素辅基,通过试验探究在不同理化因素下血红素辅基稳定性的变化规律。以往研究肌红蛋白及血红素辅基大多采用紫外光谱法[11],该方法在抗干扰、定量的准确程度等方面存在一定的缺陷。本研究采用反相高效液相色谱法探究不同理化因素对血红素辅基稳定性的影响,以更加精确地分析血红素辅基受不同理化因素的影响程度,从而深入地了解影响血红素辅基结构稳定性的关键因素,为将来控制肌红蛋白血红素辅基结构的变化、稳定肉色提供理论依据。
1 材料与方法
1.1 试剂与仪器
新鲜牛肉,购自南京市玄武区下马坊苏果超市;肌红蛋白标品为马骨骼肌红蛋白(美国Sigma公司)。其他试剂均为分析纯,所有溶液均用超纯水配制。
M124A万分之一分析天平(意大利BEL公司);WH2微型旋涡混合仪(上海沪西分析仪器厂有限公司);FE20实验室pH计[梅特勒-托利多仪器(上海)有限公司];HH8数显恒温水浴锅(国华电器有限公司);SPX250C恒温培养箱(上海博讯实业有限公司医疗设备厂);N-EVAP氮吹仪(美国Organomation公司);UPC10AKTA蛋白纯化仪(美国GE Healthcare);Sephadex G200凝胶柱(美国GE Healthcare);Waterse2695高效液相色谱仪(美国Waters公司);AgilentZX26液相色谱串联飞行时间质谱仪(美国Agilent Technologie公司)。
1.2 试验方法
牛肉肌红蛋白的提取参考Thiansilakul的方法并加以修改[12]。
1.2.1 肌红蛋白粗提物的提取 取100 g肉糜与300 mL冷的萃取介质[50 mmol/L 三羟甲基氨基甲烷(Tris)-HCl,pH值8.0]混匀,10 000 r/min 匀浆1 min,然后于9 600g离心15 min,吸出上清液于饱和度为75%的硫酸铵中盐析1 h,将上清液于 10 000 r/min 离心30 min,取粉红色的上清液,将盐析的蛋白质上清液置于透析袋中(截留分子量为7 000 u),通过10倍体积的预冷的50 mmol/L磷酸盐缓冲液(pH值8.0)透析除去硫酸铵,将透析袋置于冷冻恒温摇床中,转速为 100 r/min,透析液换10次,即得到肌红蛋白的粗提物,所有提取过程在4 ℃条件下进行。
1.2.2 蛋白层析分离纯化 肌红蛋白纯化用的层析柱为Sephadex G200凝胶柱,进样前先用冷的Tris-HCl缓冲液(50 mmoL,pH值为8.0)平衡凝胶柱,将透析后的肌红蛋白经0.2 μm滤孔过滤后进样,每次上样1 mL,流速为 1 mL/min,紫外检测波长为280 nm,收集出峰位置的溶液于10 mL EP(Eppendorf)管中,4 ℃保存。
1.2.3 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,简称SDS-PAGE)分析 SDS-PAGE电泳样品前处理:在0.2 mL除盐后的纯化蛋白液中加入0.4 mL上样缓冲液后于95 ℃处理 5 min。SDS-PAGE电泳采用15%分离胶,5%浓缩胶,每孔等体积上样20 μL,电泳电压为160 V,持续时间为50~60 min,取出凝胶块,用考马斯亮蓝染色液染色10 min后取出,加入适量的脱色液,放在摇床上使脱色更加均匀迅速,1 h后更换脱色液,直至脱色完成,取出凝胶块,用凝胶成像仪进行成像分析。
1.3 液相收集与质谱分析
分别收集反相高效液相色谱出峰位置的液体,随后利用固相萃取(solid phase extraction,简称SPE)柱对收集液进行净化浓缩,用氮气吹干至乙腈完全去除,用少量双蒸水溶解管壁内的溶质,最后用液相色谱串联飞行时间质谱进行分析。
质谱条件。离子源:电喷雾离子源(ESI),正离子模式;离子化条件:气温与流速分别为300 ℃、3 μL/min,针泵直径为 2.3 mm,毛细管电压为5.5 kV,采集时间为0.5 s,雾化器压力(GS1)、辅助器压力(GS2)均为206.842 7 kPa。数据通过分析软件PeakView进行定性分析。
1.4 液相色谱分析
1.4.1 色谱条件 色谱柱:C18反相色谱柱;流动相:A为 0.1% 三氟乙酸(TFA)溶液,B为0.1% TFA-乙腈;流速为 1 mL/min;柱温为25 ℃;波长为210~410 nm。洗脱梯度:0~10 min,5%~60% B;10~20 min,60% B;20~25 min,60%~5% B。
1.4.2 静置时间对肌红蛋白血红素辅基的影响 制备质量浓度为0.2 mg/mL的肌红蛋白溶液,置于4 ℃冰箱中,放置0、1、3、5、7 d后分别进行液相分析。
1.4.3 温度对肌红蛋白血红素辅基的影响 制备质量浓度为0.2 mg/mL的肌红蛋白溶液,置于4、20、30、40、50 ℃恒温水浴锅中水浴60 min后分别进行液相分析。
1.4.4 pH值对肌红蛋白血红素辅基的影响 制备质量浓度为0.2 mg/mL的肌红蛋白溶液,缓冲液pH值设为3、5、7、9、11,置于20 ℃恒温培养箱中60 min后分别进行液相分析。
1.4.5 氯化钠浓度对肌红蛋白血红素辅基的影响 制备质量浓度为0.2 mg/mL的肌红蛋白溶液,加入质量分数为 1%~5%的氯化钠,置于20 ℃恒温培养箱中60 min后分别进行液相分析。
1.4.6 次氯酸钠对肌红蛋白血红素辅基的影响 制备质量浓度为0.2 mg/mL的肌红蛋白溶液,加入1%次氯酸钠(将pH值调节至12),空白处理用双蒸水代替,置于37 ℃恒温培养箱中1~6 h后分别进行液相分析。
2 结果与分析
2.1 SDS-PAGE分析
已知肌红蛋白的相对分子质量约为16 ku,从图1中可以看出,条带4、条带2(圈中所示的带)处于同一位置,且泳道4中可见的条带只有1个(圈中所示的带),说明条带4对应的收集液为肌红蛋白,且较纯;与泳道4相比,泳道3中含有多条带,说明肌红蛋白粗提物经过蛋白层析仪处理后达到了较好的纯化效果。

2.2 液相收集与电喷雾质谱(ESI-MS)分析
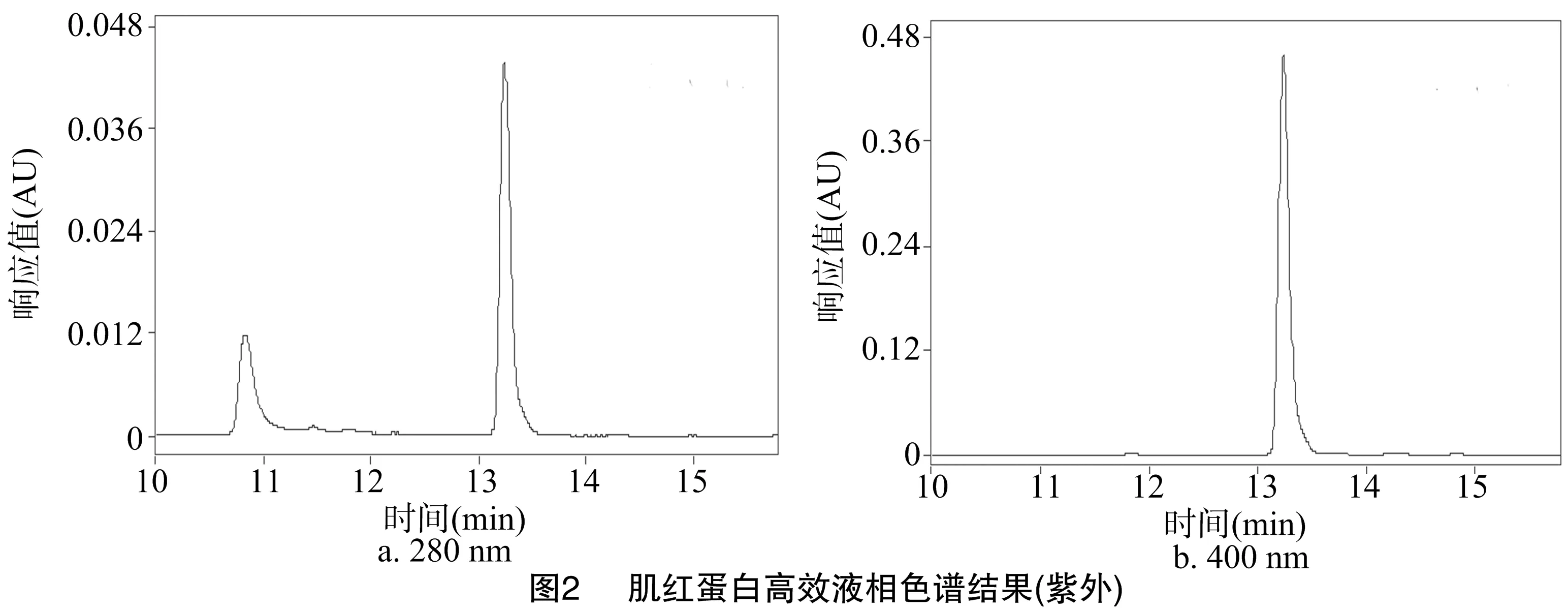
由高效液相色谱图可见,在280 nm紫外波长下,肌红蛋白在10.9、13.3 min处有较明显的吸收峰;当波长为400 nm时,肌红蛋白只在13.3 min处有明显的吸收峰(图2)。
由图3可以看出,肌红蛋白标品质谱图的主要峰在 16 952.0 u 处,另外1个较明显的峰在17 567.1 u处;由图4可以看出,肌红蛋白液相色谱在10.9 min处收集液的质谱图的主要峰在 17 567.7 u 处,另外1个较明显的峰在16 952.0 u 处;由图5可以看出,肌红蛋白液相色谱在13.3 min 处收集液的质谱图的主要峰在 764.5、765.5 u处。
综上分析可知,图3、图4这2个质谱图的2个主要峰相似,相关研究表明,肌红蛋白相对分子量在16 700.0 u左右,可以推断16 952.0、17 567.1 u处的峰代表的是肌红蛋白、珠蛋白。图5中主要峰的相对分子量为764.5 u,推测该峰代表的是血红素辅基,将该样品通过紫外波长扫描可以发现,它在400 nm处有明显的特征峰,可进一步得出肌红蛋白液相色谱在13.3 min处收集的样品是血红素辅基。因此,在液相试验考察各因素对血红素辅基稳定性影响的研究中,选择波长为400 nm、时间为13.3 min处的吸收峰作为参照。
2.3 液相分析
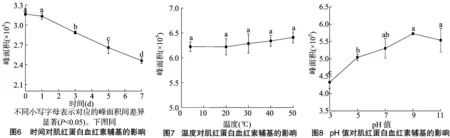
2.3.1 静置时间对肌红蛋白血红素辅基的影响 由图6可以看出,血红素辅基在400 nm处的紫外吸收峰面积随着静置时间的增加逐渐降低,在1~7 d间有显著差异(P<0.05),在1、3、5、7 d时,分别比0 d时降低了1.07%、8.83%、16.05%、22.29%,说明随着时间的延长,血红素辅基损失逐渐增加,并且在1 d后,其损失速率加快。推测其原因,可能由于肌红蛋白在空气中易发生自氧化,在自氧化过程中产生的自由基会反作用于肌红蛋白,从而破坏肌红蛋白上的血红素辅基,造成血红素辅基的损失[13]。有研究表明,随着时间的延长,从肌红蛋白上脱落的血红素辅基会进一步发生裂解,铁离子从卟啉环中游离出来,留下空位的卟啉环,造成其吸收峰强度的降低[14-15]。

2.3.2 温度对肌红蛋白血红素辅基的影响 图7结果显示,随着温度的升高,血红素辅基在400 nm处的紫外吸收峰面积无明显差异,说明在4~50 ℃、60 min内,血红素辅基的稳定性受温度的影响不大。结果表明,在50 ℃以下时,随着温度的升高,肌红蛋白自动氧化程度随着温度的升高而增加[16]。但试验结果显示,在4~50 ℃、60 min内血红素辅基吸收峰强度无明显差异,说明温度可能会加快肌红蛋白的氧化速率,即促进血红素辅基上的二价铁离子氧化成三价铁离子[17],但血红素辅基的结构并未被破坏,在该温度下血红素辅基结构较稳定。也有研究表明,当温度达到70 ℃时,血红素辅基特征峰消失,说明过高的温度依然会破坏血红素辅基的结构[16]。
2.3.3 pH值对肌红蛋白血红素辅基的影响 图8结果显示,pH值在3~11间时,血红素辅基在400 nm处的紫外吸收峰面积有明显差异(P<0.05),pH值=9时最大,pH值小于9时逐渐降低。在碱性环境中血红素辅基的吸收峰强度大于酸性环境中的,说明血红素辅基在偏碱性环境下较稳定,酸性环境会降低血红素辅基的稳定性,而且pH值越低,越不利于血红素辅基结构的稳定。血红素辅基在不同pH值下吸收峰面积的变化,可能是由于其共轭体系被破坏或者铁离子游离了出来。许多研究也显示,肌红蛋白在酸性条件下其特征峰吸收强度明显降低,还有研究表明,在酸性条件下肌红蛋白更易发生自氧化[18],质子取代反应是酸性条件下血红素蛋白自动氧化加速的主要原因[19],当pH值下降到3及以下时,肌红蛋白血红素辅基的结构会受到较大程度的破坏[20]。
2.3.4 盐浓度对肌红蛋白血红素辅基的影响 由图9可以看出,对于氯化钠质量分数为1%~5%的肌红蛋白样品,其血红素辅基在400 nm处的紫外吸收峰面积无明显差异。说明在氯化钠质量分数为1%~5%的肌红蛋白溶液中,其血红素辅基结构的稳定性基本不受盐浓度的影响。有报道表明,在肌红蛋白溶液中添加1%~5%的氯化钠,肌红蛋白的氧化程度无明显变化,通过紫外扫描其在400 nm左右的特征吸收峰强度也无明显差异,说明血红素辅基的结构相对稳定[21]。因此,将氯化钠作为肉品中常用的添加剂时,在一定范围内,其对肌红蛋白血红素辅基的稳定性无明显影响。

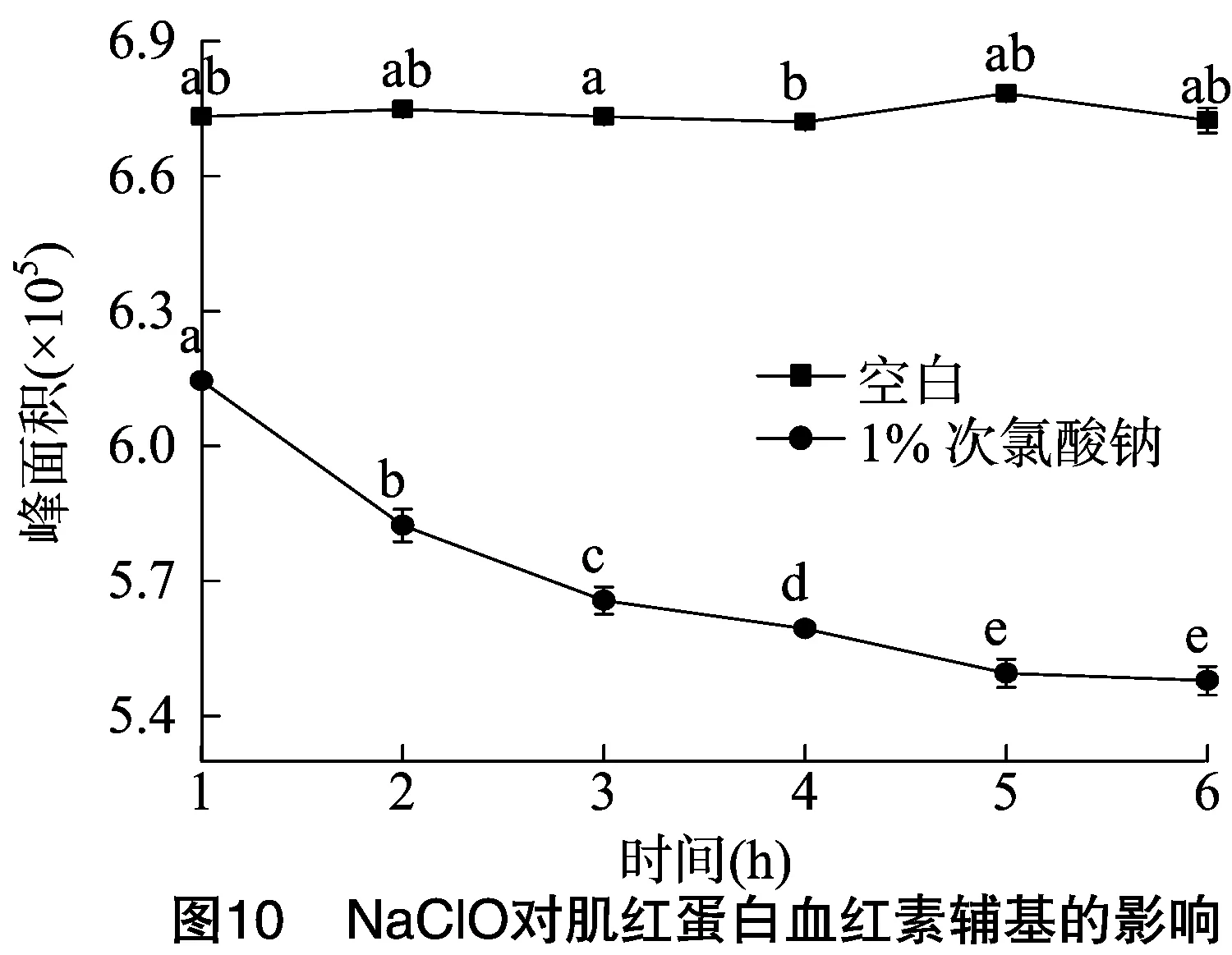
2.3.5 次氯酸钠对肌红蛋白血红素辅基的影响 从图10可以看出,用1% NaClO(稀释到pH值为12)处理后的样品的峰面积明显低于空白对照组,在开始的1 h时就有较大差异,峰面积较空白对照降低了8.72%,说明加入NaClO明显破坏了血红素辅基,使其在400 nm处的特征吸收峰降低。随着时间推移,1% NaClO处理后的样品的峰面积逐渐降低,在1~5 h 间其峰面积有显著差异(P<0.05),5 h时其吸收峰面积与空白对照相比降低了18.99%,5 h后则趋于平缓,说明NaClO对血红素辅基的作用随着处理时间的增加而逐渐增强,到5 h左右作用完全;空白组峰面积基本保持不变,说明血红素辅基在该环境下是比较稳定的。当加入5% NaClO(稀释到pH值为12)时,液相色谱图中原先肌红蛋白的2个峰基本消失,说明该剂量的次氯酸钠对肌红蛋白、血红素辅基的结构产生了很大的破坏。
次氯酸钠反应后的分解产物是氯离子、氯酸根离子。由于工业生产中使用的亚氯酸钠、次氯酸钠的浓度都较低,且对猪肉的处理方法是浸泡,因此猪肉上残留的防腐剂及防腐剂的分解产物是微量的,在这样的范围内可认为是对人体无害的[22-23]。但是一定浓度的次氯酸钠会破坏肌红蛋白的血红素辅基结构,所以在工业生产中,应控制次氯酸钠的添加量以减少对血红素辅基的影响,从而使肉色更加稳定。
3 结论
上述试验表明,在一定条件下,肌红蛋白血红素辅基损失随处理时间的延长而持续增加;在4~50 ℃范围内,温度对血红素辅基结构稳定性的影响不显著;血红素辅基在偏碱性环境下较稳定,酸性环境会影响血红素辅基的稳定性,且pH值越低,越不利于血红素辅基结构的稳定;在一定质量分数范围内,氯化钠不会破坏血红素辅基的结构,不同盐浓度下血红素辅基的稳定性无明显差异;一定浓度的次氯酸钠会破坏血红素辅基的结构,并且随着处理时间的延长,其作用越强。

