甘蓝型油菜种子特异表达油体蛋白启动子PBnOA03的克隆及功能分析
王海兰,贾庆利,赵翠珠,杨 铮,王 凯,刘香伶,唐 通,宋 欢,张 猛
(西北农林科技大学 农学院,陕西杨凌 712100)
转基因技术是基因功能分析和外源基因在植物中稳定表达的一种不可或缺的强大工具。在植物遗传工程中,引入的靶基因通常需要在特定的时期或组织器官中表达,这些问题通常通过特异表达的启动子来解决。启动子在起始和调节基因转录中有着重要的作用,也是分子育种中的重要研究部分。目前已有很多启动子被鉴定,并在农业基因工程中用来控制基因的表达。例如CaMV 35S启动子[1]、RuBisCo大型亚基启动子[2]和NOS启动子[3]。在大多数情况下,目标基因是被一个组成型启动子所驱动而表达。例如CaMV 35S,这一启动子在植物的大部分组织中都具有较强的表达水平。然而,转基因产物的连续合成和大量的积累,会对转基因植物的代谢过程造成干扰,从而产生一些不良的多效性反应[4],有时还会对组织产生毒性[5]。因此,有效利用特异表达的启动子,将会极大地满足转基因作物的需求[6]。这类启动子被称为组织特异性启动子[7],包括叶片、茎、根、果实、花粉和种子等特异性启动子。
油菜(BrassicanapusL.)是重要的油料作物之一,是植物油和植物蛋白的重要来源,在中国乃至全世界都有广泛的种植[8]。油菜种子的产量及其品质直接关系到油菜的经济价值,除了作为食用油,油菜籽还可作为生物能源,这也是用来解决未来能源危机的途径之一。因此,可以通过构建一个种子特异性的启动子来让基因在油菜种子中特异性表达,从而达到改良油菜种子特性、提高油菜的产量和改良油菜脂肪酸组分的目的[9]。目前,油菜中报道的特异性启动子的研究相对来说较少,并且大部分还受到专利的保护。因此,油菜组织特异性启动子的研究,对于油菜及其他作物的基因工程改良方面都会具有极其重要的作用。甘蓝型油菜在种子特异性启动子的研究方面主要注重于油菜籽的特性改良,近些年来应用最多最广泛的属于napin启动子。napin是十字花科植物中重要的储藏蛋白,由多基因编码,在种子发育后期开始表达。最早在1987年,Josefsson等[10]克隆到编码储藏蛋白napA的基因;随后Ericson等[11]克隆到napB上游序列,发现了和拟南芥同源性较高的一些保守区域;Zhang等[12]从油菜基因组中分离出来300 bp的napinB基因,经序列分析表明,该序列含有与种子特异相关的高度保守的顺式元件,在烟草中转化并通过GUS报告基因分析表明,它在胚和胚乳中特异性表达。另外,亚细胞定位及表达分析发现, FAE1能在胚珠中特异性表达[13]。随后有研究者对 FAE1的上游区域进行研究,发现上游序列中含有较多与种子特异表达相关的顺式作用元件,例如RY-repeat[14]、G-box和E-box[15-16]。
油体蛋白(Oleosin)是一类存在于油体表面的小分子蛋白[17],存在种子特异表达和非特异表达两种类型。本研究中,利用转录组数据,在对甘蓝型油菜种子中油体蛋白基因的表达模式进行分析的基础上,选择种子特异表达的油体蛋白,开展启动子PBnOA03的克隆、序列分析以及转基因株系的功能验证。这种种子特异表达的启动子,可以作为农作物基因工程种子改良新的工具。该启动子顺式元件的分析,也为以后油体蛋白的调控研究提供重要信息。
1 材料与方法
1.1 材 料
供试材料为陕西省油菜杂交中心提供的甘蓝型油菜‘秦油7号’;野生型拟南芥为Columbia生态型Col-0;试验所用大肠杆菌为DH5α;农杆菌菌株为GV3101,表达载体为pBI121。
质粒提取试剂盒、凝胶回收试剂盒购置于Omega公司;T4DNA Ligase、限制性内切酶购置于Takara公司;DH5 α大肠杆菌感受态细胞、高保真DNA聚合酶购置于全式金公司;DNA Marker购置于西安擎科生物公司;试验中所涉及的引物均使用Primer Premier 5.0软件设计合成,由西安擎科生物公司合成。
1.2 甘蓝型油菜油体蛋白基因在组织中的表达量分析
通过表达量分析网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastn& BLAST_PROGRAMS=megaBlast&PAGE_TYPE=BlastSearch&BLAST_SPEC=SRA&SHOW_DEFAULTS=on)对备选基因在油菜种子不同发育时期和在根、子叶、叶片等不同组织的表达量进行分析。首先,在NCBI的SRA中搜索相关的信息,找到油菜表达的转录组数据库,获得其SRX号以及表达数据(N);其次,在SRA的BLAST页面中,将备选的基因序列与SRX进行比对,表达量选择参数为:Max target sequences=20 000、Expect threshold=0.000 000 000 1、indenity>100%,从而选择出该基因的表达数据(N1);最后,计算FPKM(Fragments per kilobase of exon model per million mapped reads)值,FPKM=N1×105/N。
1.3 启动子克隆
1.3.1 DNA提取 将油菜种子点播于营养土[V(基质)∶V(珍珠岩)∶V(蛭石)=3∶1∶1]中,待其生长20 d左右,用CTAB法[18]提取叶片的DNA。
1.3.2 引物设计及基因克隆 参考拟南芥油体蛋白在种子及其他组织的表达模式,在油菜数据库寻找甘蓝型油菜的同源基因。根据这些同源基因的序列,利用甘蓝型油菜转录组数据库资料,分析相应基因在不同组织中的表达水平。选择种子特异表达且表达量最高的一个基因或重复基因,找到该基因的上游序列位置,在其末端与该基因起始密码子的区段内设计引物BnOA03-F/R(所涉及引物信息详见表1)。以所提取的油菜DNA为模板进行扩增,反应体系为:在50 μL的体系中加入1.5 μL油菜DNA,4 μL dNTP,10 μL 5×PS Buffer,0.5 μL Primer star,31.5 μL超纯水以及1.5 μL BnOA03-F/R引物。经过95 ℃预变性4 min后,95 ℃变性30 s ,57 ℃ 30 s,72 ℃延伸1 min 30 s,35个循环,72 ℃再延伸5 min。10 g/L琼脂糖凝胶电泳,经紫外显影显示PCR产物与目标片段大小一致。用凝胶回收试剂盒回收PCR产物,再经HindⅢ和XbaⅠ双酶切回收产物和PMD19-T后,进行T4连接和大肠杆菌转化,最后进行菌体PCR,选择符合要求的菌液提取质粒进行测序。
1.4 启动子序列分析
将克隆的启动子PBnOA03的序列在启动子在线分析软件PLACE(https://sogo.dna.affrc.go.jp/cgi-bin/sogo.cgi?lang=en&pj=640& action=page&page=newplace)上进行分析,并对分析得到的顺式作用元件进行分类总结。
1.5 表达载体构建
对经过测序的质粒和表达载体pBI121进行HindⅢ和XbaⅠ双酶切处理,37℃酶切4 h,分别回收质粒和表达载体pBI121的酶切产物。利用T4DNA连接酶连接,反应体系为:1 μL 回收启动子质粒片段,6 μL回收pBI121片段,2 μL 5×T4Buffer,1 μL T4连接酶,在PCR中25 ℃反应10 min。然后用热激法进行大肠杆菌DH5α转化。从过夜培养的平板中挑取单克隆于1 mL含有50 mg/L的卡那霉素液体LB培养基中培养。以单克隆的菌液为模板,用BnOA03-Fy/Ry引物进行PCR扩增鉴定。然后将正确菌液扩繁提取质粒,经冻融法将质粒转入农杆菌GV3101感受态细胞中,经验证引物BnOA03-Fy/Ry检测后,用于遗传转化。
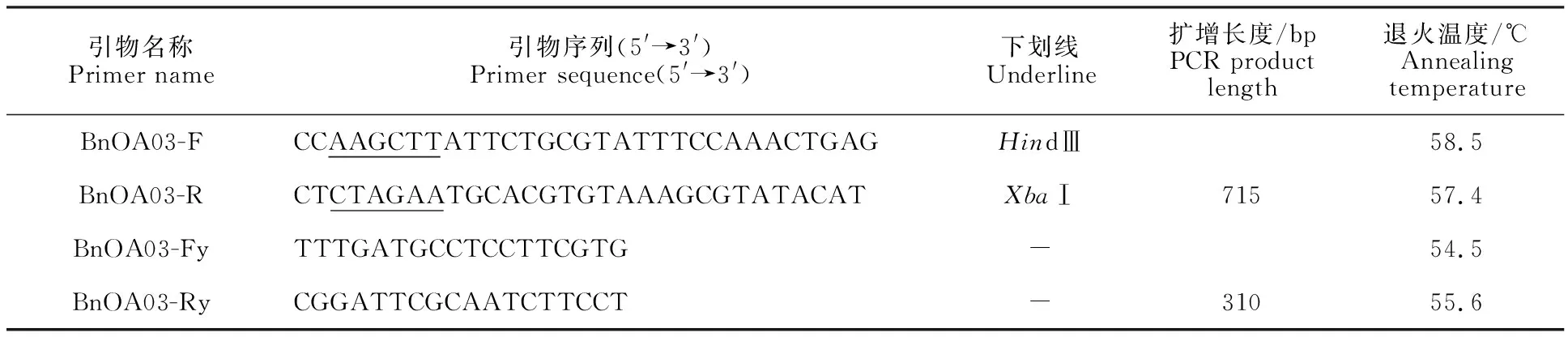
表1 PCR引物序列Table 1 PCR primer sequences
1.6 拟南芥转化及阳性苗鉴定
采用蘸花法转化拟南芥(方法参考Clough等[19])。转化大约25 d后收取种子,将收获的T1代种子消毒后撒播至含有50 mg/L的卡那霉素的1/2 MS平板上,一周后筛选阳性苗,移栽至营养土中,置于22 ℃,16/8 h光周期的培养室进行生长。
待植株正常生长至抽薹时,用CTAB法提取叶片DNA,用BnOA03-Fy/Ry引物进行PCR扩增,以确定转基因阳性植株。
1.7 转基因阳性植株GUS染色
将T1代植株收获的种子在含有卡那霉素的1/2 MS培养基上撒播,观察生长,选择有3∶1分离比的单位点插入转基因株系用于后续研究。将挑选的转基因阳性植株转移至营养土,分别取其萌发5 d的幼苗,开花时期的茎、茎生叶、莲座叶和花,以及生长至成熟阶段的种子,分别为开花后4、7、11、15、18、21 d的角果,对这些组织进行GUS染色。另外选择实验室带有GUS报告基因的转基因拟南芥材料作为阳性对照。染色液成分为:50 mmol/L NaPO4(pH=7.2),0.5 mmol/L K3Fe(CN)6,0.5 mmol/L K4Fe(CN)6,2 mmol/L X-Gluc。GUS染色方法参见 Jefferson等[20]方法,用体式显微镜观察拟南芥不同组织的GUS染色情况并拍照。
2 结果与分析
2.1 甘蓝型油菜油体蛋白的表达模式分析
在拟南芥的15个油体蛋白中有11个油体蛋白基因的表达模式可以搜索到。对这11个油体蛋白进行分类分析,发现有3种类型,种子特异、非种子特异以及组成型表达。参考拟南芥油体蛋白的表达模式,选择不同类型的油体蛋白进行分析。为了简洁,本文仅列出几个有代表性的油体蛋白的结果。拟南芥OLE(AT2G25890)在种子中表达较高且在其他组织中也有表达,它在甘蓝型油菜中存在2个同源基因,分别命名为 BnOA04和 BnOC04;拟南芥OLE(AT5G56100)在根、茎、叶和种子中都有较高表达,它在甘蓝型油菜中存在2个同源基因,分别命名为 BnOA02、BnOC02;拟南芥OLE(AT3G01570)是一个种子特异表达的油体蛋白,它在甘蓝型油菜中存在2个同源基因,分别命名为 BnOA03、 BnOC03。根据它们的编码区序列,分析这些同源基因在油菜组织中的表达量,结果见图1。图1-A中的数据来源于对甘蓝型油菜种子不同发育时期研究的4个数据库。从图1-A可以看出,基因 BnOA03的表达量在授粉后2周开始成倍增加,在第6周达到最高,6周之后虽然表达量下降,但是其表达水平较其他基因依然较高;其同源基因 BnOC03的表达趋势与其一致,但是表达量稍低于 BnOA03。其余基因在种子整个发育时期表达量都较低。图1-B中子叶和叶片的数据来源于3个数据库,根的数据来源于一个数据库。从图1-B中可以看出,油菜油体蛋白基因在根、子叶和叶片中的表达量都较低,甚至不表达。根据表达量分析结果,最终本研究选择 BnOA03油体蛋白基因为目标基因。
2.2 启动子克隆及序列分析
以所提取的油菜DNA为模板,利用引物BnOA03-F/R进行扩增。10 g/L琼脂糖凝胶电泳结果见图2-A,PCR产物为715 bp,其结果与油菜数据库获得的片段大小一致。该启动子命名为PBnOA03。

A.油体蛋白基因在油菜种子授粉后不同时间的表达量 The expression of oleosin gene at different time after pollination of Brassica napus;B.油体蛋白基因在油菜不同组织中的表达量 The expression of oleosin gene at different tissues of Brassica napus
对启动子序列进行在线分析,结果见图3和表2。PBnOA03启动子中含有水稻胚乳特异性表达顺式调控元件Skn-1基序[21]、ABRE应答元件[22]、对转录起始有重要作用的TATA-BOX[23]、与储藏蛋白基因有关的E-BOX[15]和与激素调节有关的W-BOX[22]等顺式元件。CAAT-BOX对基因的转录起到很强的激活作用[24],也可以通过与其他顺势作用元件的协同来达到调控基因高效表达的作用。除此之外,PBnOA03启动子中还存在与种子特异性相关的顺式元件RY-motif[14]、与光效应有关的G-BOX和T-BOX顺式元件[16]。启动子中存在的这些顺式元件,将为今后研究该启动子的调控提供重要的信息。

A:PCR扩增启动子PBnOA03片段 Fragment of PBnOA03 promoter amplified by PCR;M.DNA marker 5000; 1.PCR扩增启动子PBnOA03片段 Fragment of PBnOA03 promoter amplified by PCR) B:PCR扩增筛选阳性克隆电泳图 PCR screen of positive clones;M.DNA marker 2000; 1-2.挑选的阳性克隆菌落PCR产物 PCR products of positive clones; P.质粒对照 Plasmid
2.3 植物表达载体构建及拟南芥转化
对连接启动子序列的中间载体PMD19-T和pBI121进行双酶切,分别回收酶切产物,利用T4DNA连接酶连接,然后用热激法进行大肠杆菌DH5α转化,并进行单克隆菌落PCR鉴定。经电泳检测显示PBnOA03启动子成功连入pBI121(图2-B)。经测序确认后,转入农杆菌GV3101感受态细胞,重组载体图如图4-A。验证后进行拟南芥转化。经过抗性培养基筛选得到37株T1代转基因植株,提取筛选到的这些植株叶片DNA,利用BnOA03-Fy/Ry引物进行PCR检测。以质粒为阳性对照,野生型拟南芥DNA为阴性对照。检测结果见图4-B。
根据上图PCR的结果显示,筛选转基因阳性苗。
2.4 启动子功能分析
对8个T1代株系的叶片、茎、花器和发育种子进行初步GUS染色。结果表明,在营养器官和花器中均无GUS染色,而在种子发育中后期有GUS染色,表明该启动子具有活性。进一步对试验中得到的T2转基因株系进行系统的GUS染色。结果显示,在培养基上生长了5 d的幼苗(图5-B)中的各个部位都没有发现GUS基因的明显表达(以5 d幼苗为阳性对照如图5-A);在茎(图5-C)、茎生叶(图5-D)、莲座叶(图5-E)、花(图5-F)中没有发现GUS染色,其中花器的雌蕊柱头部分、花瓣和雄蕊的花药、花丝也没有发现GUS染色信号。

红色代表Skn-1基序 Red represents Skn-1motif; 棕色代表ABRE Brown represents ABRE; 蓝色代表G-BOX Blue represents G-BOX; 绿色代表GTGA-motif Green represents GTGA-motif; 橙色代表T-box Orange represents T-box ; 紫色代表CAAT-BOX Purple represents CAAT-BOX; 粉色代表RY-motif Pink represents RY-motif; 黄色代表W-BOX Yellow represents W-BOX; 灰色代表TATA-BOX Gray represents TATA-BOX

表2 PBnOA03启动子的表达元件分析Table 2 Analysis of regulatory elements in PBnOA03 promoter

A:PBnOA03∶∶GUS 载体结构 Construction of PBnOA03∶∶GUS B:PBnOA03启动子T1转基因植株PCR检测 Identification of PBnOA03 promoter T1 transgenic plants by PCR;1.转化苗 Transgenic plants; W.野生型对照 Wild type;P.质粒对照 Plasmid; M.DNA marker 2000

A.5 d幼苗(对照) 5 days old plant(CK); B.5 d幼苗 5 days old plant; C.茎 Stem; D.茎生叶 Leaf of stem; E.花 Flower; F.莲座叶 Rosette leaf; G.开花后4 d角果 4 days after flower of silique; H.开花后7 d种子 7 days after flower of seed; I.开花后11 d种子 11 days after flower of seed; J.开花后15 d种子 15 days after flower of seed; K.开花后18 d种子 18 days after flower of seed; L.开花后21 d种子 21 days after flower of seed
不同时期角果的GUS染色结果中表明,野生型在各个时期都未检测到背景GUS染色;在转化启动子的材料中,开花后4 d的种荚和株柄(图5-G)没有GUS染色,在开花后7 d的种荚中剥离的种子(图5-H)也没有发现有GUS染色;在开花后11 d的角果中,种荚和株柄没有染色,而在剥离的种子(图5-I)中发现有GUS的浅着色;开花后15 d的角果中,种荚和株柄都没有染色,在种子中(图5-J)可以检测到有明显GUS染色;开花后18 d的角果中,种荚和株柄均没有染色,而在种子中(图5-K)发现较深的GUS染色;开花后21 d的角果中,种荚、株柄和种子中(图5-L)都没有检测到GUS染色信号。这些染色结果与T1代阳性植株的染色结果一致。这些结果表明PBnOA03启动子是一个在种子发育中后期进行启动基因表达的种子特异性启动子。
3 讨 论
本试验中共得到8个转基因系,对得到的转基因系的T1代植株幼叶和不同发育时期的种子进行GUS染色,在叶片等组织中没有发现GUS染色,而在种子发育的中后期检测到GUS染色。在得到的8个转基因系中有7个系在种子开花后的11、15、18 d中能检测到逐渐增强的GUS基因活性,其中,2个系在开花后21 d还可以检测到有部分的GUS染色信号。在T2代时各组织和种子的GUS活性检测与T1代一致。这与之前分析的基因在油菜授粉后不同周期的种子中的表达趋势一致。
但在本研究中,GUS基因活性在种子开花后11 d时开始有信号,但信号不强,到18 d有信号增强的过程。然而,拟南芥种子在发育的过程中,开花后11~15 d时,是其合成油脂和储藏物质的主要阶段。也就是说,该启动子在拟南芥上表达的高峰相对油菜来讲,出现延迟表达的情况。本研究中,分析出现这种的情况的原因可能有:(1)拟南芥和油菜虽均属十字花科、有一定的亲缘关系,但是随着植物发生进化,拟南芥属于阿拉伯属,而油菜属于芸薹属。此外,油菜在进化时基因组远较拟南芥复杂[25]。(2)油菜种子在授粉后50 d 左右获得成熟种子,而拟南芥在开花后23 d左右就可以获得成熟种子,拟南芥的发育周期为油菜的一半,而本试验参照油菜的发育周期构建的启动子,在容易转化的拟南芥上进行验证,这可能是表达时期出现延后的原因之一[25]。(3)本试验所构建的启动子约700 bp。在克隆启动子时,完整的克隆了基因上游直到另一个基因的全部序列。但考虑到基因的表达调控是一个非常复杂的过程,不能排除启动子序列之外还存在其他的辅助调控序列,这些序列有可能对该基因的表达有修饰作用。在进行该启动子的后续研究中,可尝试在其他植物上进行验证分析,例如,克隆油菜基因的启动子选择烟草[14]来验证,它的种子成熟的周期与油菜大体相近,为授粉后的40 d 左右,或者用油菜[26]本身来验证,这些后续研究将有助于分析出现这一情况的原因。

