通江产辣木叶总黄酮的提取工艺优化及含量测定
刘 宇,俸 丹,陈 云,朱 蕊,马裔寒,李霞辉,舒 刚
(四川农业大学动物医学院,成都 610000)
辣木(MoringaoleiferaLam.)属小乔木植物,原产于印度,因具有耐干旱、生长迅速、营养丰富的特点,有“奇迹之树”之称[1-2]。大量试验表明,辣木是一种优质的蛋白质饲料、健康绿色的保健食品、药食同源的植物[3],在天然产物越来越受关注的当今,进行辣木的研究具有较大的价值。辣木的叶为三回羽状复叶,小叶卵形、短椭圆或椭圆,因其资源丰富、采集方便、加工简单,所以是辣木研究最多且最早的部位,我国卫生部在2012年批准辣木叶为新资源食品[4-5]。目前,国外开展的辣木叶研究中发现辣木叶中含有丰富的药用成分和营养物质,如黄酮类物质、多糖和水溶性蛋白等,并且具有多种生物活性,包括降低胆固醇、抗糖尿病、抗胃溃疡和抗肿瘤等,同时用于心血管、炎症和肝脏疾病的治疗[6-7]。黄酮类化合物具有多种生物学功能,如清除自由基、抑菌、抗病毒、抗氧化、抗肿瘤和抗癌等,且对于肝病、心血管疾病均有一定的疗效,对细胞凋亡产生抑制或促进的作用,对畜禽生产也有良好的促进功能[8-9]。有文献报道,辣木叶的醇提物或水提物有显著的生物活性,正是因为提取液中含有丰富的黄酮类化合物和多酚类[10]。黄酮类化合物的诸多生物活性促使其在食品、医药、化妆品等工业中均有广泛的应用[11]。
1 材 料
1.1 主要药品 试验所用的8、9、10月的辣木叶均采自于四川省通江,经四川农业大学动物医学院药学系李丽霞老师鉴定为辣木属植物。芦丁标准品(购自成都瑞芬思生物科技有限公司)、分析纯无水乙醇、分析纯亚硝酸钠、分析纯硝酸铝、分析纯氢氧化钠。
1.2 主要仪器 101A-4型电热鼓风干燥箱、RH-800型高速多功能粉碎机、DF-101S集热式恒温加热磁力搅拌器、ESJ200-4A电子天平(北京Sartorius天平有限公司)、SC-3614低速离心机、UV2000型紫外可见分光光度计(上海天美科学仪器有限公司)
2 方法与结果
2.1 辣木叶总黄酮的提取
2.1.1 芦丁标准曲线的绘制 按照王苗苗[12]绘制芦丁标准曲线的方法来绘制芦丁标准曲线。根据各浓度芦丁对应的吸光值,计算得到标准曲线Y=10.308X-0.0054,相关系数R2=0.9994。
2.1.2 辣木叶总黄酮的提取流程 干燥→粉碎→浸渍提取→离心→含量测定
将新鲜的辣木叶放于干燥箱中干燥24 h,干燥后的辣木叶用粉碎机粉碎并过60目筛。准确称取1 g辣木叶粉放入烧杯中,加入磁力搅拌子和一定量配置好的乙醇溶液,用保鲜膜将烧杯密封,防止乙醇溶液挥发,待磁力搅拌器达到需要的温度后,将装好药品的烧杯放入磁力搅拌器的水浴环境中,调节转速进行提取,并计时。将提取液转移到离心管中,于4000 r/min下离心10 min。离心完毕后,取离心管中的上清液于容量瓶中配置待测溶液,按照绘制标准曲线时的方法测定吸光度,计算总黄酮提取率。
2.1.3 辣木叶总黄酮提取率的测定 准确吸取1 mL辣木叶总黄酮的提取液,放入10 mL的容量瓶中,先加入 0.3 mL 5% NaNO2溶液,混匀后静置6 min;加入0.3 mL10%Al(NO3)3溶液,混匀并静置6 min;加入4 mL 4% NaOH溶液摇匀,用提取溶剂将其定容至刻度,混匀后静置15 min,按照制作芦丁标准曲线的方法测定吸光度。将测得的吸光度值带入回归方程中,计算出原提取液中总黄酮的质量浓度(C),测量得到辣木提取液体积(V),并计算出辣木叶中总黄酮的提取率。
辣木叶中总黄酮提取率%=C×V×N÷M×100
其中:C为原提取液总黄酮的质量浓度(mg/mL);V为提取液的总体积(mL);N为稀释倍数;M为称取的辣木叶粉质量(mg)。
2.2 单因素试验 在保持温度、乙醇浓度、料液比、提取时间一致的条件下,分别考察不同乙醇浓度(50%、60%、70%、80%、90%)、不同溶剂用量(20倍、25倍、30倍、35倍、40倍)、不同提取时间(10 min、20 min、30 min、40 min、50 min)、不同提取温度(30 ℃、40 ℃、50 ℃、60 ℃、70 ℃)四个因素对辣木叶总黄酮得率的影响情况,确定四个单因素的适宜水平。
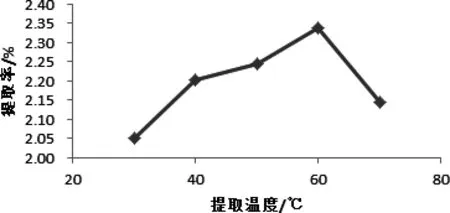
图1 温度对辣木叶总黄酮提取率的影响Fig 1 temperature on the total flavonoids Moringa leaf extraction rate
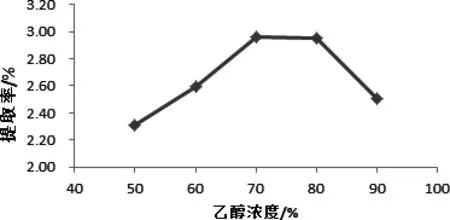
图2 乙醇浓度对辣木叶总黄酮提取率的影响Fig 2 ethanol concentration on the total flavonoids Moringa leaf extraction rate
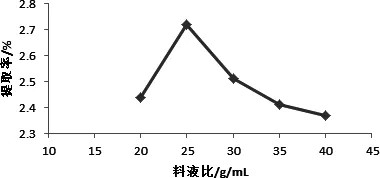
图3 料液比对辣木叶总黄酮提取率的影响Fig 3 Effect of liquor-liquid ratio on the extraction rate of total flavonoids from Moringa leaves
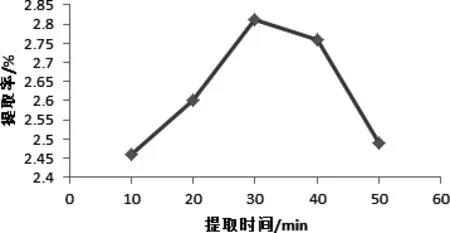
图4 提取时间对辣木叶总黄酮提取率的影响Fig 4 extraction time on the total flavonoids Moringa leaf extraction rate
2.2.1 温度对辣木叶总黄酮提取率的影响 由图1可知,随着提取温度的升高,辣木叶总黄酮提取率呈上身的趋势,在60 ℃时提取率达到最大,因为温度升高,有利于有效成分的溶出。当提取温度过高时,可能会导致大量总黄酮化合物之外的醇溶性杂质也溶解加速,使辣木叶总黄酮在乙醇溶液中的溶解度降低,因此导致辣木叶总黄酮提取率降低。此外,黄酮类化合物本身易被氧化,特别是在高氧高温的环境下,黄酮类化合物结构更易被氧化破坏,这也在一定程度上导致了辣木叶黄酮类提取率降低[13]。
2.2.2 乙醇浓度对辣木叶总黄酮提取率的影响 由图2可知,乙醇浓度在50%到70%之间时,辣木叶总黄酮提取率逐渐上升,因为黄酮类化合物主要是以黄酮糖苷的形式存在,黄酮糖苷由糖和甙元形成,其中糖易溶于水,而甙元不易溶于水,由“相似相溶”原理可知,当乙醇与水的比例适宜时,提取率可达到最大值[14]。乙醇浓度在70%-80%之间基本持平,表明在这一范围内的乙醇浓度与辣木叶总黄酮的极性相似。当乙醇浓度增加到80%后,总黄酮的提取率呈下降趋势,因为乙醇浓度过高,反而会导致色素、醇溶性杂质和亲脂性强的成分的溶出量增加,干扰因素也随之增大,导致辣木叶总黄酮的提取率不升反降[15]。
2.2.3 料液比对辣木叶总黄酮提取率的影响 由图3可知,随着液料比的增大,辣木叶总黄酮的提取率上升,当液料比持续增大,提取率反而降低。因为增大料液比可以增加辣木叶粉与乙醇溶剂之间的浓度差及接触面积,黄酮类化合物向溶剂中转移的扩散系数增大,从而使提取率增加[16]。料液比过大时,与有效成分无关的杂质也更易于溶出,导致提取率逐渐下降。
2.2.4 提取时间对辣木叶总黄酮提取率的影响 由图4可知,随着提取时间的增加,辣木叶总黄酮的提取率呈先增大后逐渐降低的趋势,当提取时间为30 min时达到最大值。因为增加提取时间,有利于辣木叶总黄酮在乙醇溶液中的溶解,提高其提取率,随着提取时间的延长,一方面会导致其他醇溶性杂质也被溶解提取,阻碍黄酮类化合物的溶出,另一方面也会增加辣木叶总黄酮被氧化的可能性,导致提取率降低[17]。因此,需要对提取时间加以控制。
2.3 辣木叶总黄酮提取的响应面优化试验
2.3.1 辣木叶总黄酮提取的响应面优化试验方案设计 试验采用Design-Expert8.0.6.1软件中的Box-Behnken design设计原理,以提取时间、料液比、乙醇浓度和提取温度4个因素为自变量,总黄酮提取率为响应值设计试验,并在最优提取条件下对优化结果进行验证试验。Box-Behnken试验因素及水平编码值见表1,试验设计编排组合见表2。

表1 辣木叶总黄酮提取率响应面试验因素水平编码Tab 1 Moringa leaf total flavonoid extraction response surface test factor level coding
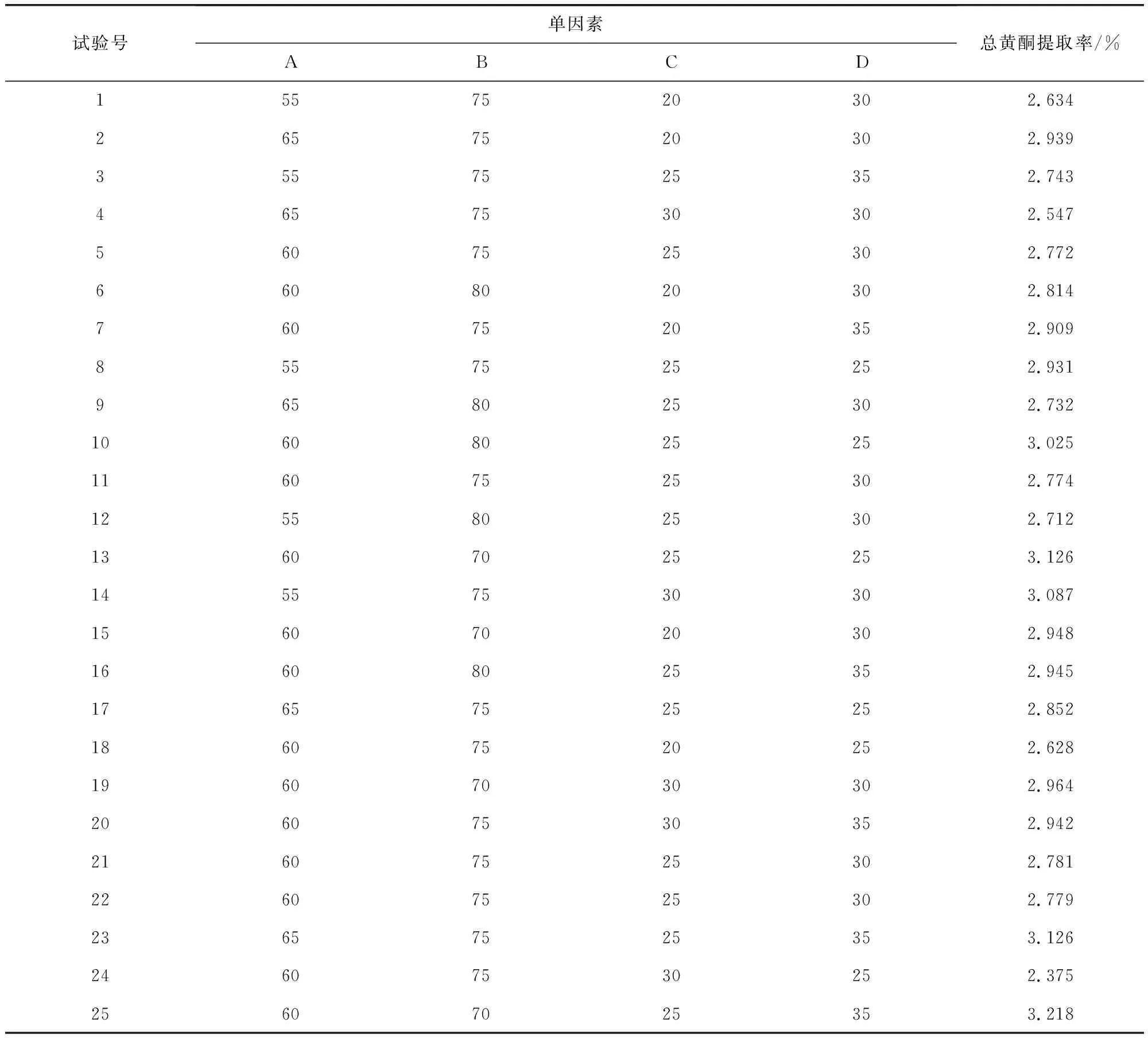
表2 辣木叶总黄酮提取率响应面试验设计与结果Tab 2 Moringa leaf flavonoids extraction rate response surface test design and results
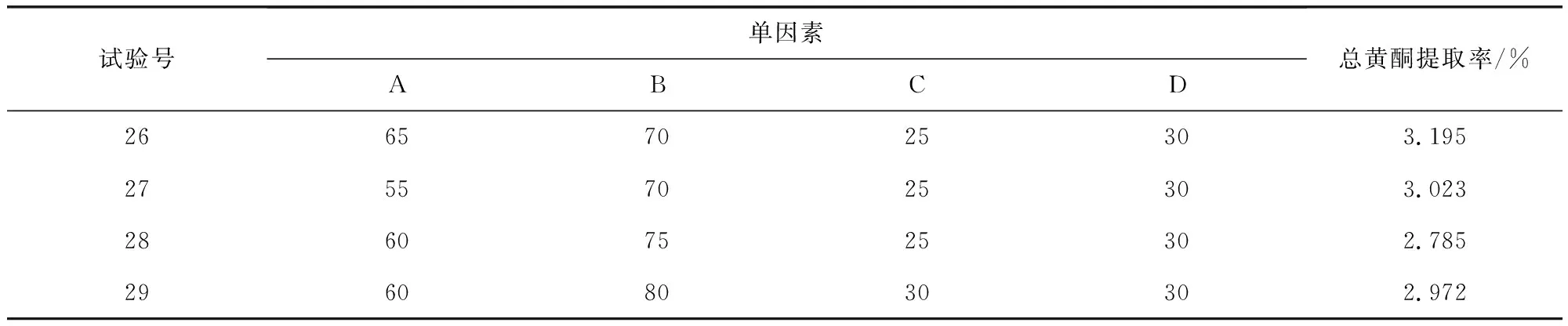
续表
2.3.2 辣木叶总黄酮提取的响应面法优化分析 采用响应面分析法进行试验结果分析,得到以总黄酮提取率为响应值的回归方程:Y=+2.78+0.013*A-0.11*B+0.060*C+0.037*D-0.038*A*B-0.086*A*C+0.12*A*D+0.060*B*C-0.043*B*D-3.500E-003*C*D+0.027*A2+0.15* B2-0.018*C2+0.11* D2,其中Y为总黄酮提取率(%), A为温度(℃), B为乙醇浓度(%), C为液料比(g/mL), D时间(min) 。
对试验数据进行方差分析(表3)可知,模型P<0.05,差异显著,说明模型对试验拟合情况较好,可以用该模型来预测不同提取条件下的总黄酮提取率。B、B2显著, AD、D2显著,说明各因素对响应值并不仅仅是简单的线性关系,且影响辣木叶总黄酮提取率的因素主次为:浓度(B)>时间(D)>温度(A)>料液比(C)。为了更加直观地反映出因素之间的交互作用对响应值的影响情况,利用软件Design-Expert8.0.6.1绘制三维响应面图来进一步分析各因素和响应值之间的相互影响关系。
由图5可以看出,乙醇浓度和提取时间的交互作用对总黄酮提取率的影响表现为显著水平,当乙醇浓度和提取时间逐渐下降时,辣木叶总黄酮的提取率呈上升趋势。因此,当选择较低的乙醇浓度和较短的提取时间即可得到较高的总黄酮得率。
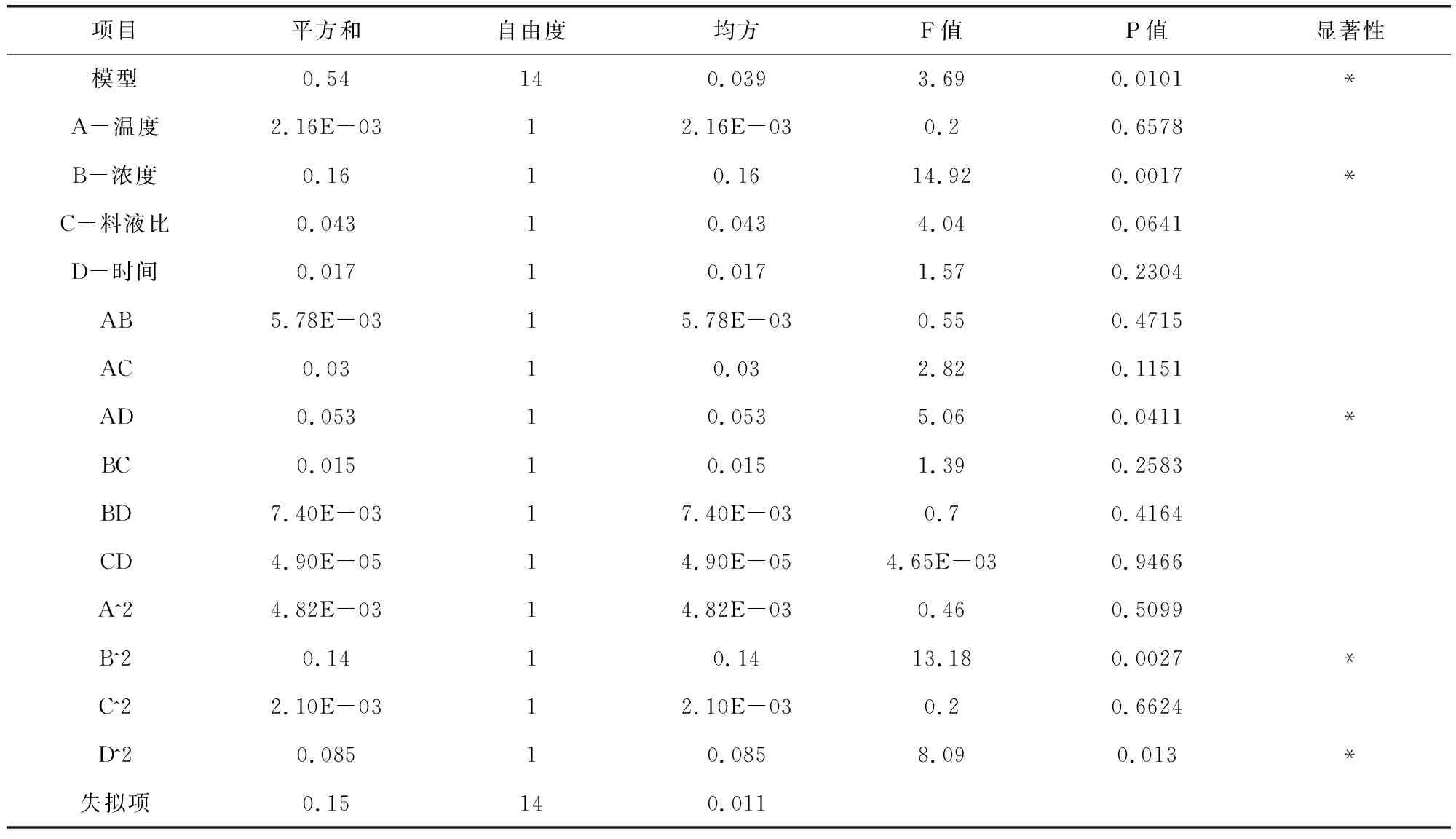
表3 响应面法ANOVA 分析结果Tab 3 Response surface ANOVA analysis results
*表示差异显著,P<0.05;**表示差异极显著,P<0.01
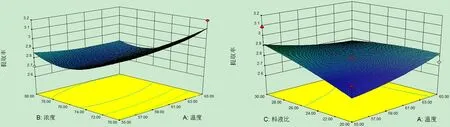
A 提取温度与乙醇浓度 B提取温度与料液比
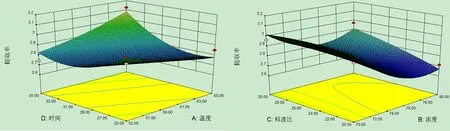
C提取温度与提取时间 D提取浓度与料液比
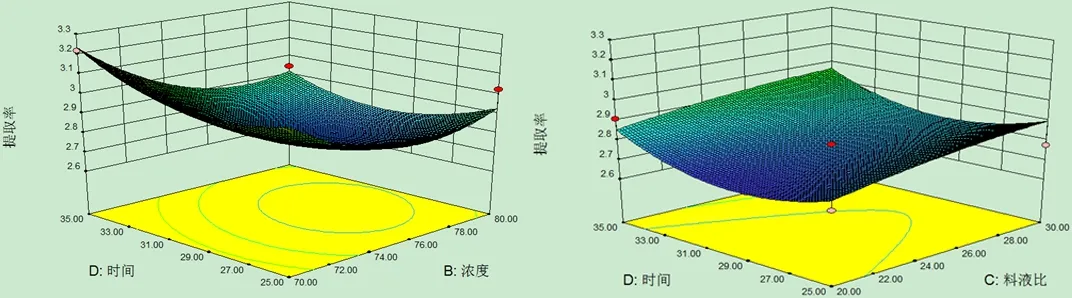
E提取浓度与提取时间 F料液比与提取时间
2.4 试验验证及结果 利用Design-Expert8.0.6.1软件建立的数学模型,得到1个最优的工艺条件,在此条件下进行验证试验,验证最优提取工艺条件的准确性。验证结果:利用响应面分析软件建立数学模型,得到1个理想的工艺条件。即在料液比1∶30(g/mL)、提取时间30 min、提取温度55 ℃ 、乙醇浓度75%的条件下,辣木叶总黄酮的理论提取率为2.919%。对理想提取工艺条件进行验证,得到辣木叶总黄酮提取率实测值可达3.018%,表明浸渍法提取辣木叶总黄酮具有一定的可行性。
2.5 各个月份辣木叶总黄酮含量的测定 在最佳提取工艺条件下测定8、9、10月通江产辣木叶总黄酮含量,分析各个月份的辣木叶总黄酮含量差异,以得出辣木叶采摘的最佳时间。即在料液比1∶30 (g/mL)、提取时间30 min、提取温度 55℃ 、乙醇浓度75%的最佳提取工艺条件下,对8、9、10月通江产辣木叶总黄酮含量进行测定分析。结果如图6,且8、9、10月采摘的辣木叶总黄酮提取率呈上升趋势,10月提取率最大。
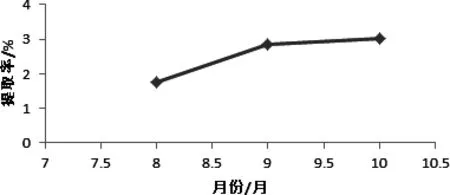
图6 不同月份辣木叶总黄酮提取率Fig 6 different months Moringa leaf flavonoids extraction rate
3 讨论与结论
3.1 提取工艺优化 该研究利用浸渍法提取辣木叶总黄酮,同时采用响应面法对辣木叶总黄酮的提取工艺参数进行优化,最后利用方差分析得出了各个因素对辣木叶总黄酮提取率的影响主次为:浓度(B)>时间(D)>温度(A)>料液比(C),同时表明乙醇浓度和提取时间对总黄酮的得率影响存在显著的交互作用。吉莉莉[14]采用微波萃取法考察微波功率、液料比、乙醇浓度和提取时间等因素对辣木叶总黄酮提取率的影响情况,得到了各因素对总黄酮得率的影响大小排序:微波功率>醇浓度>提取时间>液料比,其中乙醇浓度和提取时间对辣木叶总黄酮提取率的影响也较大。陈瑞娇等[18]采用乙醇提取的方法对辣木叶总黄酮的提取工艺进行了优化研究,得出了辣木叶总黄酮的最佳提取工艺条件:提取 3 次、每次 1 h、乙醇溶液70%、提取温度 60 ℃、料液比 1∶20,在此条件下辣木叶的提取液的总黄酮含量可达 3.95 %。与陈瑞娇的试验结果相比,该试验采用的浸渍法缩短了提取时间,减少了工作量,节约了材料。对于提取率,该试验的提取率有所降低,可能的原因是试验中使用的辣木叶的产地不同。
初雅洁[19]对云南不同产地的辣木叶成分进行分析比较发现,不同地区辣木叶中均含有黄酮和多酚类活性物质,且含量差异明显,说明辣木叶总黄酮的含量与产地有关。该试验所用的辣木叶均采自四川省通江,由此表明通江地区种植的辣木的叶子中,总黄酮含量低于其它部分地区种植的辣木的叶中总黄酮含量。
通过试验验证,得出在料液比1∶30 (g/mL)、提取时间30 min、提取温度55 ℃ 、乙醇浓度75%条件下,辣木叶总黄酮提取率的实测值为3.018%,且响应面的模型与实际的验证结果之间拟合情况良好,可为更好地开发并利用辣木叶总黄酮提供了参考依据。
3.2 不同月份辣木叶总黄酮含量分析 利用最佳提取工艺,分别提取8、9、10月在四川省通江地区采摘的辣木叶中的总黄酮。得到10月采摘的辣木叶总黄酮提取率最高,因通江种植的辣木的叶在8、9、10月生长最为旺盛,且测定结果表明10月的辣木叶总黄酮提取率最大,说明在10月采摘辣木叶较为合理。为辣木的种植地区和辣木叶的采摘时间提供了一定的参考依据,可以有效提高四川省通江地区辣木产业的经济效益,推动辣木产业的发展。

