复合调理剂对栽培基质性能及蔬菜生长的影响
范如芹, 罗 佳, 张振华
(1.农业部农业环境重点实验室,北京 100081; 2.江苏省农业科学院农业资源与环境研究所,江苏 南京 210014)
泥炭是传统的优良基质原料,在国内外基质生产中应用十分广泛。但是泥炭是世界珍贵的短期不可再生资源,随着近几十年来的大规模开采,泥炭资源正面临枯竭,且价格不断升高,导致泥炭原料基质生产成本大大增加,因此,寻求可再生的廉价优质泥炭替代资源成为世界范围内亟待解决的重要课题[1-4]。到目前为止所选用替代材料中具有一定应用价值的有作物秸秆、畜禽粪便、园艺废弃物、绿肥、菇渣等农业废弃物,发酵床垫料堆肥也是其中之一[5]。然而,由于农业废弃物来源复杂,前处理技术水平较低,标准化的生产工艺落后等缺陷,目前此类基质普遍存在持水性差、养分保蓄能力差、容重大、易板结、孔隙性差等问题,且原料中含大量畜禽粪尿等成分时,基质电导率往往偏高,易烧苗,不能用于盐分敏感作物的育苗或栽培[4, 6]。鉴于这种现状,通过基质调理剂的添加改善其性能,成为利用农业废弃物替代泥炭的重要途径之一,也是该领域的一个研究热点。
高吸水树脂(Super absorbent polymer, SAP)分子本身带有大量强吸水性基团,因而具有高吸水性和保水性,可延缓植株的萎蔫发生时间,提高植株的水分利用率。前期大量研究结果证明,在发酵茶垫料为主料的栽培基质中,0.8 g/L的SAP 添加可有效提高基质保水性能且对基质空隙度不产生副作用[7];生物炭对基质保水保肥、通气透水、作物养分吸收等均具有明显的促进作用,但添加后电导率有上升趋势,因此对盐分敏感的作物易产生盐害[4,8-9];硅藻土是一种重要的非金属矿物,主要由地质演化形成的硅藻遗体组成,其独特的物理和化学性质使得硅藻土在工业上已经得到广泛的应用。硅藻土作为蔬菜及园艺无土栽培基质的应用也引起人们的重视,在澳大利亚和美国已经有园艺工作者将硅藻土粉与硅藻土颗粒作为栽培基质种植花卉和蔬菜,并已取得很好的效果[10],而国内运用硅藻土作为设施基质栽培的研究极少。硅藻土硬度低,微孔结构发达,使得其有较小的密度和很大的比表面积,具有较强的吸附作用,因而用作基质添加剂吸附养分离子以降低盐害具有一定潜力[11-12]。可以说,这些材料在基质性能改良及促进作物生长等方面已初步展现可观效果[13-14]。但是,单一调理剂往往只能针对基质一种理化指标有改善效果,且某些调理剂在改善一个指标的同时会对基质其他指标有负面作用,针对基质存在的多方面的性能缺陷,复合调理剂的研究非常有必要。因此,本研究综合运用SAP、生物炭、硅藻土等材料组成复合调理剂,研究其对基质理化性状及作物生长的影响具有重要的理论和实际意义。
1 材料与方法
1.1 试验材料
所用基质配方为发酵床垫料堆肥∶蛭石∶珍珠岩∶泥炭=3∶2∶3∶2(体积比),其总氮、总磷、总钾及速效氮、速效磷、速效钾养分含量分别为24.2 g/kg、8.62 g/kg、10.1 g/kg、1.94 g/kg、2.41 g/kg和5.99 g/kg。蛭石、珍珠岩和泥炭的最大持水量分别为:53.9%、31.4%和31.7%。调理剂包括SAP、生物炭和硅藻土,SAP来自江苏省农业科学院农业设施与装备研究所,是以改性后的可溶性玉米淀粉为主要原料,丙烯酸和丙烯酰胺为接枝单体,采用水溶液聚合法制备的耐盐性钾型丙烯酸类高吸水树脂,外观为白色粉末,粒度为60~100目,容质量为0.6~0.8 g/cm3,吸去离子水量为800~1 000 g/g,吸水速率小于30 s,pH值为6.9~7.3,电导率为4.0~5.0 dS/m;生物炭为小麦秸秆在600 ℃高温下厌氧裂解得到,其容重、持水量、pH和电导率分别为0.31 g/cm3、139%、9.98和1.03 dS/m,颗粒大小均在2 mm以下,碳和氮含量分别为79.3%和0.97%;硅藻土pH、电导率、容重分别为6.29、0.003 dS/m和0.56 g/cm3。
1.2 试验设计
为了研究具有保水、保肥、降盐、增效等功能的基质复合调理剂,确保在尽可能提高发酵床垫料(Spent pig litter compost, SPLC)比例,降低泥炭使用量的前提下,提高基质产品品质。试验设置以下4个基质配方(F1~F4),其中第一个配方F1是经过大量研究结果和实践证明了的成功配方,8个调理剂配方,共32个组合处理,每个处理3个重复。进行基质理化性能调控,同时通过空心菜的育苗和栽培来验证调理剂功效。
基质配方(体积比)如下:F1:发酵床垫料堆肥(SPLC)∶泥炭∶蛭石∶珍珠岩=3∶3∶2∶2;F2:发酵床垫料堆肥(SPLC)∶泥炭∶蛭石∶珍珠岩=4∶2∶2∶2;F3:发酵床垫料堆肥(SPLC)∶泥炭∶蛭石∶珍珠岩=5∶1∶2∶2;F4:发酵床垫料堆肥(SPLC)∶泥炭∶蛭石∶珍珠岩=6∶0∶2∶2;调理剂配方(生物炭与硅藻土比例为体积百分比):CK: 0 SAP+0生物炭+0硅藻土;B10D10:10%生物炭+10%硅藻土;SB0D10:0.8 g/L SAP+10%硅藻土;SB10D0:0.8 g/L SAP+10%生物炭;SB5D5:0.8 g/L SAP+5%生物炭+5%硅藻土;SB5D10:0.8 g/L SAP+5%生物炭+10%硅藻土;SB10D5:0.8 g/L SAP+10%生物炭+5%硅藻土;SB10D10:0.8 g/L SAP+10%生物炭+10%硅藻土。
5月7号开始,上述基质配方添加不同调理剂配方后用于空心菜种植。空心菜用方形塑料盆(60 cm×50 cm×20 cm)种植,每盆种植3行,每行6穴,每穴播洒2粒空心菜种子。每个处理3个重复。塑料盆置于玻璃温室内(日均温26~29 ℃)随机区组摆放。空心菜种植7 d后测定出苗率。生长40 d左右达到商品空心菜大小时收获,并测定株高、茎粗、叶面积、最大根长、生物量、产量等各项指标。
1.3 测定方法
测定添加不同调理剂的基质理化指标,包括容重、总孔隙度、通气孔隙度、最大持水量、pH、EC、总氮、总磷、总钾及速效氮、速效磷、速效钾含量。基质与去离子水以体积比1∶5混合搅拌,静置8 d后用pH计和电导率仪测定pH和EC值;容重、最大持水量、总孔隙度及通气孔隙度等指标均参照澳大利亚基质测定标准(AS3743-2003)进行测定,具体为:取已知体积和质量的基质浸入去离子水中充分吸水后重力排水,此过程重复3次以确保基质吸水饱和,重力排水30 min,再次测定其体积及质量,然后放入烘箱105 ℃烘干7 d,再次称质量。用上述质量及体积计算容重、最大持水量、总孔隙度及通气孔隙度值。
1.4 数据统计分析
采用SPSS 11.5软件进行LSD显著性差异检验,用皮尔森(Pearson)相关系数进行相关关系分析,采用SigmaPlot 12.5软件进行作图。
2 结果与分析
2.1 复合调理剂对不同配方基质物理性状的影响
由表1可知,不加调理剂情况下,随着基质配方中发酵床垫料堆肥比例的增加和泥炭比例的降低,基质容重逐渐增加,F3配方基质显著高于F1(F1为研究团队经过大量试验验证的优良配方[15]),尤其发酵床垫料完全替代泥炭的配方基质(F4)容重是F1的1.64倍。添加不同调理剂后,各配方基质容重发生明显变化,其中F1与F2变化趋势一致,即除了SB10D5、SB5D5及SB10D0外,其他调理剂添加显著增加了基质容重,且SB10D0添加后容重最低,说明硅藻土的添加对容重有增大作用,这主要是因为硅藻土本身容重(0.56 g/cm3)较大造成的;SB10D5容重显著低于SB5D5,SB5D10容重也低于SB0D10说明生物炭添加有降低基质容重的作用。这与前人研究报道一致[16-18]。调理剂添加对F1配方基质容重降低作用最为明显,对其他配方基质容重影响不显著(P>0.05),其中F3及F4配方基质容重仍高于国际标准基质容重的理想值上限(0.4 g/cm3)[19]。
表1复合调理剂添加下不同基质配方容重
Table1Bulkdensityofsubstratesamendedwithcompositeconditioner

处理 容重 (g/cm3)F1F2F3F4CK0.36bc0.38b0.46b0.59aSB0D100.46a0.49a0.45ab0.61aSB5D100.43ab0.46ab0.50ab0.60aSB5D50.38b0.41b0.55a0.55bSB10D50.33c0.38bc0.51ab0.54bSB10D00.32c0.35c0.42b0.57abSB10D100.38b0.40b0.52a0.55bB10D100.41b0.44ab0.42b0.60a
F1:发酵床垫料堆肥(SPLC)∶泥炭∶蛭石∶珍珠岩=3∶3∶2∶2(体积比);F2: 发酵床垫料堆肥(SPLC)∶泥炭∶蛭石∶珍珠岩=4∶2∶2∶2(体积比);F3: 发酵床垫料堆肥(SPLC)∶泥炭∶蛭石∶珍珠岩=5∶1∶2∶2(体积比);F4: 发酵床垫料堆肥(SPLC)∶泥炭∶蛭石∶珍珠岩=6∶0∶2∶2(体积比)。调理剂配方(生物炭与硅藻土比例为体积百分比),CK: 0 SAP+0 生物炭+0硅藻土;B10D10: 10%生物炭+10%硅藻土;SB0D10: 0.8 g/L SAP+10%硅藻土;SB10D0: 0.8 g/L SAP+10%生物炭;SB5D5: 0.8 g/L SAP+5%生物炭+5%硅藻土;SB5D10: 0.8 g/L SAP+5%生物炭+10%硅藻土;SB10D5: 0.8 g/L SAP+10%生物炭+5%硅藻土;SB10D10: 0.8 g/L SAP+10%生物炭+10%硅藻土。同一列数据后不同小写字母表示不同调理剂之间在0.05水平上有显著差异。
未添加调理剂条件下,基质总孔隙度和通气孔隙度均随SPLC比例增加及泥炭比例降低而明显降低(表2)。各调理剂对F1总孔隙度和通气孔隙度影响不明显,但SB0D10添加后其他配方基质的总孔隙度和通气孔隙度均有所降低,说明不添加生物炭情况下添加10%硅藻土对基质通气性有负面作用。SB10D0与SB10D5添加后F2及F3配方基质总孔隙度明显升高,说明生物炭对基质总孔隙度提高有促进作用,这与报道结果[20-21]一致。这与生物炭本身孔隙特征较好有关[22]。调理剂对F4配方基质总孔隙度影响不明显。各配方基质通气孔隙度均低于标准基质理想范围[19],且随调理剂添加的变化趋势与总孔隙度类似,生物炭添加可增大基质孔隙孔隙度,但硅藻土对此有一定的负面作用。
无论添加调理剂与否,4个配方基质最大持水量随SPLC比例增加和泥炭比例降低而逐渐降低(表3)。通过添加调理剂后各配方基质数值变化可知,SAP添加对基质持水量增加最为明显,且F1~F4配方基质均显著增加;添加SAP调理剂的配方基质均显著高于未添加SAP的CK及B10D10处理的配方基质,也充分说明了SAP在增大基质持水量方面的重要贡献。这与前人研究结果[23-25]一致。4个配方基质的最大持水量中均表现为10%生物炭添加处理高于5%及无生物炭添加处理,说明了生物炭对增加基质水分保持也有一定作用,这可能与生物炭本身多孔结构及吸水性有关,这与前人报道结果[17-18,26]一致。
表2复合调理剂添加下不同配方基质总孔隙度与通气孔隙度
Table2Totalandairporosityofsubstratesamendedwithcompositeconditioner
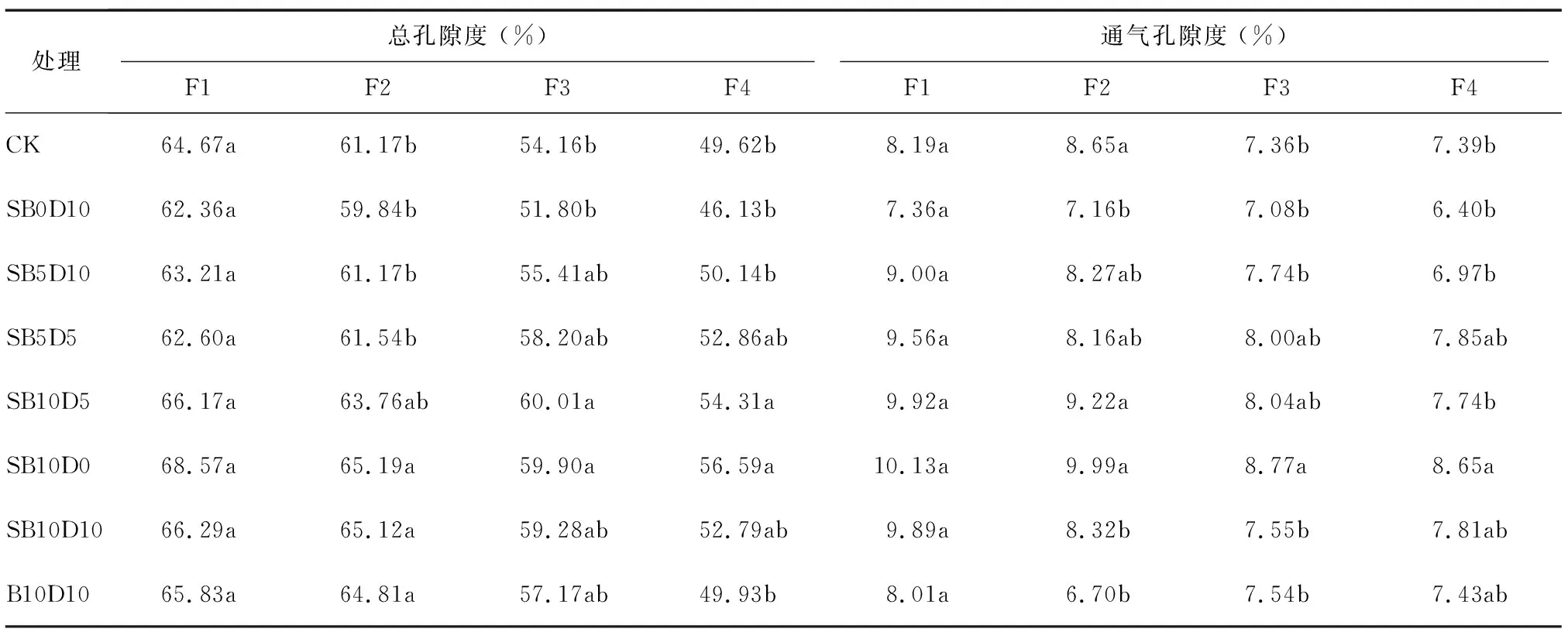
处理总孔隙度 (%)F1F2F3F4通气孔隙度 (%)F1F2F3F4CK64.67a61.17b54.16b49.62b8.19a8.65a7.36b7.39bSB0D1062.36a59.84b51.80b46.13b7.36a7.16b7.08b6.40bSB5D1063.21a61.17b55.41ab50.14b9.00a8.27ab7.74b6.97bSB5D562.60a61.54b58.20ab52.86ab9.56a8.16ab8.00ab7.85abSB10D566.17a63.76ab60.01a54.31a9.92a9.22a8.04ab7.74bSB10D068.57a65.19a59.90a56.59a10.13a9.99a8.77a8.65aSB10D1066.29a65.12a59.28ab52.79ab9.89a8.32b7.55b7.81abB10D1065.83a64.81a57.17ab49.93b8.01a6.70b7.54b7.43ab
F1、F2、F3、F4、CK、B10D10、SB0D10、SB10D0、SB5D5、SB5D10、SB10D5、SB10D10见表1注。同一列数据后不同小写字母表示不同调理剂之间在0.05水平上有显著差异。
表3复合调理剂添加下不同配方基质最大持水量
Table3Waterholdingcapacityofsubstratesamendedwithcompositeconditioner
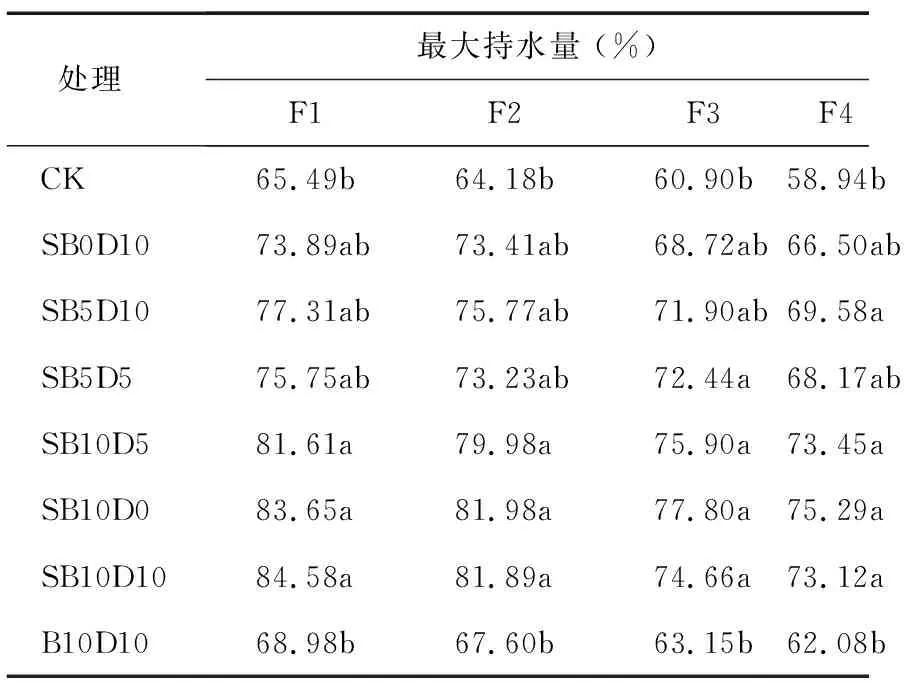
处理 最大持水量 (%)F1F2F3F4CK65.49b64.18b60.90b58.94bSB0D1073.89ab73.41ab68.72ab66.50abSB5D1077.31ab75.77ab71.90ab69.58aSB5D575.75ab73.23ab72.44a68.17abSB10D581.61a79.98a75.90a73.45aSB10D083.65a81.98a77.80a75.29aSB10D1084.58a81.89a74.66a73.12aB10D1068.98b67.60b63.15b62.08b
F1、F2、F3、F4、CK、B10D10、SB0D10、SB10D0、SB5D5、SB5D10、SB10D5、SB10D10见表1注。同一列数据后不同小写字母表示不同调理剂之间在0.05水平上有显著差异。
2.2 复合调理剂对不同配方基质化学性状的影响
研究结果[27]表明,从植株利用微量元素的角度来说,基质pH范围在5.0~6.5对根系吸收微量元素有促进作用,蔬菜幼苗对基质的pH反应比较敏感,且不同的作物幼苗对基质最适的pH要求有所不同,综合国内外诸多研究结果可知,基质的pH范围应控制在5.8~7.0。本研究中各基质配方在使用之前pH均在此范围之内(表4),符合作物生长要求[19],且表现为添加10%生物炭调理剂处理(SB10D0、SB10D5、SB10D10)显著高于不添加生物炭的处理(SB0D10)。这是因为生物炭本身pH(8.5)较高造成的。对于生物炭的石灰效应大量文献已有报道[28-30]。对生物炭生产工艺进行优化,生产适中pH值生物炭是解决这一问题的方法之一。有文献报道种植蔬菜后土壤pH因根系释放有机酸等而有所降低,但是本研究中结果与之相反,空心菜种植后pH上升的原因仍需进一步研究。硅藻土对各处理pH影响不明显,这是因为硅藻土本身pH与基质较为接近。
表4复合调理剂添加下不同配方基质种植空心菜前后的pH值
Table4ThepHofsubstratesamendedwithcompositeconditionerbeforeandaftercultivationofwaterspinach

处理pH值F1F2F3F4种植前种植后种植前种植后种植前种植后种植前种植后CK6.29b7.05a6.37b7.11a6.44b7.05a6.69b7.17aSB0D106.26b7.00a6.36b7.15a6.48b7.13a6.71b7.24aSB5D106.54ab7.03a6.62ab7.06a6.73ab7.22a6.91ab7.26aSB5D56.61ab7.05a6.70ab7.06a6.62ab7.19a6.83ab7.26aSB10D56.80a7.05a6.78a7.06a6.76a7.23a7.04a7.29aSB10D07.00a6.96a6.70a7.09a6.81a7.19a7.01a7.19aSB10D106.78a7.09a6.93a7.15a6.93a7.22a7.04a7.30aB10D106.77a6.99a7.03a7.10a6.79a7.15a7.02a7.26a
F1、F2、F3、F4、CK、B10D10、SB0D10、SB10D0、SB5D5、SB5D10、SB10D5、SB10D10见表1注。同一列数据后不同小写字母表示不同调理剂之间在0.05水平上有显著差异。
由表5可知,基础配方基质中,随SPLC比例增加和泥炭比例降低,基质电导率迅速上升,由F1的3.76升至F4的5.44。根据Abad等[19]关于标准基质的电导率范围可知,4个配方电导率均偏高,尤其F2~F4(>4.4 )可能会对盐分敏感植物生长产生较为严重的影响。种植空心菜后各配方基质电导率均明显下降,这与作物吸收养分及养分随浇水淋失有关。添加调理剂SB0D10后明显降低了4个配方基质的电导率,调理剂SB5D10添加后与对照相当,上述结果说明硅藻土对降低基质电导率具有重要作用。当生物炭添加比例增至10%后,各配方基质电导率均高于对照,尤其SB10D0配方,更是显著高于对照,充分证明了生物炭提高基质电导率及硅藻土降低电导率的作用。生物炭提高电导率与其自身较高的比表面积和高电荷密度有关[28-30],硅藻土降低电导率的功能可能与其自身低电导率以及较强的吸附能力有关[11-12]。
表5复合调理剂添加下不同配方基质种植空心菜前后电导率
Table5Electricalconductivityofsubstratesamendedwithcompositeconditionerbeforeandaftercultivationofwaterspinach

处理电导率(dS/m)F1F2F3F4种植前种植后种植前种植后种植前种植后种植前种植后CK3.76b3.25bc4.41bc3.87bc6.01ab4.05c7.10b5.44bcSB0D103.17c2.88c4.08c3.37c5.65b3.86c6.16c4.71cSB5D103.65b3.48bc5.07b3.25c5.73b4.42bc6.40bc6.04bSB5D54.27ab3.29bc5.23b4.73ab5.98b4.53b7.03b6.41bSB10D54.45ab3.69b5.68a4.52b6.21ab5.10a7.58ab6.57abSB10D05.08a4.95a5.77a5.48a7.10a5.79a8.07a7.71aSB10D104.09ab3.36bc5.40ab4.58b6.17ab5.02ab7.34ab6.23bB10D104.61ab3.72b5.32ab4.51b6.15ab4.92ab7.38ab6.21b
F1、F2、F3、F4、CK、B10D10、SB0D10、SB10D0、SB5D5、SB5D10、SB10D5、SB10D10见表1注。同一列数据后不同小写字母表示不同调理剂之间在0.05水平上有显著差异。
2.3 复合调理剂对不同配方基质栽培空心菜出苗率的影响
由图1可知,4个配方基质中空心菜出苗率随SPLC比例的增加及泥炭比例的降低而降低,且受调理剂中硅藻土添加比例的影响十分明显,整体表现为随硅藻土比例的增加而增加,尤其是在SPLC比例最高的F4配方基质中这种趋势更为明显。这主要是因为SPLC本身电导率较高,添加10%生物炭而不添加硅藻土情况下,基质高电导率阻碍了空心菜出苗。已有研究者指出,作物种子萌发及早期发展更适宜在较低电导率的环境中进行[2]。上述结果也证明了硅藻土对降低基质电导率有显著的效果。这可能是硅藻土本身的吸附性能造成的,硅藻土将基质中无机盐离子吸附,可使得基质电导率降低。对于硅藻土吸附性能及对作物生长的促进作用,岳天敬[31]已有报道。
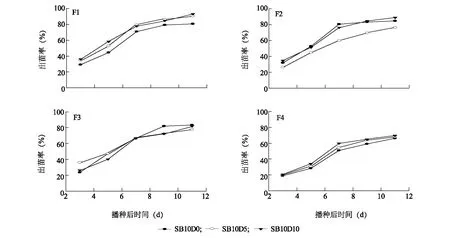
F1、F2、F3、F4、SB10D0、SB10D5、SB10D10见表1注。图1 不同硅藻土添加比例下基质栽培空心菜出苗率Fig.1 Emergence rate of water spinach grown in substrate amended with different proportions of diatomite
由图2可知,在固定调理剂中硅藻土10%比例的情况下,调理剂中生物炭添加比例对空心菜出苗率的影响也十分明显。SPLC比例较低的F1和F2配方表现为SB10D10处理出苗率显著高于生物炭比例较低的2个处理,F3受调理剂中生物炭比例影响不明显,但在SPLC比例最高的F4配方中SB0D10处理出苗率最高,SB10D10处理表现较差。这主要是因为SPLC比例相对较低的F1和F2 2个配方中,生物炭对基质孔隙度和持水性等性状的改性功能超过了对电导率的负面效应,但是随着SPCL比例及电导率值的升高,高电导率的危害成为主导作用,因此在F4中添加10%生物炭的处理空心菜出苗率最低。上述结果说明,生物炭及硅藻土等调理剂对基质的调控不只是对基质单一性状的改变,其综合作用决定了对作物的综合影响。
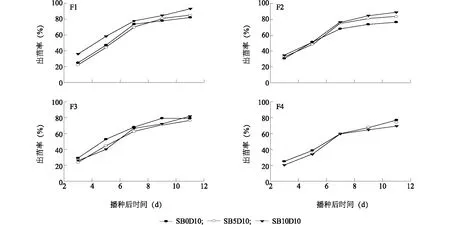
F1、F2、F3、F4、SB0D10、SB5D10、SB10D10见表1注。图2 不同生物炭添加比例下基质栽培空心菜出苗率Fig.2 Emergence rate of water spinach grown in substrate amended with different proportions of biochar
2.4 复合调理剂对不同配方基质栽培空心菜生物量的影响
不添加任何调理剂情况下,4个基础配方基质中空心菜鲜质量随基质SPCL比例增加和泥炭比例降低而显著降低(图3)。F1配方基质中,除处理SB0D10与处理B10D10外,其他调理剂添加均增加了空心菜茎叶鲜质量,且SB10D10、SB10D5及SB10D0处理均显著高于对照,其中SB10D10处理表现最佳。F2配方中各调理剂对空心菜茎叶鲜质量的影响规律与F1配方基质中类似,SB10D10处理仍为最佳。这些结果说明生物炭在调节基质孔隙度、持水量等方面的重要作用。这与前人研究结果一致[16-18,32]。在SPLC添加比例高达50%、泥炭比例降至10%的F3配方中,SB5D5及SB10D10处理仍然能够使空心菜茎叶鲜质量高于对照水平,且SB5D5处理显著高于SB10D10处理,充分说明了SAP、生物炭、硅藻土以合适比例调配后对基质性能和空心菜产量具有有效的提升作用。所有配方基质中B10D10处理空心菜茎叶鲜质量均明显低于SB10D10处理,验证了SAP在增加基质水分保持及作物生长中的重要作用[23-24,26,33]。

F1、F2、F3、F4、CK、B10D10、SB0D10、SB10D0、SB5D5、SB5D10、SB10D5、SB10D10见表1注。不同小写字母表示不同调理剂之间在0.05水平上有显著差异。图3 不同调理剂添加比例下基质栽培空心菜茎叶鲜质量Fig.3 Fresh shoot weight of water spinach grown in substrate amended with different composite conditioner
各处理中空心菜根部鲜质量随配方基质及调理剂的变化规律与空心菜茎叶鲜质量类似,不添加任何调理剂情况下,4个基础配方基质中空心菜根部鲜质量随基质SPCL比例增加和泥炭比例降低而显著降低(图4)。F1配方基质中,添加所有调理剂均增加了空心菜茎叶鲜质量,且SB5D5、SB10D10、SB10D5及SB10D0处理均显著高于对照,其中SB10D10处理表现最佳。F2配方中各调理剂对空心菜根部鲜质量的影响规律与F1配方基质中类似,SB10D10处理仍为最佳。在SPLC添加比例高达50%、泥炭比例降至10%的F3配方中,SB5D5及SB0D10处理添加仍然能够使空心菜根部鲜质量高于对照水平。
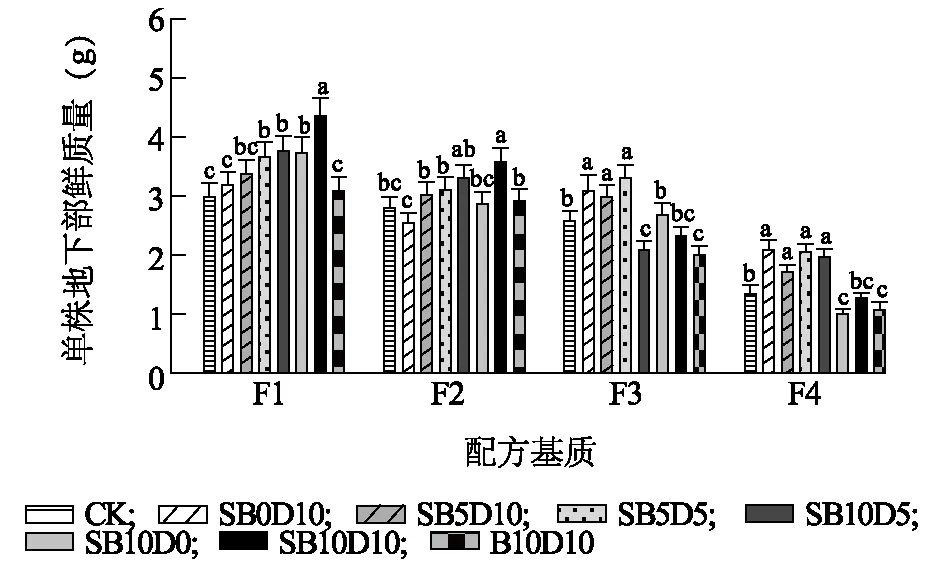
F1、F2、F3、F4、CK、B10D10、SB0D10、SB10D0、SB5D5、SB5D10、SB10D5、SB10D10见表1注。不同小写字母表示不同调理剂之间在0.05水平上有显著差异。图4 不同调理剂添加比例下基质栽培空心菜根部鲜质量Fig.4 Fresh root weight of water spinach grown in substrate amended with different composite conditioner
由图5、图6可知,空心菜茎叶及根部干质量随配方基质及调理剂的变化规律与其鲜质量大体一致,均表现为随SPLC比例增加及泥炭比例降低而降低,前2个SPLC相对较低的配方基质中,生物炭添加比例较高的调理剂对空心菜生长促进作用十分明显,但是随SPLC比例及基质电导率值的升高,高生物炭比例调理剂的效果逐渐消失,而高硅藻土比例调理剂的效果较为明显。整体而言,空心菜茎叶干质量受调理剂的影响程度低于鲜质量,这可能与调理剂添加后基质水分可利用性及空心菜含水量有关。空心菜根干质量受基质配方及调理剂的影响程度大于茎叶干质量。

F1、F2、F3、F4、CK、B10D10、SB0D10、SB10D0、SB5D5、SB5D10、SB10D5、SB10D10见表1注。不同小写字母表示不同调理剂之间在0.05水平上有显著差异。图5 不同调理剂添加比例下基质栽培空心菜茎叶干质量Fig.5 Dry shoot weight of water spinach grown in substrate amended with different composite conditioner
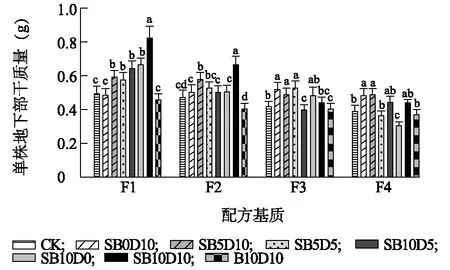
F1、F2、F3、F4、CK、B10D10、SB0D10、SB10D0、SB5D5、SB5D10、SB10D5、SB10D10见表1注。不同小写字母表示不同调理剂之间在0.05水平上有显著差异。图6 不同调理剂添加比例下基质栽培空心菜根干质量Fig.6 Dry root weight of water spinach grown in substrate amended with different composite conditioner
3 讨 论
未添加复合调理剂条件下,随发酵床垫料(SPLC)比例增加及泥炭比例降低,基质持水性、总孔隙度、通气孔隙度均明显降低,而电导率则显著升高。相应地,空心菜出苗率及生长状况(包括茎叶及根部的鲜质量及干质量)也逐渐降低。添加复合调理剂之后,各配方基质理化性质及空心菜生长差异明显,总体而言,调理剂中SAP的添加增加了基质持水性,促进了空心菜出苗及生长。随生物炭添加比例的增加,基质孔隙度及持水量呈上升趋势,但电导率也迅速上升,尤其在电导率本身较高的F4配方基质中。随硅藻土比例的增加,基质容重逐渐增加,但对基质电导率有降低作用。在SPLC比例相对较低的F1和F2 2个配方基质中,生物炭对基质孔隙度和持水性等性状的改善功能超过了对电导率的负面效应,因此空心菜出苗及后期生长均有明显提高,SB10D10处理表现最佳。但是随着SPCL比例及电导率值的升高,高电导率的危害成为主导作用,因此在F4中生物炭添加10%比例的处理空心菜出苗率最低。各种调理剂综合作用结果表明,SB5D5及SB10D10调理剂添加后,配方基质中SPLC比例增至50%,泥炭比例降至10%的情况下,空心菜产量仍然高于不加调理剂的F1(SPLC比例30%、泥炭比例30%)对照。

