槐米槐叶中黄酮类物质合成相关酶基因研究
高洁
(山西省林业科学研究院,山西 太原 030012)
槐米为豆科植物槐(SophorajaponicaL.)的花蕾,是我国传统的大宗药材之一,内含芦丁、槲皮素等多种黄酮类成分,芦丁为槐米中含量最高的成分。米槐是植物槐的栽培品种。随着专用于生产槐米的优良品种选育成功,植物槐作为行道树、四旁树、园林绿化树和生态树种栽培的同时,也可作为一种经济树种栽培。人们把专门用来生产槐米的植物槐称为米槐。临床上槐米常用于治疗高血压、冠心病、防治脑溢血及吐血、风热目赤等[1]。1904年,Schmidt分离得到芦丁,为槐米中的主要成分。随后,在槐米中分离得到很多黄酮类成分,如:染料木素、山柰酚、异鼠李素[2]等。除黄酮类外,其他类成分,如皂苷类[3]、甾类[4~5]、色素、氨基酸[6~8]等成分也被发现。同时,槐米还可食用、做染料等,槐叶资源丰富,但利用较低,目前对槐米和槐叶的研究主要集中在化学和药理方面,对于黄酮类化合物在槐米和槐叶中的积累规律及生物合成规律尚未报道。
荧光定量PCR技术(RT-qPCR)是一种在PCR反应体系中加入荧光材料,利用荧光信号积累实时监测整个PCR过程,然后通过标准曲线对未知模板进行定量分析的方法。通过RT-qPCR可以分析植物在不同处理条件下基因样本的表达差异,比较不同基因型,不同发育阶段或生长条件下的细胞或个体在基因表达上的差异,是研究分子调控机制的重要组成部分。Czechowski等[9]使用RT-qPCR研究了1400多个拟南芥转录因子在根组织和茎组织的特异表达情况,认为荧光定量PCR是研究转录因子的优势方法。Alaei等[10]用传统方法和实时PCR法检测了杭白菊中的白锈病,认为实时PCR能够快速准确的检测病原。RT-qPCR也可以为转基因产品的检测提供快速而灵敏的技术途径。Wu等[11]建立了转基因水稻TT51-1实时PCR检测体系,为快速检测转基因植物成分提供便捷方法。因此,实时荧光定量PCR技术可作为分析槐米和槐叶中关键酶基因表达水平的有利工具。
本研究应用RT-qPCR技术,对在前期槐米和槐叶的转录组数据中挖掘到13个有关黄酮类生物合成的关键酶基因[12]的mRNA的表达量进行荧光定量分析,以期研究槐米中黄酮类化合物生物合成途径中关键酶基因的表达水平,明确槐米的采收期,皆在为后续通过基因工程进行槐米种质遗传改良奠定基础。
1 材料与方法
1.1 仪器与材料
DYY-6B稳压稳流电泳仪,ZF-258全自动凝胶成像分析系统,GC-02实时荧光定量PCR仪,TC-XP-D 基因扩增仪, NanoDrop2000超微量分光光度计;RNAisoPlus、Taq DNA 聚合酶、dNTPs、DNA Marker、M-MLV Reverse Transcriptase、PrimeScrip RT Master Mix、SYBR Premix Ex TaqTM II均为TaKaRa公司,琼脂糖(BIOWEST),DEPC(Solabio),2×Easy Taq PCR SuperMix (TransGen)。
槐米和槐叶样品均采自山西省运城市盐湖区茂端双季槐种植专业合作社基地,分别于2016年7月和9月,随机抽取同一片试验田中10株生长旺盛的米槐,每株随机从不同部位各采集10包槐米(M)及槐叶(Y)(图1),以铝箔纸包裹,液氮速冻后于-80 ℃保存。采集的所有样本经山西大学中医药现代研究中心的秦雪梅教授鉴定为米槐(Sophora japonica),凭证标本保存在该中心。

图1 槐米和槐叶的生长状况Fig.1 The growth status of the Sophora Japonica and its leaves
1.2 RNA提取及cDNA的合成
采用RNAiso Plus(TaKaRa)说明书,对7月和9月采集的槐米和槐叶样本进行总RNA提取,提取RNA时,随机选取3包样品进行混合。Nano Drop 2000及1.5%琼脂糖凝胶电泳对所提取的RNA样品进行浓度和质量检测。按照M-MLV Reverse Transcriptase(TaKaRa)说明书用 1μg总RNA合成cDNA。
1.3 荧光定量引物设计及验证
1.3.1 引物设计
使用Primer Premier5.0软件设计槐米和槐叶内参18 s rRNA与13个与黄酮类化合物生物合成相关酶基因的表达引物,引物的碱基数为20 bp左右,上下游引物的退火温度相差1 ℃左右,且都在60 ℃上下浮动,符合荧光定量引物设计原则。引物合成工作由南京金斯瑞生物科技有限公司完成。
1.3.2 引物验证
采用PT-PCR验证引物特异性,反应体系:12.5 μL 2×Taq PCR MasterMix;1.0 μL上游/下游引物(引物浓度10 μmol/L);8.5 μL ddH20;2 μL cDNA。反应程序:94 ℃ 3 min;94 ℃ 30 s,58 ℃ 60 s,72 ℃ 3min;35个循环,72 ℃ 10 min;4 ℃保存。选取7月份的槐米为模板,每个基因各做1个反应,1.5%琼脂糖凝胶电泳检测PCR产物。
1.4 RT-qPCR分析
反应体系:10 μL SYBR Premix Ex Taq;1.0 μL上游/下游引物(引物浓度10 μmol/L);6.4 μL ddH20;2 μL cDNA。反应程序:95 ℃ 60 s;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 45 s,40个循环。每个样本生物学重复3次,技术重复3次。以2-ΔCt值分析数据[14]。
2 结果与分析
2.1 总RNA样品质量分析
对所提取的RNA(S7-M、S7-Y、S9-M和S9-Y)进行1.5%琼脂糖凝胶电泳分析(见图2-A),由图可见,有3条完整的电泳条带,并且28 s比18 s和5s明亮,说明RNA的完整性良好,没有降解。通过Nanodrop检测RNA的浓度和纯度,结果表明A260/280与A260/230均在1.9~2.1之间,说明RNA的纯度较高,符合后续试验要求。
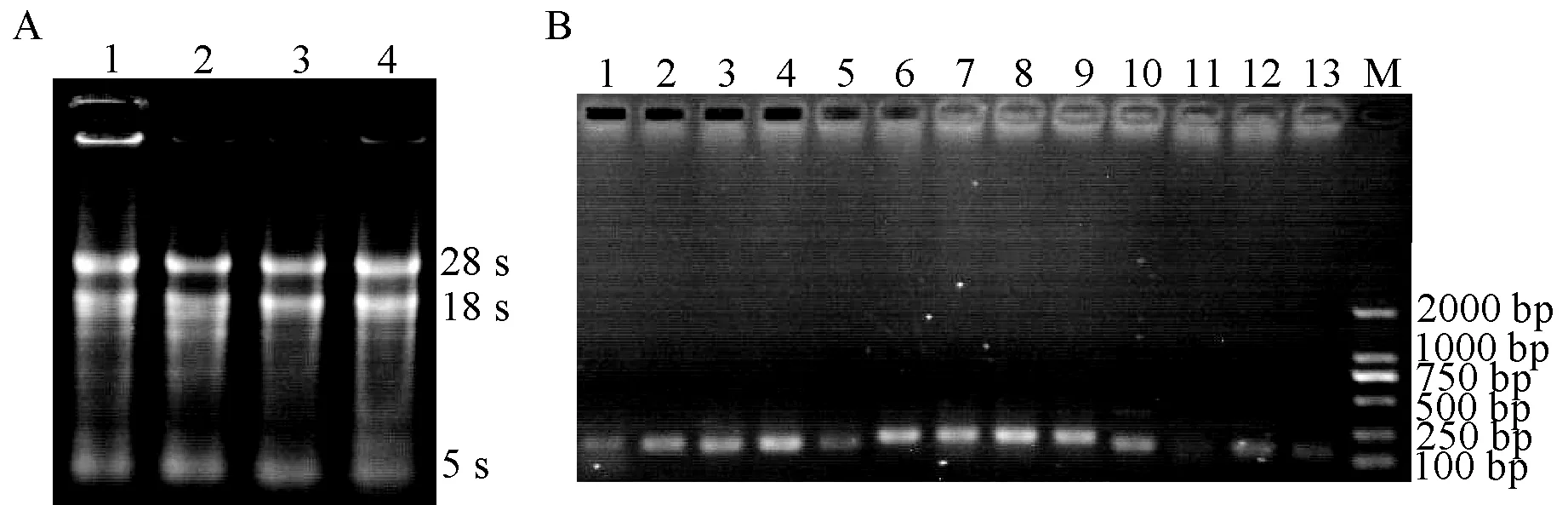
图2 槐米和槐叶总RNA提取的琼脂糖凝胶电泳图及RT-PCR产物琼脂糖凝胶电泳图(A-槐米和槐叶总RNA提取:1∶7月槐米;2∶7月槐叶;3∶9月槐米;4∶9月槐叶;B-RT-PCR产物验证:1:柚皮素3-双加氧酶;2:ANR;3:HCT;4:FLS;5:CHS;6:LDOX;7:FLS;8:LAR;9:F3′H;10:4CL;11:PAL;12:CCoAOMT;13:IFS)Fig.2 The electrophoresis figure of agarose gel extracted from the total RNA of Sophora japonica and its leaves and the electrophoresis figure of agarose gel of RT-PCR products.(A: The extracted total RNA of Sophora japonica and its leaves: 1: Sophora japonica in July;2:Leaves in July; 3: Sophora japonica in September; 4: Leaves in September; The product of B- RT-PCR: 1: EC 1.14.11.9; 2:ANR;3:HCT;4:FLS;5:CHS;6:LDOX;7:FLS;8:LAR;The product of C-RT-PCR: 9:F3′H;10:4CL;11:PAL;12:CCoAOMT;13:IFS)
2.2 引物扩增特异性检验
据RT-PCR产物的琼脂糖凝胶电泳结果(图2-B)可知,所设计13个与黄酮类化合物生物合成相关的酶基因的引物均得到特异性扩增产物,且无引物二聚体。扩增目的条带符合设计引物时目的产物片段的大小,基本在200 bp左右,符合荧光定量反应试验要求。
2.3 槐米和槐叶中与黄酮类生物合成相关的酶基因的发掘
据本课题组前期转录组测序结果分析,共注释到157个与黄酮类化合物生物合成相关的酶基因(表1),包括花青素还原酶(c47862_g1,ANR)、黄酮醇合酶(c38192_g1,FLS)、查尔酮合酶(c51726_g1,CHS)、异黄酮2′-羟化酶(c41373_g1,I2'H)等。其中,注释最多的为4-香豆酸:CoA连接酶同工酶(4CL),为黄酮类化合物生物合成途径中上游的一个关键酶。在这157个酶基因中,高表达的有13个,为本研究进行荧光定量分析的13个酶基因。
2.4 与黄酮类化合物生物合成相关酶基因的荧光定量分析
以LAR在9-M(9月份采收的槐米)中的荧光定量扩增曲线(见图3)为例,内参18 srRNA和基因LAR在9-M中表达稳定,并且扩增良好。由熔解度曲线可知,内参18 s rRNA和基因LAR都是一个尖峰,说明设计的引物扩增良好,无引物二聚体或其它非特异性扩增。
通过不同采收期(7月和9月)槐米的mRNA表达量分析,图4可知,除基因类黄酮-3′-羟化酶(F3'H)外,其余基因在7月采收槐米中的表达量均高于9月;在比较不同部位米槐(槐米和槐叶)中与黄酮类物质生物合成相关的酶基因表达水平时发现,除基因黄酮醇合酶(FLS)、苯丙氨酸氨裂解酶(PAL)、4-香豆酸:CoA连接酶同工酶(4CL)和2-羟基异黄酮合成酶(IFS)外,其余9个与黄酮类化合物生物合成相关的酶基因在槐米的表达量均高于槐叶。由此可推测,黄酮类化合物的积累在7月槐米中较高,9月采收的槐米中黄酮类成分减少;且黄酮类成分的积累多在槐米中,槐叶中的黄酮类成分较少。

表1 转录组数据中注释到的与黄酮类化合物生物合成相关的基因Table 1 The Genes Related to the Biosynthesis of Flavonoids in the Transcriptome Data

图3 内参(18 s RNA)与LAR基因在9-M中的荧光定量扩增曲线与熔解度曲线Fig.3 Fluorescent Quantitative Amplification Curves and Melting Curves of Internal References (18 s RNA) and LAR Gene in 9-M

图4 不同采收期槐米和槐叶中黄酮类物质生物合成相关基因的mRNA表达量Fig.4 The amount of mRNA expression of related genes of the biosynthesis of flavonoids of sophora japonica and its leaves in different harvest time
2.5 槐米和槐叶中与黄酮类化合物生物合成相关关键酶基因的序列比对
通过使用国家生物技术信息中心(NCBI)数据库https://www.ncbi.nlm.nih.gov/对米槐转录组数据中挖掘到的13个与黄酮类化合物生物合成关键酶基因进行同源序列比对由表2可知,13个酶基因的功能均在其他同源物种中被注释,且基因同源性均大于70%。此外,除c85175_g1(HCT)和c56136_g1(IFS)未匹配到蛋白编码区外,其余基因均有编码区。最长的基因序列是c56049_g1(LAR),2 474 bp,其主要功能是无色花青素还原酶,最短的序列是编码LDOX的c46064_g1(1 197 bp)。
3 讨论与结论
本研究通过前期槐米不同采收期(7月和9月)及不同组织部位的转录组数据库进行分析,从中找到13个黄酮类化合物生物合成相关的关键酶基因,并利用RT-qPCR技术对这13个酶基因mRNA的表达水平进行分析,明确了槐米的最佳采收期为7月。为后续黄酮类成分生物合成相关酶基因克隆及功能分析提供数据支持,为通过基因工程进行米槐种质遗传改良奠定基础。
通过前期米槐转录组数据的深度挖掘,找出157个与黄酮类生物合成相关的基因,并在其中找出13个表达上调的关键酶基因,随后对这13个酶
表2槐米和槐叶中与黄酮类化合物生物合成相关关键酶基因的序列比对
Table2 The sequence alignment of key enzyme genes related to biosynthesis of flavonoids in the Sophora Japonica and its leaves

Gene IDFunctionlength(bp)Homologous species functionHomology rateHomologous gene length(bp)Gene bank IDc49346_g1Naringenin, 2-oxoglutar-ate 3-dioxygenase1676Glycine max flavanone 3-hydroxylase (F3H) mRNA, complete cds85%1677DQ513328.1c47862_g1Anthocyanidn reductase1803Lotus uliginosus anthocyanidin reductase (ANR) mR-NA, complete cds88%1161/c85175_g1HCT;shikimate O-hydroxycinnamoyltrans-ferase1862PREDICTED: Glycine max spermidine hydroxycin-namoyl transferase-like (LOC100777007), mRNA79%1646/c43880_g1Flavonol synthase1490Onobrychis viciifolia flavonol synthase mRNA, complete cds84%1005HM204484.1c51726_g1Chalcone and stilbene synthase family protein2018Acacia confusa chalcone synthase mRNA, complete cds85%1577JN812063.1c46064_g1Leucoanthocyanidin diox-ygenase LDOX1197Glycine max anthocyanidin synthase 3 (ANS3) mRNA, complete cds88%1308AY382830.1c31170_g1Flavonol synthase1572Eustoma russellianum flavonol synthase (fls) mRNA, complete cds73%1268AF240764.1c56049_g1Leucoanthocyanidin re-ductase LAR2474Glycine max cultivar Clark leucoanthocyanidin reductase 1 (LAR1) mRNA, complete cds85%1314JF433916.1c40901_g1Flavonoid-3'-hydroxylase1944Glycine max flavonoid 3'-hydroxylase (F3'H) mRNA, complete cds83%1589 FJ770476.1c53277_g14-Coumarate: CoA ligase isoenzyme 32130Glycine max 4-coumarate:CoA ligase (4CL) mRNA, complete cds84%1697FJ770469.1c53596_g1Phenylalanine ammonia-lyase class 1-like2176Vitis vinifera phenylalanine ammonia-lyase 1 (PAL1) mRNA, complete cds78%2154KU162973.1c50834_g1Cinnamoyl-CoA O-meth-yltransferase1258Caragana korshinskii cinnamoyl-CoA O-methyltrans-ferase (CCOAOMT) mRNA, complete cds91%744HQ829864.1c56136_g12-Hydroxyisoflavanone synthase2009PREDICTED: Lupinus angustifolius 2-hydroxyisofla-vanone synthase-like (LOC109328965), mRNA80%1703/
基因进行同源性比对,比对结果显示除c85175_g1(HCT)和c56136_g1(IFS)未匹配到蛋白编码区外,其余基因均有编码区。此结果表明,所找到的黄酮类化合物生物合成途径中表达上调的基因多数为全长基因,并不是以小片段形式存在的,所以关于酶基因的功能注释结果是可信的,并且基因注释结果与同源全长基因的结果相匹配。通过RT-qPCR技术对这13个酶基因的mRNA表达量进行分析,结果发现其中9个基因mRNA的表达量在槐米中均高于槐叶,且在比较不同采收期槐米中与黄酮类物质生物合成相关的酶基因表达水平时发现,除F3'H外,其余基因在7月采收槐米中的表达量均高于9月,这为确定槐米的采收期提供了理论支持。
目前,人们致力于槐米中药用成分的研究,主要是化学和药理方面。化学研究主要集中在槐米中芦丁与槲皮素的含量测定、提取及纯化工艺研究;药理作用的研究主要为黄酮类化合物(芦丁、槲皮素)的抗炎、止血、抗病毒及心血管疾病等。槐叶资源丰富,但利用率较低,为了提高槐叶的附加价值,李彩霞等[13]采用ABTS清除体系、DPPH清除体系、H2O2/ Fe2 +/水杨酸检测体系、亚硝基清除体系、普鲁士蓝法、邻苯三酚自氧化法研究了国槐叶黄酮的抗氧化活性,并同芦丁、Vc进行了比较,说明国槐叶提取物可以作为天然抗氧化剂,并且可以应用在医药食品领域。李小勇等[14]研究超声波辅助双水相、回流、半仿生、水提、超声波辅助双水相(碱)性5种提取方法提取国槐叶黄酮以及抗氧化活性。结果表明,回流提取黄酮含量大于其它几种提取方法。抗氧化结果显示,超声辅助双水相提取物具有很好的抗氧化性。以上研究表明目前对槐米和槐叶中的主要活性物质黄酮类化合物研究较多,但黄酮类化合物的积累规律及生物合成规律在米槐中的研究尚未报道,但在其他植物中的研究较广泛。PAL(苯丙氨酸解氨酶)是类黄酮生物合成途径中的一个关键酶,其能催化L-苯丙氨酸非氧化性脱氨生成反式肉桂酸。Liu等[15]克隆得到蒙古黄芪PAL1基因,并将该基因CaMV35S启动子转入到烟草中,研究发现烟草中PAL酶活和槲皮素的含量升高,证明了PAL是蒙古黄芪黄酮化合物合成途径中的关键酶。CHI(查耳酮异构酶)也是黄酮类化合物代谢途径中的一个关键酶,第1个CHI基因是Mehdy等[16]于1987年从法国豌豆中得到的,CHI能使查尔酮发生分子内环化。Liu等[15]克隆得到花生的CHI基因并通过RT-qPCR分析,结果显示CHI基因主要在根系中表达。不同种类的黄酮类化合物在植物各组织中的分布情况不同。Graham[17]研究发现,在大豆萌芽后5天时,幼苗的根部组织、胚轴以及子叶中异黄酮类化合物含量高,而初生的叶片组织中主要是黄酮醇类成分,这可能与合成不同黄酮类化合物的酶的含量及活性有组织差异性有关。黄酮醇类物质大部分分布于叶和花中,而异黄酮类化合物多在豆科植物的根中分布。本项目研究通过将在米槐转录组数据库中筛选到的13个与黄酮类生物合成相关的基因注释到黄酮类化合物生物合成途径中,揭示了米槐中黄酮类成分的积累及生物合成规律。研究结果F3'H和FLS主要参与黄酮醇类化合物的生物合成,槐米中含量最高的芦丁属于此类化合物,由基因表达量分析可知,与槐叶相比,黄酮醇类化合物的积累在槐米中较高,且7月份采收的槐米比9月份含量高。槐米为未开放的花蕾,槐米与槐花中的芦丁含量相似,且槐米中含有更多的黄酮类物质,本研究结果与诸姮[18]总结结果一致,而本研究发现异黄酮类物质的合成主要在叶中,与异黄酮类化合物多在豆科植物的根中分布结论不一致,这可能是因为,本研究仅在2个组织中分析与黄酮类化合物生物合成相关的酶基因表达水平,未就槐枝、槐根等其他组织进行研究。结合黄酮类化合物的生物合成路径与荧光定量结果可以推测,异黄酮类物质可以通过采收槐叶获得,而通过采收槐米可能获得更高的黄酮醇及花色素类物质。从而为通过提取分离获得目标化合物提供依据,也可为后续黄酮类成分生物合成相关酶基因克隆及功能分析提供数据支持。

