黑河口岸地区蜱类调查及研究
叶楠楠,裴希超,孙善华
蜱类是一种分布广泛的携毒媒介生物,蜱可携带83种病毒、14种细菌、17种回归热螺旋体、32种病原虫,其中大多数是自然疫源性疾病,在东北地区较为常见的蜱传疾病有蜱传脑炎病毒、莱姆病螺旋体、巴尔通体、无形体病毒及斑点热立克次体等[1].近年来,一些新发或再度肆虐的蜱传疾病对人畜的危害日趋严重,中国已有河南省、湖北省、山东省、安徽省、江苏省等省报告蜱传类疾病病例280多人,死亡10余人[2-3].
我国黑河口岸与俄罗斯接壤,是我国对俄罗斯贸易的重要口岸,也是我国蜱传脑炎、莱姆病等蜱媒疾病疫区之一,绵延的边境线地区多为湿地与灌木林,使该地区的生境更具有多样性,为蜱类的孳生提供了良好条件.近年来,我国对俄输出劳务人员的不断增加,其中多数在俄从事种植及林木采伐工作,蜱传疾病的感染及传入风险也随之增加,会对输入国的卫生安全特别是口岸地区的卫生安全造成较大危害[4].每年蜱活动的高峰期,在野外作业的工作人员都极容易遭蜱叮咬而产生患病可能,从而给自身生命安全带来危害[5].一些重要的新发蜱传疾病,如莱姆病、人粒细胞无形体病、巴贝西原虫病、巴尔通体病、斑点热等在黑龙江地区均有报道[6-7].
本文主要对黑龙江省黑河区域内蜱种群密度、数量、分布以及季节变迁方面的数据进行整理及总结,建立黑河口岸蜱传疾病的有效监测及携带病原体的快速检测分子生物学方法,建立快速、成熟稳定蜱传染病的PCR检测体系,对及时快速监测该口岸地区的新发蜱媒病发情况有重要意义,为科学的诊断和预防黑河地区蜱传流行疾病提供理论基础和技术支持,同时为全国生物安全防御提供有力保障.
1 材料与方法
1.1 材料
1.1.1 蜱采集时间及地点 从2012年4月开始,每个月上旬10日、下旬25日各一次,每次3人,采集1 h(遇到雨天顺延),每天在蜱活动高峰时间(10∶00到15∶00)捕蜱,9月份后连续2次捕蜱数为零时结束调查.利用布旗法釆集蜱虫,连同草叶一起装到湿润的塑料瓶中,用记号笔标明好采集的地区、种类以及日期.采集到的蜱类进行种属鉴定;鉴定后的蜱类进行病原体检测.地点位于我国黑龙江省黑河市,具体地点及环境如表1.

表1 黑河市蜱类的采集地点及生境描述Tab.1 Description of the sample sites and habitat
1.1.2 主要试剂材料及仪器设备 Taq酶(M7845)、AMV 反转录(Fasr Quant RT Kit with Gdna KR106-1)试剂盒生产商promaga公司;RNA提取试剂盒采用tiangen的动物组织总RNA提取试剂盒(DP431)、基因组DNA提取试剂盒生产商Qiagen公司的DNeasy Blood&Tissue Kit(96506);大肠杆菌感受态 DH5α、d NTPs、DL2000 DNA marker、T载体生产商均为宝生物工程(大连)有限公司.CX41RF生物显微镜厂商奥林巴斯有限公司;SZ61TR体视显微镜厂商奥林巴斯仪器设备有限公司;Nuaire NU430-600E生物安全柜厂商苏州宏瑞净化科技有限公司;Bio-radPower Pac Basic∕Wide Mini Sub-Cell电泳仪厂商上海天能科技有限公司;Sigma 3k15冷冻台式离心机厂商德国Sigma公司;MINILUMix凝胶成像系统厂商美国Media Cybernetics公司;ABI VERITI PCR扩增仪厂商美国ABI公司;QIAGEN TissueLyser LT组织细胞破碎仪厂商凯杰生物技术有限公司.
1.2 方 法
1.2.1 标本的采集与保存 采集标本前,在装蜱虫的储存管中放入一小团用水浸泡过的棉花,后将采集到的蜱虫标本存放在标本收集管中,用胶布封好瓶盖并标号,同时录入标本采集背景资料表.采集到的活蜱,要雌雄分开保存,可直接放入蜱盒或大试管中(塑料材质为佳),在蜱盒底垫上1~2 cm的细沙,细沙上布满1~2 cm经过处理的棉花,之后要使用滤纸片覆盖并压实、挤紧不留孔隙.然后将蜱放入,并放入干滤纸条,最后用润湿的棉花塞封口(湿度以挤不出水为宜),注意保存容器应有透气小孔.如天气较热(大于16℃),可将蜱盒置于4℃的冰箱内保存,可保存5~10 d.在采集或保存过程中,如遇标本死亡可直接用75%的酒精保存.
1.2.2 形态学鉴定 将采集的蜱标本用蒸馏水冲洗,并用超声波清洗仪清洗20 min,待干燥后用75%酒精进行固定,4℃冰箱中保存.将保存在75%酒精中的标本取出干燥后,在解剖显微镜下进行观察,进行初步形态学鉴定,整理并记录.
1.2.3 病原体的分子生物学鉴定
1.2.3.1 引物的合成 不同蜱传病原体PCR检测引物合成及目的基因如表2.

表2 蜱类检测所用引物及目标基因Tab.2 Experiment primer and reaction condition
1.2.3.2 病原体的PCR扩增检测
①PCR扩增检测 以提取的DNA为模板,按照表2-2列出的引物进行PCR扩增,用于检测蜱类伯氏疏螺旋体、巴贝西虫、无形体、立克次体(属)、埃立克体、土拉菌、巴尔通体、Q热立克次体;因此对于这几种病原体的检测以提取的DNA为模板.扩增反应体系包括Taq酶1.25 U,10×PCR buffer 5 μL,d NTPs mixture 0.2μmol/L,上下游引物0.5 μmol/L,模板DNA约为0.5μg,补充无菌水使总体积达到25μL.
②RT-PCR检测 加入1μL RNA、d NTPs 0.4 pmol/L、1.25 U 的 RNase抑制剂、0.5μg的random primer、1.5 U的AMV反转录酶,加入适量的水至20μL进行反转录反应,反应条件为室温放置10 min,42℃保温1 h,之后95℃,10 min后结束反应,反应完毕后将反应体系稀释至100μL.取稀释后反转录产物1μL进行PCR,森林脑炎扩增条件为94℃预变性5 min,然后35个循环,每个循环94℃变性30 s,50℃退火40 s,70℃聚合60 s,最后72℃延伸5 min.同样为RNA病毒的布尼亚属的扩增条件为94℃预变性5 min,共39个循环,每个循环94℃变性60 s,54℃退火60 s,72℃聚合60 s,最后72℃延伸5 min.
每检测组设一例阴性对照,以DEPC处理过的水代替DNA模板.扩增到的片段经过胶回收后与p MD-18T载体连接后送北京三博远志测序部进行测序.阳性率计算公式:阳性率=检测出阳性蜱数/采集到的总蜱数×100%.普通PCR法采用琼脂糖凝胶电泳法进行目的条带的分离,Gelred染色后紫外灯下观察是否具有表一中的目的条带,每组设一个阴性对照.
阳性基因片段PCR产物进行纯化,开始大肠杆菌(DH5α)感受态细胞的制备采用CaCl2溶液法小量制备大肠杆菌感受态细胞,所有操作都在无菌条件下进行:
①用冷却的无菌吸头吸取感受态细胞悬液200 μL加到微量离心管中,每管加DNA(体积≤10μL,DNA≤50μg)轻轻旋转以混匀内溶物,在冰上放置30 min.
②42℃热激90 s,迅速将离心管放到冰浴中,冷却1~2 min.加入800μL LB液体培养基,37℃温和振荡(250 r/min)培养60 min,使细菌复苏.
③4 000 r/min,离心5 min,吸出上清900μL,保留100μL菌液涂布于在加了40μL 2%X-gal贮存液和7μL 20%IPTG并含50 mg/L Amp的LB固体平板上,37℃倒置培养12~16 h.
④于4℃将平板放置数小时,使蓝色充分显现.
1.2.3.3 重组质粒的鉴定 连接液转化大肠杆菌DH5α后,通过氨苄筛选挑出阳性克隆菌株.用转化重组质粒的菌落进行PCR检测,在PCR反应管中加好PCR反应试剂,然后用无菌枪头挑取抗性筛选出的小部分单菌落,设空白对照和阳性对照,PCR反应体系和程序与扩增程序相同.检测后,挑取阳性菌落接种于含Amp(50μg/m L)的LB液体培养基中,37℃振荡培养过夜,以提取质粒.质粒提取采用海基公司质粒小量提取试剂盒.
1.2.3.4 序列测定及分析 DNA序列测定由华大基因测序技术公司和上海生工测序完成.应用DNAMAN软件对克隆的基因序列和GenBank上的相应序列进行序列同源性分析和比对.
2 结 果
2.1 黑龙江省黑河地区蜱类采集情况 2012年至2014年每年4月16日至10月8日期间在黑河口岸地区的蜱类采集活动中,共获得蜱类1 343只,经形态学鉴定分属3属3种,其中森林革蜱1 054只占总体构成78.48%为优势蜱种;嗜群血蜱236只占总体构成17.57%;全沟硬蜱53只占总体构成3.94%,具体结果如表3所示.
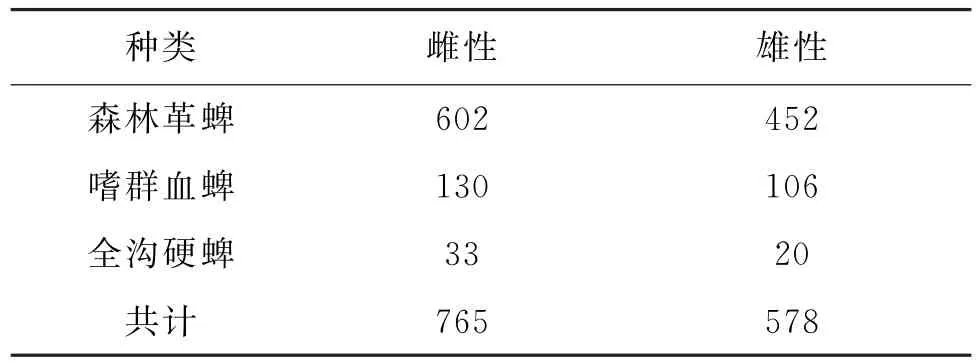
表3 黑河市蜱的采集种类表Tab.3 Description of the sample sites and habitat,Heihe
2.2 形态学鉴定结果
2.2.1 森林革蜱形态学鉴定结果 雄蜱:个体大小4.5 mm×2.9 mm(包括假头).假头基呈矩形,宽稍大于长.须肢粗短,其第2节稍长于第3节.口下板齿式排列前4/4,后3/3.盾板卵圆形,表面珐琅彩比较浓,中垛最窄.气门板呈长逗点形,背突较窄,向背方微弯,其末端伸达盾板边缘,背缘无几丁质增厚部.4对足粗壮,第1对足基节外距明显短于内距.第4对足基节大而向后延伸,外距超出该节后侧缘.第1对足转节背距发达,呈三角形,其末端尖细.第4对足胫节、前跗节、跗节内缘各有3个齿突,但较小.
雌蜱:个体大小4.5 mm×3.0 mm(包括假头).盾板近圆形,长等于或稍大于宽,假头基较短呈矩形,孔区较大呈卵圆形,前端向外斜置.盾板形状近似心形,其珐琅彩覆盖不均匀.气门板呈逗点形,背突窄短,背缘无明显的几丁质增厚部.4对足粗细适中,第1对足基节内外距近似相等,背距显著突出,末端尖细.第4对足基节外距末端超出该节后缘.如图1所示为森林革蜱的正反雌雄腹面图.

图1 森林革蜱形态学鉴定结果Fig.1 Results of morphological identification of Dermacentor silvarum
2.2.2 嗜群血蜱形态学鉴定结果 成蜱须肢第3节无背刺,腹刺短,足基节1内距长而尖,基节2~4内距粗短,不超过后缘.雌蜱盾板近圆形.雄蜱盾板卵圆形,侧沟明显,前端伸达基节2水平,后缘达第一缘垛.如图2.

图2 嗜群血蜱形态学鉴定结果Fig.2 Results of morphological identification of Haemaphysalis conicinna
2.2.3 全沟硬蜱形态学鉴定结果 体长中等,未吸血个体约2.5~3.5 mm.假头基腹面的耳状突钝齿形.第1对足基节具一细长的内距,雌虫足基节Ⅰ内距的末端达基节Ⅱ的前1/3,雄虫的内距略微超过基节Ⅱ前缘.雌虫盾板椭圆形.雄虫假头基腹面后缘向后突出或圆角.如图3.

图3 全沟硬蜱形态学鉴定结果Fig.3 Results of morphological identification of Persulcatus ixodes
2.3 分子生物学鉴定结果
2.3.1 病原体的16S r DNA序列相似性分析 采用表2-2的引物对采集到的1 343只蜱针对10种病原体进行PCR检测.结果发现在黑河地区的蜱类中存在立克次体感染的情况,PCR检测得到300 bp左右的片段,将片段与p MD-18T载体链接得到382 bp片段,测序后的基因序列与NCBI进行同源比对后发现,该片段与斑点热群中的劳氏立克次体病原体相似率最高,这种立克次体只在森林革蜱中被检测到,在森林革蜱中的感染率分别为64.37%,随机抽取150个样本进行测序,测序后的基因序列提交GenBank获得的登录号为KC566999,具体种属还要进行下一步鉴定;其次还在黑河口岸的森林革蜱中均检测到巴尔通体,感染率为3.35%,PCR检测得到300 bp左右的片段,将片段与p MD-18T载体连接,经测序后得到378 bp阳性片段,进行同源比对发现与EF662053.1巴尔通体相似率达到了100%,提交GenBank获登录号为k M115550(citrate synthase(glt A)gene);在巴贝西虫的检测中,在黑河口岸的森林革蜱中检测到一种类似巴贝西虫病原体的DNA片段检出率为1.70%,PCR检测得到300 bp左右的片段,将片段与p MD-18T载体连接,经测序后得到356 bp片段,进行同源比对,提交NCBI序列号KC567000,经同源性比对后发现与(Xiphocephalus ellisi small subunit ribosomal RNA gene)FJ459762.1同源性最高达87%;而森林脑炎病毒、伯氏疏螺旋体、嗜吞噬细胞无形体、查菲埃立克体、土拉菌病、新布尼亚病毒及Q热立克次体的的检测结果均为阴性.结果见表4,表5.
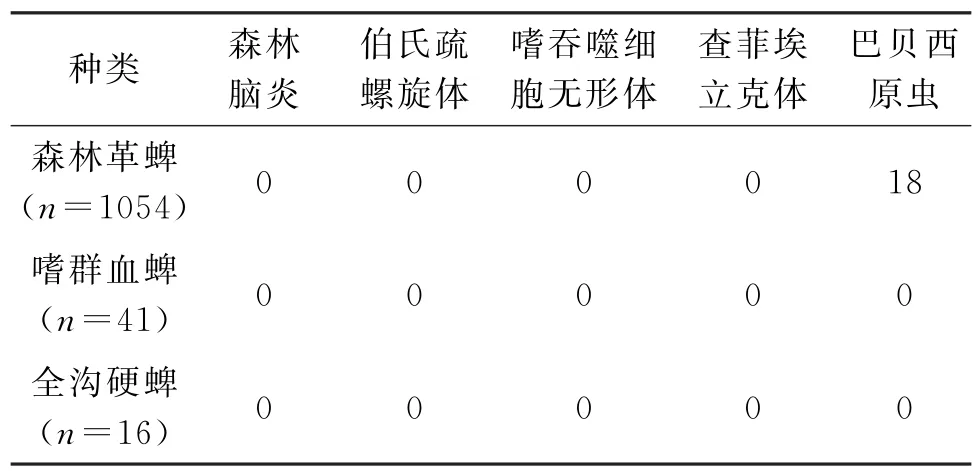
表4 黑河市蜱的种类及病原体检测情况Tab.4 Tick sampled and tick-borne pathogen detected in Heihe area,Heihe

表5 黑河市蜱的种类及病原体检测情况Tab.5 Tick sampled and tick-borne pathogen detected in Heihe area,Heihe
2.3.2 PCR检测结果 对采集自黑龙江省黑河口岸的1 343只蜱标本进行PCR扩增鉴定,发现了立克次体、巴尔通体、类似巴贝西虫均为阳性,图4、图5、图6为这3种病原体的特异性引物扩增结果.
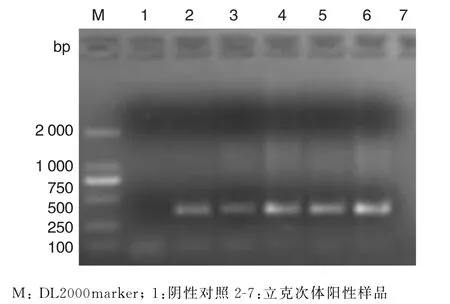
图4 立克次体(属)阳性样品PCR检测结果Fig.4 PCR detection for R.raoultii in D.silvarum

图5 巴尔通体(属)阳性样品PCR检测结果Fig.5 PCR detection for Bartonella sp.
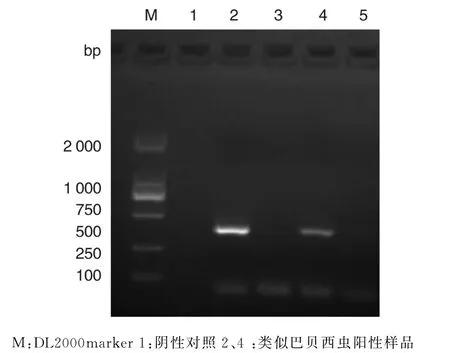
图6 类似巴贝西虫阳性样品PCR检测结果Fig.6 PCR detection for Babesia-like in D.silvarum
3 讨 论
黑河地区与俄罗斯只有一江之隔,境内森林覆盖率为58.5%,在这些边境地区还有物种繁多的野生动物以及珍贵的经济作物和药材资源,因为植物动物种类宿主多样化,所以寄生的蜱虫等媒介也存在多样化,因此病原携带以及发病率也较高[8-9].随着经济的发展,我国与国外的贸易往来以及旅游业的发展也越来越频繁,黑河等地区作为我国北部的口岸,承担着更大的贸易往来,因此我们要时时刻刻关注边境的公共卫生安全[10].本试验针对2012年至2014年的蜱虫进行分类,我们发现在一共采集的1 343只蜱虫中,有一半以上的为森林革蜱,也就是说,在黑龙江省黑河地区靠近口岸的地区是很容易有森林革蜱的出现的,这种情况的产生是由于不同时间以及不同地点的环境、气候及自然因素所导致的.其中全沟硬蜱和嗜群血蜱也占据了总数的一小部分,这也说明了在东北地区这样四季分明,雨季周期也比较长的天气下,这3种蜱虫为最重要的研究对象,我们不能忽视这一问题,就是这3种蜱虫之间有着怎样的联系和互生性,另外,我们也将对这主要的3种蜱虫进行病原体的检测和分析,并且通过简单科学的检测方法进行研究,为该地区的蜱虫的种类和病原体传染性进行总结及评估,为我国的寄生虫研究提供一定的参考资料.
研究发现,在这3种蜱虫中,森林革蜱1 054只,占总体构成78.48%,为优势蜱种;嗜群血蜱236只,占总体构成17.57%;全沟硬蜱53只,占总体构成3.94%.我们也对森林革蜱进行了病原体的检查,结果发现存在立克次体感染的情况,在森林革蜱中的感染率为64.37%,也就是说,立克次体的感染率已经达到了一半以上.因此,在一定意义上讲,森林革蜱仍然是监测新发蜱媒传染病的前哨种类,应引起足够重视.同时,其他蜱种自然感染现象的存在,提示这些蜱媒传染病原的生态复杂性.目前许多欧美等发达国家已经开始重视这些蜱媒传染病的监测和预防工作,他们在这项不容我们忽视的工作中做了大量的工作和投入.本研究PCR技术的研究发现立克次体、巴尔通体、巴贝西虫,初步探讨了他们携带病原体的情况,这为科学评估我国发生这些蜱媒传染病的风险提供了科学依据和基础支持.对于其他几种蜱媒传染病的人群流行情况还有待于进一步研究.
我国至少存在10种立克次体病流行在不同蜱种中对埃立克次体和无形体的检测方面,曹务春等在福建越原血蜱和卵形硬蜱中扩增到查菲埃立克次体,阳性率为55.2%,11.9%和12.0%.赵秋敏等从全沟硬蜱中分离到 HGA[11-12].高东旗等在内蒙古森林革蜱、全沟硬蜱和新疆全沟硬蜱中分离到查菲埃立克次体,阳性率为 39.1%,10.0%和 6.0%.在俄罗斯的诺沃西比尔斯克地区的边缘革蜱及网纹革蜱中分离出这种新型的立克次体,2008年在俄罗斯与中俄口岸相邻的Khabarovsk地区发现了立克次体病原体[13].在中国关于病原体的报道鲜有,2008年曹务春等在中国吉林地区的森林革蜱中发现了立克次病原体,2012年在西藏高原地区的西藏革蜱和银盾革蜱发现了立克次病原体,黑龙江中俄口岸除黑河口岸以外这个病原体的流行还未见报道[14-15].
——劳氏立克次体的研究现状

