超高效液相色谱-四极杆飞行时间质谱法研究菊三七总生物碱致肝毒性的血清代谢组学
林珠灿, 易 开, 许 文, 郭素华
(福建中医药大学药学院,福建福州 350122)
代谢组学是通过考察生物体系受刺激或扰动后,其代谢产物随时间的变化来研究生物体系的一门科学[1]。在现代中药研究中,代谢组学被广泛应用到中药效应物质基础、毒副作用及作用机制等研究[2]。近年对于中药毒性的代谢组学研究已成为国内外研究的热点。针对中药的毒性研究,美国食品药品管理局(FDA)也启动了开展植物药安全性和药物毒性评价的代谢组学计划,荷兰还成立了专门针对中药的代谢组学研究中心[3]。国内已有人报道了基于超高效液相色谱-四极杆飞行时间质谱法(UPLC-Q-TOF MS)和1H-NMR方法的半夏、关木通、附子、朱砂、雄黄[4]及甘遂[5]等药物毒性评价的相关研究。
菊三七又名红背三七、土三七,为菊科菊三七属植物菊叶三七(GynurasegetumMerr.)的根或全草,始载于《滇南本草》,其味甘、微苦,性温,有破血散瘀、止血、消肿之功,主治跌打损伤、创伤出血、吐血、产后血气痛等症[6]。目前对菊三七的药理活性研究较广,主要集中在止血、抗疟、镇痛及抗肿瘤等方面[6],然而近年因服用菊三七的中毒现象屡有发生,其所致肝窦阻塞综合征(Hepatic Sinusoidal Obstruction Syndrome,HSOS)的临床报道日益增多[7],并已引起广泛关注。有研究认为,菊三七具有严重的肝毒性与其所含的吡咯里西啶类生物碱(Pyrrolizidine Alkaloids,PAs),如千里光碱、千里光菲灵碱、菊三七碱甲、碱乙及千里光碱-N-氧化物等[6]有关,但对其肝毒性机制的研究尚处于初步阶段。代谢组学可通过分析与毒性密切相关的生物体体液或组织中代谢产物随时间变化的关系,可以从“组学”的角度评价中药的毒性与安全性,但目前尚未见菊三七总生物碱致肝毒性的代谢组学的研究报道。基于此,本实验采用基于超高效液相色谱-四极杆飞行时间质谱(UPLC-Q-TOF MS)的代谢组学技术,结合主成分分析(PCA)与偏最小二乘法-判别分析(PLS -DA)等模式,分析菊三七总生物碱给药前后大鼠血清代谢产物差异,以期寻找潜在的毒性生物标记物,从代谢角度探讨菊三七总碱致肝毒性的作用机制,为该药民间、临床的合理及安全应用提供科学的实验依据。
1 实验部分
1.1 主要仪器与试剂
Agilent 1290 UPLC和AB Sciex Triple TOF MS 6600系统(美国,Agilent公司);7180型全自动生化分析仪(日本,日立公司)。
天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、总胆红素(TBIL)由浙江康特生物科技有限公司提供;L-2-氯苯丙氨酸(CAS:103616-89-3,≥98%)购自上海恒柏生物科技有限公司;甲醇、乙腈均为质谱级(德国默克公司);其余试剂均为分析纯。
菊三七购于河北安国药材市场,经福建中医药大学药学院车苏容副教授鉴定为菊科菊三七属植物菊叶三七(GynurasegetumMerr.)的干燥根。
1.2 实验方法
1.2.1菊三七总生物碱的制备[8]称取菊三七根800 g,粉碎,用95%乙醇回流提取2次,每次1 h,合并提取液,减压浓缩得浸膏,加200 mL 1%HCl超声溶解20 min,离心,取上清液,加氨水调节pH至11,以二氯甲烷萃取3次,每次200 mL,合并二氯甲烷相,减压回收至干,即得菊三七总生物碱。
1.2.2动物分组与给药取清洁级雄性SD大鼠30只,每只180~220 g(购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2012-0002),随机分成3组,分别标记为空白组、菊三七总碱低剂量组和高剂量组。将总碱用5%HCl溶解,加1 mol/L NaOH溶液调节pH至6,再加生理盐水配制成一定浓度[9]。大鼠适应饲养3 d后,低、高剂量组分别灌胃给予19.7、39.5 mg/kg的总碱[9],空白组给予相应体积的生理盐水,每天1次,连续给药14 d。
1.2.3血清生化指标检测各组大鼠每周在灌胃后,1 h眼眶取血,静置1 h后析出血清,于温度4 ℃下3 000 r/min离心15 min,取上层血清,置于-80 ℃保存。采用全自动生化分析仪检测血清中ALT、AST及TBIL水平(由福建中医药大学附属第三医院检验科检测)。
1.2.4血清处理保存在-80 ℃冰箱的空白组及高剂量组肝毒性大鼠血清,取出复融后,取100 μL血清样本,加入300 μL提取液(甲醇∶乙腈∶水=2∶2∶1),再加入20 μL L-2-氯苯丙氨酸,涡旋混匀30 s,冰水浴超声10 min,4 ℃、12 000 r/min离心15 min,取60 μL上清液于2 mL进样瓶中。同时每个样本各取10 μL 混合成质控(QC)样本,再取60 μL上机待测。
1.2.5色谱与质谱条件[10]色谱条件:色谱柱为ACQUITY UPLC BEH Amide柱(100×2.1 mm,1.7 μm,Waters);流动相A为水(含有25 mmol/L的乙酸铵及25 mmol/L的氨水),B为乙腈,梯度洗脱:0~0.5 min,5%A;0.50~7.0 min,5%→35%A;7.0~8.0 min,35%→60%A;8.0~9.0 min,60%A;9.0~9.1 min,60%→5%A;9.1~12.0 min,5%A;进样体积0.5 μL,流速0.5 mL/min,柱温35 ℃,样品温度4 ℃。质谱条件:AB 6600 Triple TOF MS仪在控制软件(Analyst TF 1.7,AB Sciex)下基于IDA功能进行一级、二级质谱数据采集。在每个数据采集循环中,筛选出强度最强且大于100的分子离子进行采集对应的二级质谱数据。轰击能量:30 eV,15张二级谱图/50 ms。ESI离子源参数如下:雾化气压(GS1):60 Pa,辅助气压(GS2):60 Pa,气帘气压:35 Pa,温度:650 ℃,喷雾电压:5 000 V(正离子模式)或-4 000 V(负离子模式)。
1.2.6数据处理与分析运用XCMS(版本号:1.41.0)开发的xcms4dda和xcms4lipid程序及自建库,将LC-MS原始数据进行色谱峰的寻找与校准,minfrac设为0.5,cutoff设为0.6。利用每个样本的总离子流色谱峰峰面积进行归一化法数据处理。将处理好的分析数据导入SIMCA软件(V14.1,Sweden)进行主成分分析(PCA)和偏最小二乘法-判别分析(OPLS -DA)。以t检验(Student’s t-test)的P值(P-value)小于0.05,同时OPLS -DA模型第一主成分的变量投影重要度(Variable Importance in the Projection,VIP)大于1为标准筛选差异代谢物。
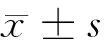
2 实验结果
2.1 菊三七总碱对大鼠血清ALT、AST及TBIL水平的影响
与正常组的大鼠相比,给药1周后,高剂量组ALT显著性升高(P<0.01),低剂量没有显著性差异,AST值则高、低剂量组均有显著上升(P<0.01),但TBIL值无显著性差异,没有统计学意义。给药2周后,高、低剂量组的ALT、AST及高剂量组的TBIL水平皆有显著性升高(P<0.01),见表1。
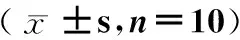
表1 菊三七总碱对大鼠血清ALT、AST 及TBIL的影响
*P<0.05,**P<0.01 compared with the control group.
2.2 大鼠血清代谢轮廓分析
连续给药2周后,空白组和高剂量组大鼠血清经过UPLC-Q-TOF MS分析后,得到两组具有代表性的总离子流(TIC)色谱图,见图1。
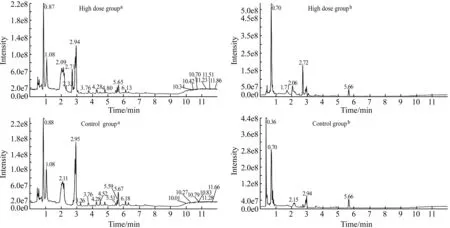
图1 高剂量组和空白组大鼠血清正、负离子扫描的总离子流(TIC)色谱图Fig.1 TIC chromatograms of rat serum samples from the high dose group and control group in positive and negative ion mode a:positive ion mode;b:negative ion mode.
2.3 总碱致肝毒性大鼠血清的PCA分析
对空白组和高剂量组给药2周的大鼠血清LC-MS代谢指纹数据进行PCA分析,见图2。结果表明,在正、负离子扫描模式下,两组血清样本分离显著。说明菊三七总碱致大鼠机体代谢网络产生了明显变化。
2.4 总碱致肝毒性大鼠血清的OPLS -DA分析
为了进一步探讨总碱引起的血清代谢差异,找到与总碱所致肝毒性相关的代谢通道变化。以监督性OPLS -DA法对高剂量组和空白组样本重新建模。通过OPLS -DA分析,可以过滤掉代谢物中与分类变量不相关的正交变量,并对非正交变量和正交变量分别分析,从而获取更加可靠的代谢物的组间差异与实验组的相关程度信息。模型的质量用7折交叉验证进行检验,用交叉验证后得到的R2Y(模型对分类变量Y的可解释性)和Q2(模型的可预测性)对模型有效性进行评判。结果如图3所示,两组血清样本在其中一维得到显著的区分,且各组样本各自集中分布,表明该总碱可能是造成大鼠体内代谢紊乱的主要因素。
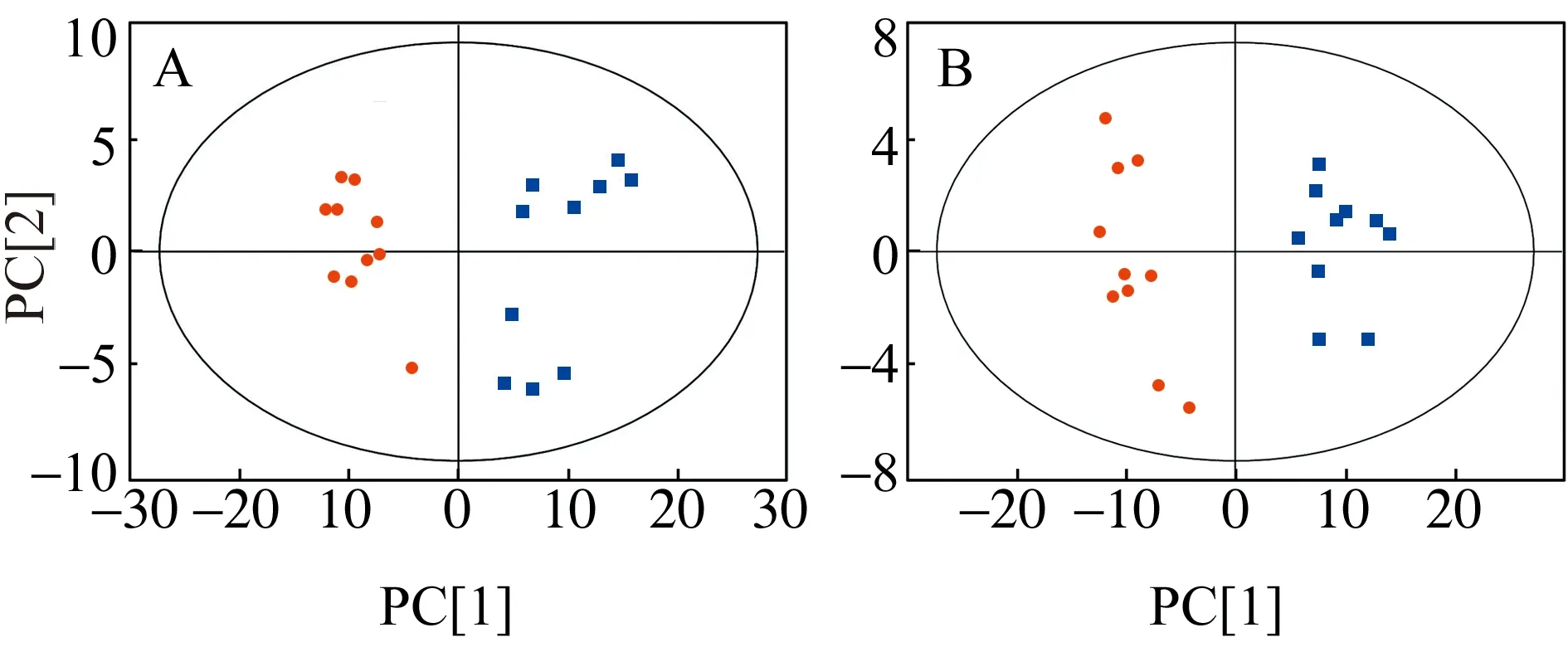
图2 高剂量组()对空白组()的PCA得分散点图(A为正离子扫描模式:R2Xcum=0.741;B为负离子扫描模式:R2Xcum=0.714)Fig.2 Principal components analysis(PCA) score plots of metabolic profiling of rat serum samples from the high dose group() and control group () in positive(A:R2Xcum=0.741) and negative ion mode(B:R2Xcum=0.714)
为了验证所建立模型的有效性,运用置换检验通过随机多次改变分类变量Y的排列顺序(次数n=200)以获取随机模型的R2和Q2值,对OPLS -DA模型的置换检验结果如图4所示,建立的模型符合样本数据的真实情况,原模型可以很好地解释两组样本之间的差异。
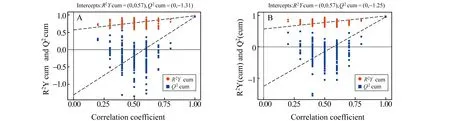
图4 高剂量组对空白组OPLS -DA模型的置换检验结果示意图(A为正离子扫描模式:R2Y(cum)=0,0.57,Q2(cum)=0,-1.31;B为负离子扫描模式:R2Y(cum)=0,0.57,Q2(cum)=0,-1.25)Fig.4 Permutation test model validation plot of OPLS -DA of the high dose group and control group in positive(A:R2Y(cum)=0,0.57,Q2(cum)=0,-1.31) and negative ion mode(B:R2Y(cum)=0,0.57,Q2(cum)=0,-1.25)
2.5 潜在生物标记物的筛选与鉴定
基于高剂量组和空白组大鼠血清样本的OPLS -DA分析,以同时满足t检验的P<0.05,OPLS -DA模型第一主成分的VIP值>1为标准,筛选与总碱致肝毒性高度相关的差异代谢物。通过匹配HMDB,KEEG及自建库等数据库,解析二级质谱,从中筛选鉴定出34个可能的代谢物,见表2。其中,肌氨酸、肌酐、D-脯氨酸、L-丙氨酸、5-羟吲哚乙酸、吲哚丙烯酸、马尿酸代谢水平的下调,酪胺、β-高脯氨酸、L-苯丙氨酸代谢水平的上升,显示菊三七总碱肝毒性可引发氨基酸代谢途径发生紊乱;丙三醇、尿嘧啶、胞苷、脱氧胞苷、5′-单磷酸胞苷、尿苷、2′-脱氧尿苷、嘌呤、黄嘌呤核苷、5-甲基胞嘧啶、5-羟甲基胞苷等代谢水平的变化表明总碱肝毒性可致核苷酸代谢途径异常;肉豆蔻酸、顺-9-棕榈酸、顺-(6,9,12)亚麻酸、亚油酸代谢水平的变化与总碱肝毒性引起脂质代谢紊乱相关;胆酸、甘氨胆酸、牛磺鹅(去氧)胆酸盐、牛磺胆酸盐、甘氨鹅去氧胆酸等代谢水平的上升说明菊三七总碱致肝毒性特征是胆汁淤积型,推测可能由于胆汁不能顺利排出,造成胆汁成分反流至血液,因而血清中胆汁酸类成分明显增高[11]。
*P<0.05,**P<0.01 compared with the control group;avariable importance in the projection.
3 结论
本实验基于UPLC-Q-TOF MS的血清代谢组学方法,从整体代谢指纹谱的角度对菊三七总生物碱致肝毒性潜在生物标记物进行了探索性研究,从血清中筛选鉴定出34个肝毒性高度相关的差异代谢物,初步阐明了菊三七总碱致肝毒性的作用机制主要与氨基酸、核苷酸、脂质等代谢途径及肝肠循环紊乱相关,为菊三七总碱肝毒性的作用机制补充了代谢信息。

