利用DNA免疫技术制备ASB11蛋白的多克隆抗体
蔡英桂,尹丽阳,王宏波,陈 宇,曾 蓉,吴秀山,叶湘漓*
(1.湖南师范大学医学院,湖南 长沙 410013; 2.湖南师范大学生命科学学院心脏发育研究中心,湖南 长沙 410081;3.中南大学湘雅二医院,湖南 长沙 410011)
ASB家族(ankyrin repeat and SOCS box containing protein family,含锚蛋白重复序列-细胞因子信号抑制物盒蛋白家族)因在其氨基端和羧基端分别含有多个串联重复的ankyrin repeat结构域和一个SOCS(suppressor of cytokine signaling)box结构域而得名。ASB的ankyrin repeat结构域最先是在酵母的细胞周期基因Swi/Cdc10和果蝇的Notch基因中发现的,可以与特异性的靶蛋白结合,介导蛋白与蛋白之间的相互作用;该结构域在蛋白中的重复次数最高可达33次,不过多数为6个以下[1,2]。目前已经发现的ASB家族成员共有18个,分别命名为ASB1-ASB18;其中ASB5、ASB9、ASB11、ASB13 和ASB15蛋白的主要序列相似,且都含有6个重复的ankyrin repeat结构域,该特征与ASB家族的其它成员存在明显区别。不同ASB蛋白在其ankyrin repeat结构域的构象以及重复次数等方面的差异性提示其可能通过与不同的靶蛋白相结合而参与不同的生理过程[3-5]。
斑马鱼的Asb11与人类的ASB11高度同源。已有的研究表明,斑马鱼的Asb11基因位于第9号染色体上,含7个外显子,cDNA全长为882 bp,编码293个氨基酸,分子量约为32 kD;人类的ASB11基因位于Xp22.31上,由7个外显子构成,亚细胞定位显示ASB11蛋白在细胞质和细胞核中均有表达。斑马鱼的Asb11是体内经典Notch信号传导的正调节因子,参与泛素化过程,影响胚胎神经祖细胞的发育,该过程依赖于Asb11蛋白的SOCS box[6,7]。SOCS box是ECS型E3泛素连接酶复合物的底物识别模块,SOCS box域分为BC框和Cul框基序,Asb11的Cul5框是正确表达Notch靶基因的前提,缺乏Cul5框的斑马鱼突变体在Notch信号传导方面存在明显缺陷[8]。此外,Asb11是胚胎和成体再生性肌发生的主要调节者,也是肿瘤发生的候选基因之一[9-11]。ASB11可能参与了心脏和肌肉组织的发育过程,有关ASB11的研究对于揭示心脏发育中的相关信号通路和分子调控机理具有重要的意义。
DNA免疫是将包含目标蛋白DNA或者cDNA的重组真核表达载体直接注射到动物的肌肉、皮下或者腹腔等部位,利用宿主的转录系统合成外源目标蛋白抗原,并激活宿主的免疫系统,诱导免疫应答的发生[12-14]。DNA免疫的应答强弱与其表达载体表达抗原的能力以及免疫接种的途径有关,其中,表达载体的表达能力主要取决于载体上的启动子和增强子的强弱,而不同的免疫途径产生免疫应答的机制和效果也不同。肌肉注射是最常见的DNA导入方式,具有操作简便、免疫接种容量大、引起免疫反应持续时间长等特点[15,16]。真核表达质粒pCAGGS-P7是DNA免疫研究中最常用的质粒载体之一,含有鸡的β-actin真核启动子和CMV增强子,可使下游插入基因能在哺乳动物中高效表达,从而增强免疫效果[17,18];而多个酶切位点利于目标片段的插入,Poly A可保证目标mRNA在体内的稳定性。
本研究将带有斑马鱼ASB11 cDNA的pCAGGS-P7/ASB11重组表达质粒通过肌肉注射到小鼠中,使其在小鼠体内引起免疫应答,经过多次免疫后,提取相应的血清进行Western Blot和免疫荧光,检测制备的多克隆抗体的免疫效果,以期为后续的功能研究奠定基础。
1 材料与方法
1.1 菌株、质粒、细胞和主要试剂
DH5α感受态细胞、真核表达质粒pCAGGS-P7以及人肺癌A549细胞为湖南师范大学心脏发育中心保存;BALB/c小鼠购自湖南斯莱克景达实验动物有限公司;高保真酶试剂盒、一步克隆试剂盒购自南京诺唯赞生物科技有限公司;DNA纯化回收试剂盒、质粒提取试剂盒购自北京康为世纪生物公司;鼠二抗购自CST公司。限制性内切酶KpnI、XhoI(Takara公司,日本);常规RPMI1640培养基(北京全式金生物技术有限公司);10%新生牛血清FBS(Invitrogen公司,美国);10 mmol/L Hepes(北京索莱宝科技有限公司),用于细胞培养,培养条件为37 ℃、5%CO2。
1.2 引物的设计与合成
在NCBI网站上搜索斑马鱼Asb11基因的cDNA序列,并以该序列为模板,利用Primer5.0软件设计引物P1、P2。在P1、P2引物前均加入同源臂序列,同源臂序列中分别引入限制性内切酶KpnI、XhoI识别位点。引物由上海生物工程公司合成,序列如下(下划线序列为内切酶KpnI、XhoI的识别位点):P1(pCAGGS-P7-Asb11-F):CTATAGGGCGAATTGGGTA CCTTTAGTTTAGAGATGGCCGTGG;P2(pCAGGS-P7-Asb11-R):ATCGATACCGTCGACCTCGAGGTGACACT TGACAATGTTTATCGG。
1.3 pCAGGS-P7/ASB11表达质粒的构建
首先,用Trizol从发育至24 h的AB品系斑马鱼胚胎中提取总RNA,反转录合成cDNA。然后以cDNA为模板,用上述P1、P2引物进行高保真PCR扩增,成功扩增出长度为964 bp的Asb11基因片段。反应条件为:95 ℃预变性3 min,95 ℃变性15 s,56 ℃复性15 s,30个循环,72 ℃延伸30 s,4 ℃保存。获得的PCR产物琼脂糖电泳后,用DNA纯化回收试剂盒回收目的片段。最后与用限制性内切酶KpnI和XhoI双酶切pCAGGS-P7质粒回收的约5 000 bp片段,用T4 DNA连接酶4℃连接过夜。
1.4 转化及重组质粒的鉴定
将上述连接产物转化至DH5α感受态细胞,经氨苄青霉素抗性筛选后,挑取阳性单克隆至氨苄抗性的LB液体培养基中,200 r/min,37 ℃振荡培养14 h。以P1、P2为引物进行菌液扩增,经琼脂糖凝胶电泳后初步确定重组质粒pCAGGGS-P7/ASB11阳性克隆,将阳性的重组质粒进行测序鉴定。
1.5 DNA免疫技术制备小鼠抗ASB11抗体
用pCAGGGS-P7/ASB11重组质粒免疫6~8周龄的小鼠:电击处理5只小鼠后,在其肢股四头肌部位注射浓度为700 ng/μL的重组质粒,每只小鼠注射40 μL。同时用未插入片段的pCAGGGS-P7空载质粒DNA等量注射5只小鼠作为对照组。注射时间段为0 d、21 d、28 d,共重复注射三次,于第35 d取血并分离血清,分装后的血清于-80 ℃冰箱保存。
1.6 Western-blot检测ASB11多克隆抗体效价
将发育至24 h的AB型斑马鱼胚胎收集于1.5 mL的EP管中,加入裂解试剂(RIPA)和蛋白酶抑制剂后充分研磨,在4 ℃摇床静置30 min后,沸水煮10 min,转速为12 000 r/min,离心5 min;取上清,加入5×的蛋白上样Loading,12 000 r/min,离心2 min。然后取30 μL的样品,SDS-PAGE凝胶电泳2 h,凝胶半干转膜15 min,5%脱脂牛奶室温封闭1 h,加入DNA免疫产生的ASB11抗血清作一抗,用免疫前血清做阴性对照,37 ℃摇床孵育2 h。最后,用TBST洗涤3次后加入1∶1 000抗小鼠的二抗,室温孵育2 h,TBST洗涤3次后显影观察。
1.7 免疫荧光检测ASB11多克隆抗体效价
将人肺癌A549细胞以合适的密度接种于玻底培养皿培养48 h,吸去培养基,PBS清洗2次,3 min/次;用4%多聚甲醛室温固定20-30 min,PBS洗3次,5 min/次;然后用0.2%的Triton-X-100室温通透20 min,PBS清洗3次,5 min/次;加入5%BSA封闭液,室温封闭30 min后,吸掉封闭液。
实验组用DNA免疫产生的ASB11抗血清1∶50稀释,室温孵育2 h,对照组则用等体积的免疫前血清孵育。在避光条件下,用0.1%的PBST洗3次后,滴加稀释好的荧光二抗,室温孵育2 h,PBST浸洗3次,5 min/次。滴加DAPI孵育10 min(DAPI按1∶1 000稀释),PBST洗3次,5 min/次,在共聚焦显微镜或荧光显微镜下观察采集图像。
2 结果与分析
2.1 真核表达质粒pCAGGS-P7/ASB11的构建及鉴定
以P1、P2引物PCR扩增后得到约964 bp的目标条带,对PCR产物进行纯化(图1)。然后将目标片段连接到pCAGGGS-P7质粒的KpnI和XhoI酶切位点之间,构建重组质粒pCAGGGS-P7/ASB11(图2)。将重组质粒进行转化后获得单克隆菌液,提取质粒,进行酶切初步验证(图3),并将质粒进行测序,进一步确定重组质粒序列的准确性。结果表明pCAGGGS-P7/ASB11重组质粒的序列与NCBI上ASB11序列一致,pCAGGS-P7/ASB11重组质粒构建成功。
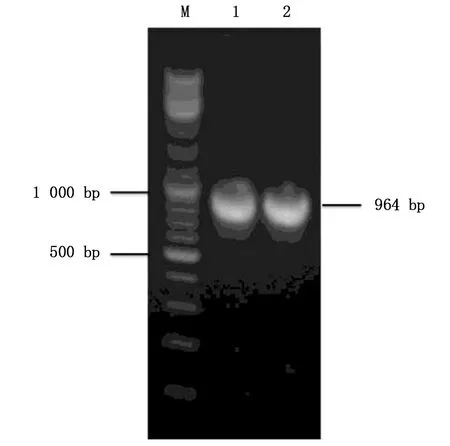
图1 Asb11基因的PCR产物纯化回收电泳图Fig.1 Electropherogram of purification and recovery of Asb11 PCR productsM:DNA marker; 1,2:Asb11基因PCR产物纯化回收电泳条带M:DNA marker;1, 2: Asb11 gene PCR product purification and recovery of electrophoretic bands

图2 pCAGGGS-P7/ASB11重组质粒示意图Fig.2 Construction of pCAGGGS-P7/ASB11 recombinant plasmid

图3 pCAGGGS-P7/ASB11重组质粒酶切验证图Fig.3 Verification of pCAGGGS-P7/ASB11 recombinant plasmid digestionM:DNA Marker;1-9:Kpn I、Xho I酶切质粒结果;2、3、5、7、8、9号泳带为与预期目的条带大小相近的条带M:DNA marker;1-9: Plasmid digestion results: the bands 2, 3, 5, 7, 8, and 9 are similar to the size of the intended destination band
2.2 ASB11多克隆抗体的Western-blot鉴定
提取发育至24 h的AB型斑马鱼胚胎总蛋白进行Western-blot检测。将制备的ASB11多克隆抗体作为一抗,分别以1∶100和1∶400的稀释比进行孵育,结果显示免疫后血清在32 kD处有一条特异的杂交带出现,并且稀释比为1∶400时杂交信号仍然非常明显(图4)。这些结果说明免疫后的小鼠血清中产生了ASB11蛋白的特异性抗体,该抗体的特异性和敏感性良好,可以满足后续相关实验的需要。

图4 ASB11多克隆抗体Western blot鉴定Fig.4 Western-blotting of ASB11 polyclonal antibody1:免疫前血清; 2:抗体稀释比为1∶100; 3:抗体稀释比为1∶4001:Control;2:The antibody dilution ratio: 1∶100;3:The antibody dilution ratio: 1∶400
2.3 ASB11多克隆抗体免疫荧光鉴定
免疫荧光实验表明,DNA免疫制备的ASB11抗血清检测人肺癌A549细胞中有较强特异性荧光,而阴性对照无明显的特异性荧光(图5),即DNA免疫产生的ASB11多克隆抗体能够识别自然状态下的ASB11蛋白。
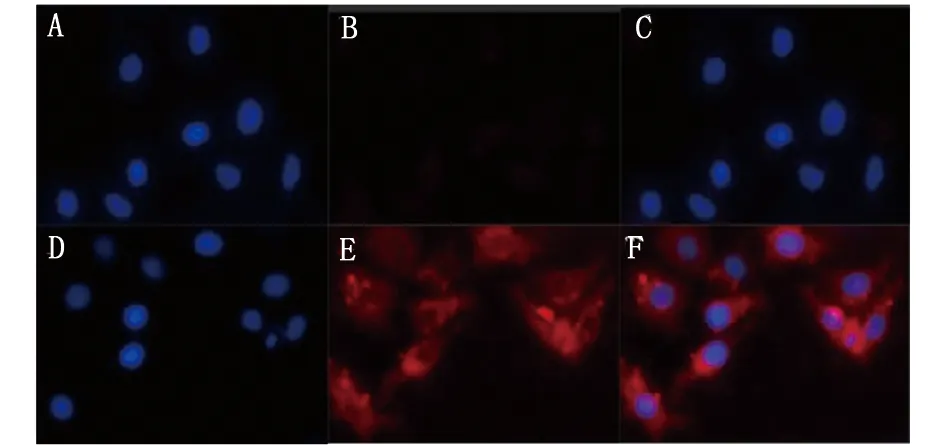
图5 免疫荧光检测多克隆抗体的特异性Fig.5 Detection of polyclonal antibodies specificity by immunofluorescenceA:免疫前血清免疫的细胞核染色;B:免疫前血清免疫的ASB11蛋白;C:免疫前血清免疫的merge图;D:ASB11多克隆抗体免疫的细胞核染色;E:ASB11多克隆抗体免疫的ASB11蛋白的表达;F:ASB11多克隆抗体免疫的merge图A: Nuclear staining of serum immunization before immunization;B: Expression of ASB11 protein in serum before immunization;C: Merge diagram of serum immunization before immunization;D: Nuclear staining immunized with ASB11 polyclonal antibodies;E: Expression of ASB11 protein immunized with ASB11 polyclonal antibody;F: Merge diagram immunized with ASB11 polyclonal antibody
3 讨论
Asb11在脊椎动物中高度保守,研究表明,Asb11在多能和神经定向祖细胞系中的过度表达将抑制末梢神经元的分化;目前Asb11在胚胎发生和成体中的功能仍未得到充分的阐明。值得注意是,斑马鱼的Asb11不仅与人类的ASB11具有同源性,而且与哺乳动物中ASB家族的其它成员也高度同源,尤其是与ASB9高度同源。ASB9在结直肠癌中高度表达,是癌细胞检测中的重要指标[20],ASB11与ASB9高度同源,暗示ASB11可能参与了肿瘤的发生;泛素-蛋白酶体途径是恶性肿瘤发生过程中的关键因子,在ASB11过表达的细胞系中,P53、P21的表达明显上调[10],由此推测ASB11可能与肿瘤的发生相关。有关ASB11的功能研究将有助于阐明胚胎神经祖细胞的发育、再生性肌发生、泛素化以及肿瘤的发生机理,具有重要的意义。
Wolf等人[19]第一次将DNA质粒注射到肌肉中,诱发免疫应答产生特异性抗体,开启了DNA免疫的新篇章。作为近三十年发展起来的新兴免疫技术,DNA免疫技术能很好的模拟天然条件下宿主机体感染病原体产生抗体的过程。刘丽梅[18]等人利用DNA免疫技术,通过将含有鸡的β-actin真核启动子和SV40双启动子的真核表达载体pCAGGS-P7/NV2B免疫小鼠,使下游插入的基因能在小鼠体内高效表达,制备了抗登革热病毒2型NS2B蛋白的多克隆抗体;姜永萍[17]等人利用表达载体pCAGGS显著增强了禽流感DNA疫苗的免疫保护效果;证明DNA免疫反应持久,可持续表达低水平的蛋白抗原。此外,DNA免疫可以直接免疫小鼠,其操作过程简单、用时短、无需纯化蛋白,故较传统的免疫方式而言具有很大的优势。当然DNA免疫亦存在一定的缺陷,如免疫应答不够强烈,所获得的抗体效价也偏低等。总体来说,DNA免疫是一种简单易行的抗体制备方法,尤其适用于分子质量小、不易纯化的蛋白的抗体制备。
本研究通过反转录的方式获得了斑马鱼ASB11的cDNA,将其克隆至改造过的含有鸡β-actin启动子和CMV增强子的pCAGGS-P7真核表达载体上,构建pCAGGS-P7/ASB11重组表达质粒。实验表明,该重组质粒可以在小鼠体内高效表达,肌肉注射较其他注射方法而言更为简便,能诱导CTL特异反应。通过DNA免疫技术成功制备了斑马鱼Asb11基因的多克隆抗体,利用Western-blot以及免疫荧光检测了ASB11多克隆抗体的有效性。在前期成功构建了斑马鱼Asb11基因突变品系的基础上,为后续ASB11基因的功能研究和作用机理研究奠定了基础。

