重症监护病房脓毒症患者病原菌的流行病学特征
冯 清,吴 龙,艾宇航,邓松筠,艾美林,黄 立,刘志勇,张丽娜
(中南大学湘雅医院,湖南 长沙 410008)
脓毒症是指机体对感染反应失调而导致危及生命的器官功能障碍,此脓毒症定义更关注机体应对感染时所发生的复杂病理生理反应[1]。脓毒症是重症监护病房(intensive care unit, ICU)常见的危重症和主要死亡原因之一,脓毒症患者住院时间长,且有长期认知障碍和功能损伤,生活质量严重下降,增加其家庭经济负担及心理负担[2]。炎症因子检测为脓毒症的早期诊断和预后判断提供实验室依据[3],感染源的病原菌培养及药敏试验结果则为脓毒症的抗感染治疗提供精准方向[4]。但近年来,由于抗菌药物的广泛使用以及患者个体差异等原因,脓毒症的耐药菌株不断增加,导致脓毒症治疗困难。因此,开展脓毒症患者医院感染监测,了解其感染病原菌分布及耐药状况,定期检测脓毒症患者病原菌,及时了解流行谱及耐药率的动态变化,对脓毒症患者的治疗有着极其重要的指导意义。本研究通过对2015年1月—2016年6月入住某院ICU的脓毒症患者常见的病原菌种类、分布及对抗菌药物耐药情况进行分析,为指导临床合理使用抗菌药物提供参考依据。
1 对象与方法
1.1 研究对象 选取2015年1月—2016年6月入住某院ICU的脓毒症患者为研究对象。脓毒症诊断标准依据2016年美国重症医学会(SCCM)与欧洲重症医学会(ESICM)联合发布的脓毒症及诊断标准[1]。多重耐药菌判断标准以2011年欧洲疾病控制与预防中心(ECDC)和美国疾病控制与预防中心(CDC)发起制定的关于多重耐药(multi-drug resistance,MDR),泛耐药(extensively drug resis-tance,XDR)和全耐药(pan-drug resistance,PDR)的专家共识[5]为依据。脓毒症最终诊断由三名有经验的临床医生共同判定。
1.2 研究方法 回顾性收集脓毒症患者的呼吸道、泌尿道、血液、腹腔等部位的标本细菌培养和药敏试验等资料。排除同一患者相同部位重复培养分离的菌株,所有菌株均按常规方法进行细菌培养、分离及鉴定。
1.3 仪器及试剂
1.3.1 培养仪及鉴定仪 血标本采用BactAlert 3D 240型自动血培养分析仪(法国生物梅里埃公司)和Bactec FX400型全自动血培养仪(美国BD公司)及其配套专用培养瓶进行培养;腹腔引流液标本接种于脑心浸液肉汤管(含5%羊血);痰、各种分泌物及脓液标本接种于哥伦比亚血平板,麦康凯平板和巧克力平板,采用Vitek 2 Compact全自动微生物生化鉴定仪(法国生物梅里埃公司)进行菌株鉴定和药敏试验。
1.3.2 标准质控菌 以肺炎克雷伯菌ATCC 70063、大肠埃希菌ATCC 25922、金黄色葡萄球菌ATCC 25923、铜绿假单胞菌ATCC 27853和粪肠球菌ATCC 29212为质控菌株,菌株均来源于国家卫生计生委临床检验中心。
1.3.3 药敏试验 药敏试验判定参照美国临床实验室标准化协会(CLSI) 2015年及2016年抗菌药物敏感性试验标准(M25,M26)进行,产超广谱β-内酰胺酶(ESBLs)检测参照CLSI相关标准进行。
1.4 统计方法 应用SPSS 18.0统计软件对数据进行分析。计量资料符合正态分布以均数±标准差表示,不符合正态分布以四分位数表示。计数资料的率和构成比等采用描述性统计分析。
2 结果
2.1 一般资料 2015年1月—2016年6月该院ICU共收集175例脓毒症患者。主要原发疾病为多发伤、胰腺炎、重症肺炎、肠穿孔、泌尿系结石、胆管炎、血液系统感染等;平均年龄为(58±15)岁,其中男性107例,女性68例。APACHE Ⅱ评分为(15.44±6.91)分;序贯器官衰竭评分(sequential organ failure assessment,SOFA)为(9.03±4.87)分;入住ICU时间[M(P25~P75):5(3~10)d];住院时间[M(P25~P75):14(8~23)d];28天病死率29.71%;180天病死率37.14%。175例脓毒症患者中有117例患者检出病原菌,检出率为66.86%。
2.2 病原菌种类及分离率 175例脓毒症患者中检出病原菌241株,其中革兰阴性(G-)菌139株(57.68%),革兰阳性(G+)菌68株(28.22%),真菌29株(12.03%)。分离率居前5位分别为大肠埃希菌(20.75%)、肺炎克雷伯菌(14.11%)、鲍曼不动杆菌(13.28%)、白假丝酵母菌(12.03%)、铜绿假单胞菌(9.54%);检出率居前5位的多重耐药菌(MDRO)分别为鲍曼不动杆菌(90.63%)、屎肠球菌(80.00%)、肺炎克雷伯菌(70.59%)、葡萄球菌属(66.67%)、铜绿假单胞菌(60.87%)。白假丝酵母菌对抗真菌药物普遍敏感。
2.3 不同标本来源的病原菌及MDRO分布 病原菌主要标本来源为腹腔引流液(116株)、痰(53株)、血(50株);MDRO总株数为129株,占53.53%。MDRO标本来源居前3位的分别为痰71.70%(38/53)、血64.00%(32/50)及腹腔引流液47.41%(55/116)。痰标本检出的MDRO以鲍曼不动杆菌、肺炎克雷伯菌为主;血标本检出的MDRO以鲍曼不动杆菌、葡萄球菌属为主;腹腔引流液检出的MDRO以大肠埃希菌、屎肠球菌为主。见表1。
2.4 肠杆菌科的耐药情况 共检出84株肠杆菌科细菌,其中大肠埃希菌50株,肺炎克雷伯菌34株。大肠埃希菌和肺炎克雷伯菌中产ESBLs菌株分离率分别为68.00%(34/50)和17.65%(6/34)。大肠埃希菌对头孢替坦、哌拉西林/他唑巴坦、阿米卡星、厄他培南、亚胺培南耐药率均<10.00%。肺炎克雷伯菌对抗菌药物普遍耐药,仅对替加环素敏感。见表2。
2.5 非发酵菌的耐药情况 非发酵G-菌中鲍曼不动杆菌共检出32株,其中有17株为MDRO,14株为XDR菌株;鲍曼不动杆菌对抗菌药物呈普遍耐药。铜绿假单胞菌共检出23株,未发现对多粘菌素耐药菌株。见表3。

表1 脓毒症患者病原菌种类及MDRO分布情况[菌株数(MDRO株数)]Table 1 Species of pathogens and distribution of MDROs isolated from sepsis patients(No. of isolates[No. of MDROs])

表2 肠杆菌科细菌对常用抗菌药物的耐药率(%)Table 2 Antimicrobial resistance rates of Enterobacteriaceae strains (%)
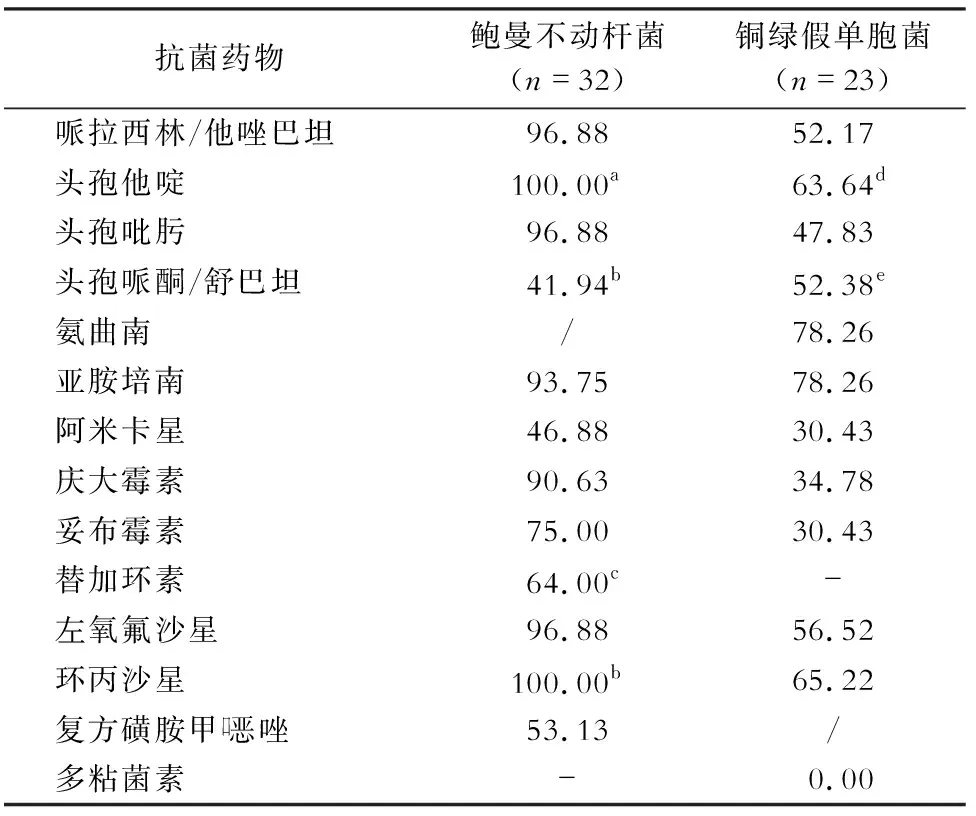
表3 非发酵G-菌对常用抗菌药物的耐药率(%)Table 3 Antimicrobial resistance rates of non-fermentative gram-negative bacteria (%)
2.6 肠球菌属的耐药情况 共分离出肠球菌33株,其中屎肠球菌20株,粪肠球菌13株;屎肠球菌对抗菌药物的耐药率高于粪肠球菌。屎肠球菌对万古霉素及利奈唑胺耐药率均为5.88%(1/16),未发现对替加环素耐药菌株。未发现对利奈唑胺、万古霉素、替加环素耐药的粪肠球菌。见表4。
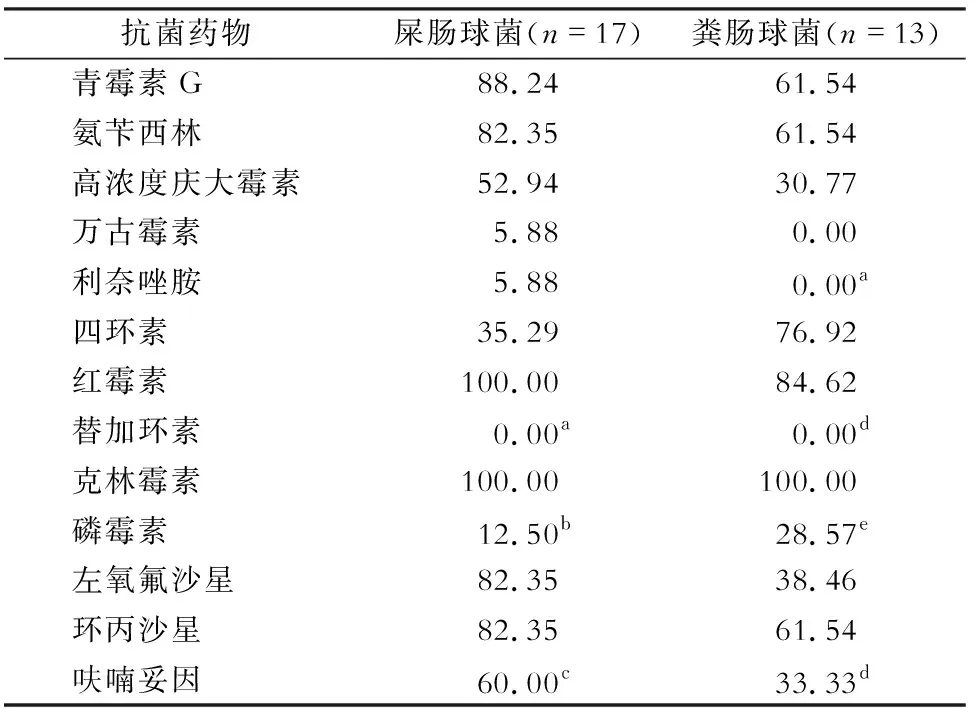
表4 肠球菌属对常用抗菌药物耐药率(%)Table 4 Antimicrobial resistance rates of Enterococcus spp.(%)
2.7 葡萄球菌属的耐药情况 共分离出葡萄球菌属21株,其中凝固酶阳性葡萄球菌11株;凝固酶阴性葡萄球菌10株。葡萄球菌属均对苯唑西林耐药,对呋喃妥因、利奈唑胺、万古霉素、替加环素、四环素、奎奴普丁/达福普汀均敏感。见表5。

表5 葡萄球菌属对常用抗菌药物耐药率(%)Table 5 Antimicrobial resistance rates of Staphylococcus spp.(%)
2.8 真菌的耐药情况 真菌以白假丝酵母菌为主,共29株;对抗真菌药物普遍敏感;尤其对伏立康唑、氟胞嘧啶具有高敏感性。见表6。

表6 白假丝酵母菌对常用抗菌药物耐药情况Table 6 Antimicrobial resistance of C. albicans
3 讨论
脓毒症是严重烧伤、创伤、感染、休克等临床危重患者严重的并发症之一,病情进展迅速,短时间内大量细菌与毒素入血,快速引起机体出现失控的全身炎症反应综合征、多器官功能衰竭(MODS)、脓毒症休克等,导致病死率高[6]。本研究发现,肠杆菌科细菌是引起该院ICU脓毒症的主要G-菌,尤以大肠埃希菌和肺炎克雷伯菌为多,分别居于第1位和第2位,说明脓毒症患者的病原菌主要以G-杆菌为主,这与欧洲国家文献[7]报道的结果相同。大肠埃希菌分离株以腹腔引流液标本分离率最高,为66.00%,且腹腔引流液标本分离的病原菌也以大肠埃希菌为主,占28.45%,提示肠杆菌科细菌是引起腹腔感染相关脓毒症的主要G-菌,以大肠埃希菌最为多见,与国内研究[8]报道的结果相同。
根据2013年中国CHINET检测报告,肠杆菌科细菌对碳青霉烯类抗生素耐药率呈逐年上升趋势。2013年肺炎克雷伯菌对美罗培南、亚胺培南的耐药率分别为13.5%、10%[9]。本研究显示,肠杆菌科细菌对大部分头孢菌素类和喹诺酮类药物的耐药率仍保持在较高水平;大肠埃希菌对β-内酰胺酶抑制剂保持相对高的敏感性,对碳青霉烯类抗生素保持高敏感性;但肺炎克雷伯菌对美罗培南耐药率已达92.31%,对厄他培南的耐药率为50.00%,仅对替加环素有敏感性,可能与其产生碳青霉烯酶(KPC)有关,在我国主要为KPC-2型[10],临床应引起高度重视。如果微生物检测报告中已提示产KPC,临床应慎用单一品种碳青霉烯类抗生素治疗产酶菌株,可与其他种类具有协同或累加作用的抗菌药物联合应用。
全球传播的产超广谱β-内酰胺酶肠杆菌科细菌对公共卫生和医院感染控制带来越来越大的挑战[11]。大肠埃希菌和肺炎克雷伯菌是产ESBLs的典型细菌[12]。早期的ESBLs报告通常是描述由肺炎克雷伯菌肺炎产生的医院暴发的TEM和SHV基因型,而在过去十年的报告中集中在CTX-M基因型上,这已经成为世界范围内绝大多数的ESBLs亚型[13]。本研究发现,大肠埃希菌和肺炎克雷伯菌的ESBLs的检出率仍然很高,分别为68.00%和17.65%。表明这两种产ESBLs代表菌的耐药监测依然不能忽视,应进一步规范抗菌药物的合理应用及各项医疗操作,延缓耐药性的进一步发展。
由于各医疗机构抗菌药物应用管理的差异,ICU内常见病原菌的药物敏感性存在差异,病原菌的耐药谱在不断变化,但总体耐药率呈逐步上升趋势。多种指南建议治疗铜绿假单胞菌的首选药物为亚胺培南和头孢哌酮/舒巴坦,但本研究发现,铜绿假单胞菌对亚胺培南和头孢哌酮/舒巴坦表现较低的抗菌活性,仅对多粘菌素敏感,提示可能出现多重耐药的铜绿假单胞菌,目前对铜绿假单胞菌经验选择用药范围已经很小,需联合用药治疗。
目前鲍曼不动杆菌对常用抗菌药物耐药形势较为严峻。本研究结果提示脓毒症患者检出的鲍曼不动杆菌中53.13%为MDR,43.75%为XDR,痰标本中的鲍曼不动杆菌100%为MDR,与国外[14]研究结果相似。研究还发现鲍曼不动杆菌对替加环素的耐药率为64.00%,但未对多粘菌素耐药性进行检测。前瞻性观察性研究[15]显示,替加环素治疗ICU严重感染患者的成功率与其他抗菌药物的成功率相似;另有多粘菌素联合替加环素与多粘菌素联合亚胺培南/西司他丁治疗鲍曼不动杆菌肺炎的比较研究[16]发现,两组之间差异无统计学意义;提示替加环素在治疗多重耐药鲍曼不动杆菌(MDR-AB)肺炎患者中的治疗效果仍需要进一步充分研究,且ICU细菌耐药性比其他科室严重和复杂,需要临床医务工作者给予更多的关注和进一步深入研究。
本研究发现,屎肠球菌在本研究中耐药率居第2位,且发现1株利奈唑胺耐药和1株万古霉素耐药菌株。欧美国家研究[6,17]显示,G+球菌引起的脓毒症逐渐增加,原因可能因ICU侵入性操作应用广泛,增加医院获得性G+球菌感染发病率。我国耐万古霉素肠球菌感染发病率呈逐年上升趋势,它的产生对临床微生物学和流行病学提出了新的挑战,研究[18]显示金黄色葡萄球菌感染造成的医疗负担正逐年加重。该研究中,共检出21株葡萄球菌属细菌,其中52.38%为耐甲氧西林凝固酶阳性葡萄球菌,低于国内相关研究(耐甲氧西林金黄色葡萄球菌占97.8%)[19]。本研究中也发现葡萄球菌属细菌对四环素、万古霉素、利奈唑胺及替加环素菌均保持较高的敏感性。一项多中心研究[20]显示,在治疗中,使用利奈唑胺和万古霉素分别治疗耐甲氧西林金黄色葡萄球菌感染的肺炎患者的60天病死率相似,但不良事件的发生率中,万古霉素肾毒性发生率较高。故临床中还需要根据患者的具体情况慎重选择敏感的药物,防止药物的毒副作用。
另外,真菌中白假丝酵母菌分离率高。真菌检出率的升高与广谱抗菌药物的应用、患者免疫力低下、侵入性操作增加、糖皮质激素使用增加等有关,临床应引起高度重视。微生物培养及药敏分析对真菌诊断及治疗有重要的作用,但由于微生物培养结果相对滞后,故初始经验性抗感染治疗仍十分重要。经验性抗感染方案选择前需要评估患者是否为MDRO感染,导致发生MDRO感染的危险因素包括长期住院(住院时间>5 d)、入院后医疗保健相关设施以及最近抗菌药物的使用等[21]。
综上所述,该院ICU脓毒症患者所分离的病原菌对常用抗菌药物的耐药较严重,酶抑制剂类、碳青霉烯类和糖肽类抗生素仍然是经验性抗感染治疗的有效药物。在开始经验性抗感染治疗前,应尽早获得可靠的病原学及药敏依据,为抗感染治疗的合理运用提供依据。

