不同分子量的壳聚糖氨基酸衍生物对抑菌活性的影响
冷 懿
(北京林业大学 林学院,北京 100083)
研究表明,壳聚糖的抑菌性能受多种因素的影响,分子量、脱乙酰度(脱乙酰度越高,抑菌性能越好)等都会影响壳聚糖的抑菌性能,其中壳聚糖上氨基对其抑菌性能有重要影响。一般来说,壳聚糖上正电荷越多,其抑菌性能越好。而碱性氨基酸赖氨酸带两个氨基基团,猜想如果壳聚糖上连接赖氨酸可增强其抑菌性能。因此,本实验拟制备不同分子量全脱乙酰壳聚糖,并连接赖氨酸以探讨不同分子量壳聚糖赖氨酸衍生物的抑菌性能,为开发新型壳聚糖类消毒剂提供理论支持。
1 实验材料与器材
材料:壳聚糖(需添加药品试剂)
器材:见表1

表1 实验器材
2 实验流程
原材料壳聚糖→不同分子量壳聚糖的制备→壳聚糖赖氨酸衍生物的制备→抑菌实验→讨论与分析
3 实验具体步骤
3.1 全脱乙酰壳聚糖的制备
称取400g壳聚糖,加入到20%的NaOH溶液中,搅拌均匀,于高压灭菌锅中120℃反应2h。反应结束后于布氏漏斗抽滤,并用蒸馏水多次冲洗滤饼,测其pH,直至洗至中性,将滤饼转移至烘箱60℃烘干称重,得全脱乙酰壳聚糖360g。
3.2 不同分子量壳聚糖的制备
微波辅助降解壳聚糖反应时间与壳聚糖分子量关系的探究
3.2.1 微波辅助法降解壳聚糖
4g全脱乙酰壳聚糖溶于200mL2%(微波反应的容器一次最多反应200mL)的乙酸中过夜待其溶解完全。
将溶解的壳聚糖置于微波反应器中,设置微波反应参数(600w,70℃),加 2mL 30%过氧化氢,启动反应器。 分别于 6min、8min、10min、14min、20min、30min、40min、50min、70min、100min 取样 1~2mL,置于-20℃冰箱中,备用。
3.2.2 HPLC(高效液相色谱法测定壳聚糖分子量)
取分子量为 1000Da,5000Da,12000Da,25000Da,80000Da,270000Da,670000Da,用乙酸/乙酸钠缓冲液配成0.4%溶液,0.22um滤头过滤,HPLC检测,制作标准曲线。将(1)制备的样品融化后用乙酸/乙酸钠缓冲液稀释成0.4%的溶液,0.22um滤头过滤,HPLC检测,测定不同降解时间壳聚糖的分子量。经测定,不同时间降解所得壳聚糖分子量如表2:
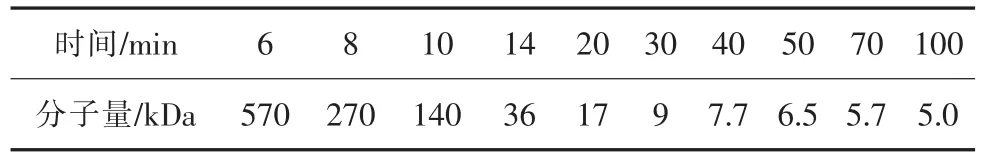
表2 不同时间降解所得聚糖分子量
3.3 特定分子量壳聚糖的制备
采用微波辅助法降解壳聚糖,降解8min、14min、30min、100min这4个时间段的壳聚糖作为实验材料,对应的分子量分别为 270000 Da、36000 Da、9000 Da、5000 Da。
40g全脱乙酰的壳聚糖溶于2L2%的乙酸溶液中,过夜充分溶解。
取200mL溶液加入微波反应器中,600w,70℃反应8min,待反应完全,将溶液倒入烧杯中,并将烧杯置于冷水中冷却,防止壳聚糖分子量继续降解,相同条件反应两次,制得400mL反应8min的壳聚糖。反应液于真空旋转蒸发仪中50℃旋蒸浓缩至200mL,置于冻干盒中于真空冷冻干燥机中冻干得淡黄色粉末状物质。
同样方法制得反应14min、30min、100min的壳聚糖,共制得4种不同分子量的全脱乙酰壳聚糖。
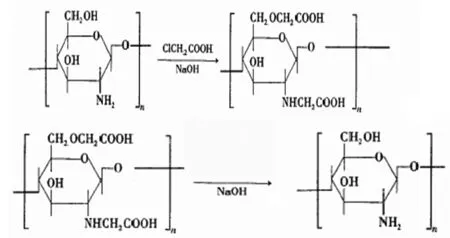
3.4 壳聚糖赖氨酸衍生物的制备
2g三苯基膦溶于20mL的N,N-二甲基甲酰胺中,加3mL的DIAD,冰浴中搅拌溶解,溶解完毕加入50mL甲酰胺,加2g壳聚糖,搅拌10min后加入3.6g赖氨酸。冰浴下搅拌2-3h,然后撤去冰浴,室温反应48h。醇沉抽滤,乙醇多次洗涤,冷冻干燥机中冻干。(按此方法制得4种不同分子量的壳聚糖-赖氨酸衍生物)。
HPLC测定壳聚糖分子量:
3.4.1 缓冲液配制:称取13.6g醋酸钠+11.45mL冰乙酸,1L容量瓶中定容。
3.4.2 0.22um微孔滤膜过滤水和缓冲液
3.4.3 开HPLC,由上往下依次打开仪器各个模块。打开电脑,联机software,新建方法。
四元泵→方法(流量:0.8mL/min;用A泵100%;停止时间 25min;压力限值:min=0,max=45);
TCC:温度左=右=30℃;RID:温度35℃;四元泵→控制→定期清洗。
3.4.4 A泵接水;打开purge,打开泵,排气 10min;连色谱柱,关purge,打开冲洗阀,冲参比30min;关泵连 buffer,开 purge排气 10min;关 purge,打开冲洗阀50min,关闭冲洗阀平衡30min。
3.4.5 进样
配制壳聚糖溶液0.4%
过滤样品,水相接黄滤头,有机相接绿滤头
加样:洗上样针3-5次,吸样品,无气泡,进样20μL。
3.4.6 关闭关泵,换水;开purge排气10min;关purge,开冲洗阀90min;换 30%乙腈平衡30min。
3.4.7 关闭software,电脑,仪器。洗净上样针放好。
3.5 抑菌实验
有关抑菌实验所用到的培养皿、试管、塞子、枪头、棉签、滤纸片等都须在使用前经121℃高压灭菌15min,所用镊子、接种环每次操作前须在酒精灯上灼烧灭菌,冷却后使用。实验操作均在超净工作台中完成。所有操作须严格按照无菌操作的要求完成,避免实验过程中污染微生物。所用受试菌种为金黄色葡萄球菌、大肠杆菌。
3.5.1 菌种活化
3.5.1.1 培养基配制:
将配置好的培养基于121℃高压灭菌15min,冷却至50℃,倒入无菌培养皿中(每个皿倒15~20mL),冷却凝固备用。
3.5.1.2 划线接种:直接用接种环在酒精灯上烧过之后,等之冷却,蘸取待活化的菌种,于培养基上进行之字形划线接种。37℃培养箱中培养18~24h。同样方法重复传代一次。

表3 营养肉汁琼脂培养基配方
3.5.2 菌悬液制备
3.5.2.1 培养基配制 MH培养基 (Mueller-Hinton)成分:牛肉浸粉(牛肉膏);酪蛋白水解物;淀粉。(本实验采用商品化的成品MH培养基);MH液体培养基配制方法:称取MH琼脂12.6g,溶解于300mL蒸馏水中,121℃高压灭菌15min,冷却后,倾入试管中,备用。
3.5.2.2 菌悬液的制备 将活化好的菌种用接种环挑取少许菌体于装有MH培养基的试管中,震荡均匀,制成菌悬液。37℃培养18~24h,备用。
3.5.3 抑菌实验
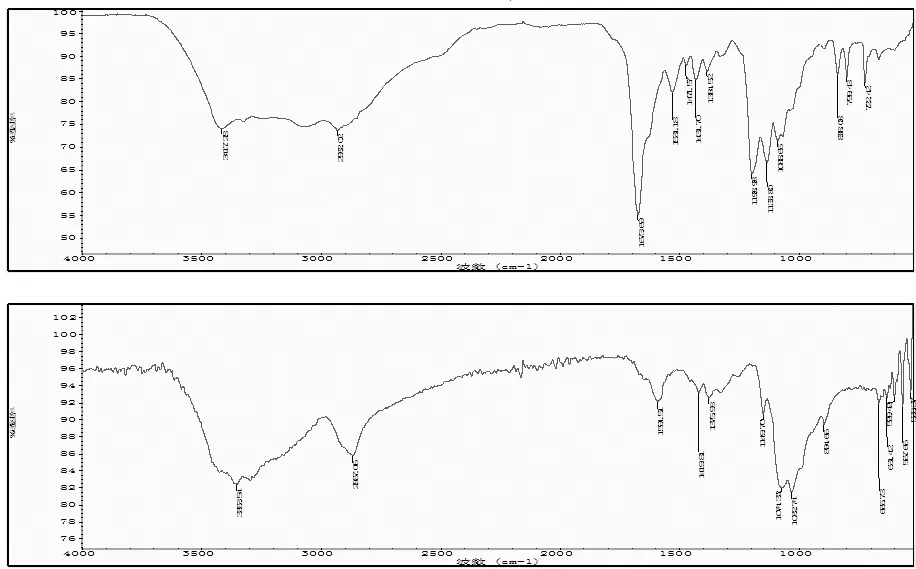
图1 聚糖赖氨酸衍生物(上)与壳聚糖(下)红外图谱对比
3.5.3.1 受试样品准备 制备的4种分子量的壳聚糖-赖氨酸衍生物与壳聚糖原料用2%乙酸分别配成1%、0.1%浓度的溶液,并编号 (CS1~CS4;CS1’~CS4’;CS-L1~CS-L4;CS-L1’~CS-L4’),共计 16 组。
3.5.3.2 培养基配制 MHA培养基(Mueller-Hinton Agar)成分:牛肉浸粉(牛肉膏);酪蛋白水解物;淀粉;琼脂。(本实验采用商品化的成品MHA培养基);MHA培养基配制方法:称取MHA琼脂12.6g,溶解于300mL蒸馏水中,121℃高压灭菌15min,冷却至50℃,倒入无菌培养皿中(每个皿倒15~20mL),冷却凝固备用。
3.5.3.3 含样品滤纸片制备 用移液枪取配好的溶液5μL滴于滤纸片上,待滤纸片晾干后再滴5μL样品溶液,晾干备用。每种样品溶液制作6个含样品的滤纸片。
3.5.3.4 平板接菌 用灭过菌的棉签蘸取菌悬液,均匀涂布于含培养基的培养皿上。大肠杆菌、金黄色葡萄球菌各涂6个培养皿。
3.5.3.5 放滤纸片 将含 CS1~CS4;CS1’~CS4’样品与含碘伏的滤纸片各一个均匀的置于一个含大肠杆菌培养皿中(滤纸片正面朝下放置),将含CSL1~CS-L4;CS-L1’~CS-L4’样品与含碘伏的滤纸片各一个均匀的置于另一个含大肠杆菌培养皿中。同样方式将含样品的滤纸片放于涂布有金黄色葡萄球菌的培养皿中。
做3次重复实验。操作完成,37℃培养24h观察抑菌圈大小。
4 实验结果与分析
以壳聚糖为对照组,发现壳聚糖衍生物对金黄色葡萄球菌的抑菌活性比普通壳聚糖的抑菌活性强,对于金黄色葡萄球菌(革兰氏阳性菌)来说,降解14min制得的(即分子量为270000 Da)壳聚糖衍生物的抑菌效果最好,抑菌活性最高。
5 结论
在本次的课题研究中,我们制备了全脱乙酰壳聚糖,并研究了特定条件下壳聚糖分子量与微波辅助降解时间的关系,制备了一系列特定分子量的额壳聚糖,并制备了相应的壳聚糖赖氨酸衍生物,最后进行了抑菌实验。

表4 对大肠杆菌的抑制作用(抑菌圈直径)

图2 壳聚糖与壳聚糖赖氨酸衍生物对金黄葡萄球菌的抑制作用
通过对比壳聚糖赖氨酸衍生物组与壳聚糖组的抑菌实验结果来看,实验组的抑菌圈普遍大于壳聚糖对照组的抑菌圈,说明对壳聚糖进行赖氨酸衍生化处理可显著增高其抑菌活性。
对大肠杆菌,36000分子量的壳聚糖氨基酸衍生物具有最高的抑菌活性,而对金黄色葡萄球菌,在进行的实验范围内,270000分子量的壳聚糖氨基酸衍生物具有最高的抑菌活性。
实验结果显示,随着分子量的增加,壳聚糖氨基酸对金黄色葡萄球菌的抑致作用逐渐增加,此时并不能判断300000分子量的壳聚糖赖氨酸衍生物具有最高的抑菌活性,其抑菌活性与分子量的关系还需进一步增大分子量进行实验方能验证。
虽然实验组的抑菌效果对比碘伏制剂仍然存在较大差距,但对壳聚糖进行赖氨酸衍生化处理后,其抑菌效果已明显高于壳聚糖,后续可通过进一步的条件优化,如溶剂选择、pH的选择、浓度的调整等方式可进一步增强其抑菌效果。

