不同麻醉方式对直肠癌患者免疫功能的影响*
王晖,杨春艳,宋宇龙,杨瑞,王臻
(陕西省人民医院 麻醉科,陕西 西安 710068)
随着腹腔镜手术的广泛应用,近年来有研究指出,术中二氧化碳CO2气腹和某些麻醉方式会对机体免疫系统产生影响,进而影响患者预后[1-4]。急性高容量血液稀释(acute hypervolemic hemodilution,AHH)是指术前快速输注一定量的晶体液或胶体液,从而使血容量保持高容状态[5]。有研究显示,用羟乙基淀粉进行容量治疗,可以有效改善腹膜巨噬细胞免疫功能[6]。本研究旨在探讨不同麻醉方式对CO2气腹腹腔镜下直肠癌手术患者围手术期免疫功能的影响,为临床麻醉方式的选择提供参考。
1 资料与方法
1.1 一般资料
采用前瞻性队列研究设计的方法,选取2013年1月-2015年12月该院住院治疗并行CO2气腹腹腔镜下直肠癌切除术患者294例为研究对象。其中,男性185例,女性109例;年龄≥18岁,平均(50.3±10.1)岁。将患者按照麻醉方式的不同分为单纯全身麻醉(general anesthesia,GA)组76例、硬脊膜外腔麻醉复合GA(epidural combined general anesthesia,EA)组123例及EA下6%羟乙基淀粉液急性高容量血液稀释(epidural anesthesia combined with 6% hydroxyethyl starch solution acute hemodilution,EA+AHH)组89例。纳入标准:①符合美国麻醉医师协会麻醉分级(american society of anesthesiology,ASA)Ⅰ、Ⅱ级;②经病理检查明确诊断,此前未进行放化疗。排除标准:①患有免疫性疾病、内分泌疾病和严重心、肺及肾等重要器官损伤;②均未使用过激素和免疫类药物;③对羟乙基淀粉无过敏史。所有患者术后随访时间1个月,期间无患者死亡。288例患者完成随访,失访6例。本研究通过医院伦理委员会批准,患者及其家属均知情同意。
1.2 方法
1.2.1 麻醉方法 麻醉诱导前30 min肌内注射阿托品0.50 mg,苯巴比妥钠0.10 g,咪唑安定0.04 mg/kg,依托咪酯0.30 mg/kg,罗库溴铵0.60 mg/kg,芬太尼2.00~4.00 μg/kg静脉注射进行麻醉诱导;诱导满意后行气管插管,连接呼吸机控制患者呼吸(呼吸频率12~14次/min,呼气末二氧化碳分压35~45 mmHg)。GA组给予单纯GA,术中使用瑞芬太尼0.10 μg/(kg·min)、维库溴铵 0.10 μg/(kg·min)静脉泵入及1%~3%七氟醚持续吸入进行麻醉维持。EA组和(EA+AHH)组给予全身麻醉联合硬脊膜外腔阻滞麻醉,以L2~L3椎间隙为穿刺点,以2%利多卡因4 ml/kg为试验量测麻醉平面,将麻醉平面上界控制在T8~T10,待硬膜外阻滞确认后再行GA诱导,术中间断硬膜外注射0.50%罗哌卡因与1.0%利多卡因合剂维持麻醉平面和麻醉深度。EA+AHH组于手术开始前30 min给予局部麻醉并行颈内静脉穿刺置管,输注6%羟乙基淀粉130.0/0.4扩容(15 ml/kg,50 ml/min),密切监控中心静脉压。术中依据患者心率(HR)、血压等生命体征指标变化调整补液速度和七氟醚吸入浓度,术毕前10 min终止麻醉。
1.2.2 资料采集 除常规病历资料外,所有患者手术前均测量身高、体重,计算 BMI= 体重(kg)/身高(m)2。手术过程中持续监测HR、心电图(electrocardiogram,ECG)、血氧饱和度(blood oxygen saturation,SPO2)、收缩压(SBP)、舒张压(DBP)及平均动脉压(MAP)变化。手术后待患者意识恢复,采用视觉模拟评分(visual analogue scale,VAS)量表评估其躯体疼痛情况。记录患者术后48 h内出现的恶心、呕吐、头晕及呼吸抑制等不良反应。当患者临床表现符合≥3项下述标准时判定为临床感染:①血清或体液细菌培养阳性;②术后4 d白细胞>10×109个/L;③影像检查发现感染灶或被手术证实;④术后4 d体温>37.5℃。
1.2.3 免疫功能相关指标检测 分别于麻醉诱导前30 min(AHH前,T0)、手术开始时(T1)、手术开始后 1 h(T2)、手术结束(T3)、术后 24 h(T4)及术后72 h(T5)采集静脉血。其中3 ml肝素抗凝后,立即送至该院中心实验室进行检测,采用FACS-420型流式细胞仪(美国BD公司)测定自然杀伤细胞(NK)、总T淋巴细胞(CD3+)、辅助T淋巴细胞(CD4+)及抑制T淋巴细胞(CD8+)水平,并计算CD4+/CD8+;酶联免疫吸附双抗夹心法检测血浆肿瘤坏死因子α(TNF-α)和白细胞介素6(IL-6)水平(购自武汉博士德生物公司),比浊法测定IgG、IgM及IgA和补体成分C3、C4水平。
1.2.4 分析指标 分析性别、年龄、BMI、ASA分级及肿瘤Dukes分期;手术时间、术中出血量,AHH前、AHH后及术后HR、SaPO2、SBP、DBP和MAP变化;术后苏醒后即刻VAS评分;术后不良反应和感染发生情况;各时间CD4+、CD8+、NK细胞及CD4+/CD8+比例;外周静脉血IgG、IgM及IgA和补体成分C3、C4水平;血清中TNF-α、IL-6水平。
1.3 统计学方法
数据分析采用Excel表格和SPSS 13.0统计软件,计量资料以均数±标准差(±s)表示,比较采用单因素方差分析或重复测量设计的方差分析,两两比较采用LSD-t检验,治疗前后比较采用配对t检验;计数资料以率(%)表示,比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组一般资料比较
3组年龄、性别、BMI、ASA分级及肿瘤Dukes分期比较,差异无统计学意义(P>0.05),具有基线可比性。见表1。

表1 3组一般资料比较
2.2 3组术中情况比较
3组手术时间、术中出血量比较,差异无统计学意义(P>0.05)(见表2)。3组AHH前后及术后检测HR、SpO2、SBP、DBP和MAP水平,采用重复测量设计的方差分析,结果:①3组不同时间点的HR、SpO2、SBP、DBP和MAP水平有差异(F=226.094、117.323、293.654、230.757和 315.460,均P=0.000);②3组间在AHH后的SBP、DBP和MAP水平有差异(F=83.167、44.270和 36.977,均P=0.000),EA+AHH组与GA组和EA组比较,SBP、DBP和MAP水平均较高,血压波动相对平缓;③3组的HR、SpO2、SBP、DBP和MAP变化趋势有差异(F=654.895、325.640、172.260、365.718 和 390.391,均P=0.000)。见表 3。
2.3 3组术后恢复、并发症发生情况及感染比较
3组术后恢复、并发症发生情况及感染方面比较,差异有统计学意义(P<0.05)。EA组和EA+AHH组术后苏醒后即刻VAS评分均低于GA组(P<0.05);EA组和EA+AHH组术后恶心、呕吐及头晕发生例数均低于GA组,且EA+AHH组呕吐发生例数低于EA组(P<0.05)。术后1个月内感染方面比较,差异有统计学意义(P<0.05)。EA组低于GA组;EA+AHH组4低于GA组和EA组(P<0.05)。提示硬脊膜外腔麻醉复合GA联合使用AHH能有效减少患者术后并发症和感染的发生,促进患者康复。见表4。
表2 3组手术时间、术中出血量比较 (±s)

表2 3组手术时间、术中出血量比较 (±s)
组别 手术时间/min 术中出血量/ml GA组(n =76) 128.5±15.3 274.2±40.1 EA组(n =123) 132.4±13.7 269.5±39.8 EA+AHH 组(n =89) 130.5±12.4 270.9±37.1 F值 0.773 0.149 P值 0.465 0.862
2.4 3组围手术期细胞免疫功能变化比较
3 组 T0~ T5时间的外周血 CD3+、CD4+、CD8+、CD4+/CD8+T细胞亚群及NK细胞比较,采用重复测量设计的方差分析,结果:①3组不同时间点的CD3+、CD4+、CD8+、CD4+/CD8+T细胞亚群及NK细胞有差异(F=303.758、633.994、342.353、10.257 和 72.954,均P=0.000);②3组间的CD3+、CD4+和NK细胞有差异(F=159.615、69.801和3.565,P=0.000、0.000和0.026)。EA+AHH组与GA组和EA组比较,CD3+、CD4+和NK细胞较高,对机体细胞免疫影响较小;③ 3组的 CD3+、CD4+、CD8+、CD4+/CD8+T细胞亚群及NK细胞变化趋势有差异(F=139.717、107.383、117.669、3.659 和 13.199,P=0.000、0.000、0.000、0.012和0.000)。见表5。
2.5 3组体液免疫功能变化比较
3组T0~T5时间的外周血IgG、IgM、IgA、C3及C4水平比较,采用重复测量设计的方差分析,结果:①3组不同时间点的外周血IgG、IgM、IgA、C3及C4水平有差异(F=583.360、38.359、62.890、387.143和 109.710,均P=0.000);② 3组间的 IgG、IgA、C3及C4水平有差异(F=3.857、4.466、3.322和3.309,P=0.023、0.022、0.041和 0.040)。EA+AHH 组 与 GA组和EA组比较,IgG、IgA、C3及C4水平较高,对机体体液免疫影响较小;③3组IgG、IgM、IgA、C3及C4水平变化趋势有差异(F=74.983、9.273、32.348、97.004和63.166,均P=0.000)。提示硬脊膜外复合GA联合使用AHH较其他麻醉方式能更好的改善CO2气腹腹腔镜下直肠癌手术患者围手术期的体液免疫功能。见表6。
表3 3组术中血液动力学变化比较 (±s)
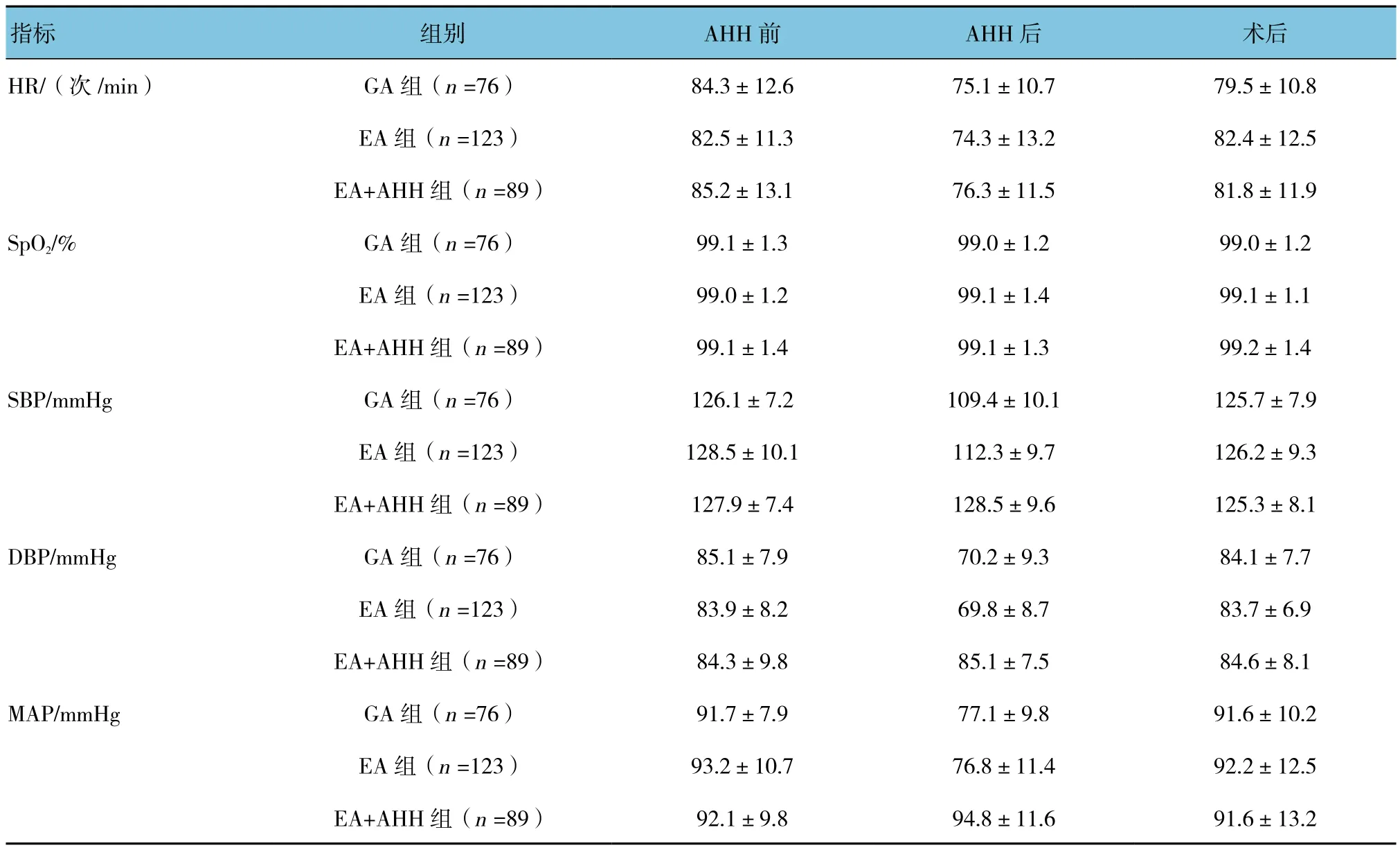
表3 3组术中血液动力学变化比较 (±s)
指标 组别 AHH前 AHH后 术后HR/(次/min) GA组(n =76) 84.3±12.6 75.1±10.7 79.5±10.8 EA 组(n =123) 82.5±11.3 74.3±13.2 82.4±12.5 EA+AHH 组(n =89) 85.2±13.1 76.3±11.5 81.8±11.9 SpO2/% GA组(n =76) 99.1±1.3 99.0±1.2 99.0±1.2 EA 组(n =123) 99.0±1.2 99.1±1.4 99.1±1.1 EA+AHH 组(n =89) 99.1±1.4 99.1±1.3 99.2±1.4 SBP/mmHg GA组(n =76) 126.1±7.2 109.4±10.1 125.7±7.9 EA 组(n =123) 128.5±10.1 112.3±9.7 126.2±9.3 EA+AHH 组(n =89) 127.9±7.4 128.5±9.6 125.3±8.1 DBP/mmHg GA组(n =76) 85.1±7.9 70.2±9.3 84.1±7.7 EA 组(n =123) 83.9±8.2 69.8±8.7 83.7±6.9 EA+AHH 组(n =89) 84.3±9.8 85.1±7.5 84.6±8.1 MAP/mmHg GA组(n =76) 91.7±7.9 77.1±9.8 91.6±10.2 EA 组(n =123) 93.2±10.7 76.8±11.4 92.2±12.5 EA+AHH 组(n =89) 92.1±9.8 94.8±11.6 91.6±13.2
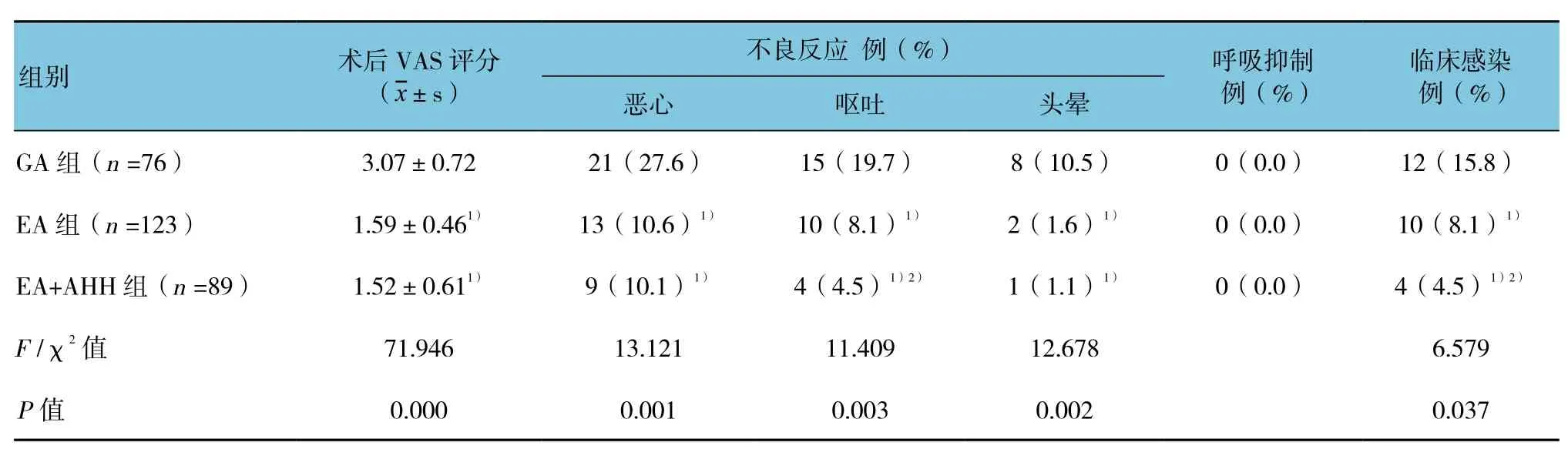
表4 3组术后恢复、并发症发生情况及感染比较
2.6 3组血清炎症因子水平变化比较
3组T0~T5时间的血清炎症因子IL-6和TNF-α水平比较,采用重复测量设计的方差分析,结果:①3组不同时间点的IL-6和TNF-α水平有差异(F=697.009和551.720;均P=0.000);②3组间的IL-6和TNF-α水平有差异(F=8.145和5.503,P=0.004和0.011),EA+AHH组与GA组和EA组比较,IL-6和TNF-α水平较低;③3组的IL-6和TNF-α水平变化趋势有差异(F=328.603和234.898,均P=0.000)。见表 7。
表5 3组围手术期细胞免疫功能变化比较 (%,±s)

表5 3组围手术期细胞免疫功能变化比较 (%,±s)
指标 组别 T0 T1 T2 T3 T4 T5 CD3+ GA 组(n =76) 61.7±7.8 52.8±7.7 51.3±6.2 42.5±8.8 47.2±6.1 52.1±7.2 EA 组(n =123) 58.2±9.3 53.4±5.2 52.1±4.9 49.8±7.4 54.8±8.0 56.9±7.6 EA+AHH(n =89) 59.6±8.2 56.2±6.1 57.9±5.8 55.4±6.9 56.1±6.7 58.8±6.3 CD4+ GA 组(n =76) 36.8±6.4 28.5±6.3 27.2±7.2 21.1±5.5 22.4±6.9 27.7±7.4 EA 组(n =123) 37.2±5.9 34.6±5.2 33.5±4.7 26.8±6.1 27.9±5.2 32.1±7.0 EA+AHH(n =89) 37.1±7.2 36.3±6.81 35.9±4.4 34.4±6.9 35.4±5.0 36.8±6.3 CD8+ GA 组(n =76) 24.3±3.2 23.2±4.3 22.5±4.2 21.8±3.9 22.2±4.3 23.3±4.1 EA 组(n =123) 23.1±3.5 23.0±3.1 22.8±4.4 21.6±4.3 22.9±3.9 23.2±3.2 EA+AHH(n =89) 23.8±4.1 23.8±3.3 23.6±3.6 23.7±3.1 24.0±3.7 23.9±3.5 CD4+/CD8+ GA 组(n =76) 1.5±0.6 1.4±0.3 1.3±0.4 1.2±0.2 1.1±0.4 1.2±0.3 EA 组(n =123) 1.6±0.3 1.5±0.2 1.4±0.3 1.4±0.5 1.4±0.3 1.5±0.4 EA+AHH(n =89) 1.5±0.4 1.5±0.5 1.4±0.4 1.4±0.3 1.5±0.2 1.6±0.5 NK细胞 GA组(n =76) 17.0±6.9 17.1±3.2 16.2±4.2 15.0±4.1 15.5±3.7 16.7±3.5 EA 组(n =123) 17.2±5.4 17.3±4.1 16.9±3.8 16.1±4.4 16.8±3.6 17.9±4.0 EA+AHH(n =89) 17.1±5.7 17.9±5.1 17.5±4.3 17.3±3.1 17.3±4.2 17.7±3.7
表6 3组体液免疫功能变化比较 (g/L,±s)
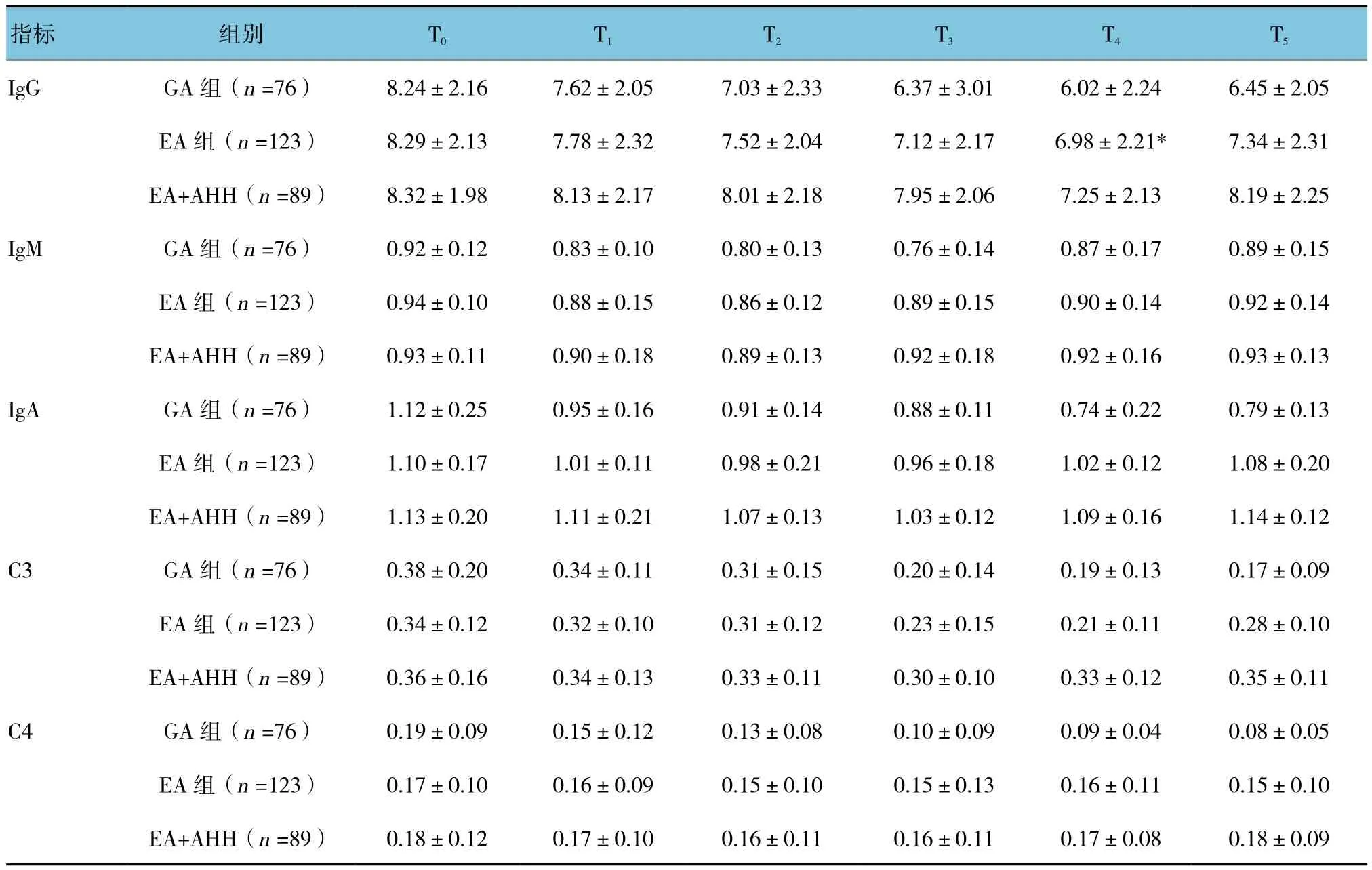
表6 3组体液免疫功能变化比较 (g/L,±s)
指标 组别 T0 T1 T2 T3 T4 T5 IgG GA 组(n =76) 8.24±2.16 7.62±2.05 7.03±2.33 6.37±3.01 6.02±2.24 6.45±2.05 EA 组(n =123) 8.29±2.13 7.78±2.32 7.52±2.04 7.12±2.17 6.98±2.21* 7.34±2.31 EA+AHH(n =89) 8.32±1.98 8.13±2.17 8.01±2.18 7.95±2.06 7.25±2.13 8.19±2.25 IgM GA 组(n =76) 0.92±0.12 0.83±0.10 0.80±0.13 0.76±0.14 0.87±0.17 0.89±0.15 EA 组(n =123) 0.94±0.10 0.88±0.15 0.86±0.12 0.89±0.15 0.90±0.14 0.92±0.14 EA+AHH(n =89) 0.93±0.11 0.90±0.18 0.89±0.13 0.92±0.18 0.92±0.16 0.93±0.13 IgA GA 组(n =76) 1.12±0.25 0.95±0.16 0.91±0.14 0.88±0.11 0.74±0.22 0.79±0.13 EA 组(n =123) 1.10±0.17 1.01±0.11 0.98±0.21 0.96±0.18 1.02±0.12 1.08±0.20 EA+AHH(n =89) 1.13±0.20 1.11±0.21 1.07±0.13 1.03±0.12 1.09±0.16 1.14±0.12 C3 GA 组(n =76) 0.38±0.20 0.34±0.11 0.31±0.15 0.20±0.14 0.19±0.13 0.17±0.09 EA 组(n =123) 0.34±0.12 0.32±0.10 0.31±0.12 0.23±0.15 0.21±0.11 0.28±0.10 EA+AHH(n =89) 0.36±0.16 0.34±0.13 0.33±0.11 0.30±0.10 0.33±0.12 0.35±0.11 C4 GA 组(n =76) 0.19±0.09 0.15±0.12 0.13±0.08 0.10±0.09 0.09±0.04 0.08±0.05 EA 组(n =123) 0.17±0.10 0.16±0.09 0.15±0.10 0.15±0.13 0.16±0.11 0.15±0.10 EA+AHH(n =89) 0.18±0.12 0.17±0.10 0.16±0.11 0.16±0.11 0.17±0.08 0.18±0.09
表7 3组血清炎症因子水平变化比较 (ng/L,±s)

表7 3组血清炎症因子水平变化比较 (ng/L,±s)
指标 组别 T0 T1 T2 T3 T4 T5 IL-6 GA 组(n =76) 52.5±7.6 87.1±9.2 101.3±10.1 137.6±11.4 97.5±10.3 68.2±7.7 EA 组(n =123) 53.1±8.1 79.6±8.7 89.7±9.6 105.6±10.2 81.4±7.2 62.2±9.2 EA+AHH(n =89) 51.9±7.3 72.7±8.5 83.3±8.8 91.4±9.3 80.9±8.1 56.1±6.8 TNF-α GA组(n =76) 42.3±13.3 85.6±16.4 90.2±15.5 110.4±13.2 79.2±12.1 52.7±15.9 EA 组(n =123) 43.1±10.7 70.4±12.1 76.8±14.3 80.1±13.9 69.5±10.7 47.6±12.6 EA+AHH(n =89) 42.5±11.5 63.3±10.2 70.4±10.6 77.9±11.4 61.4±11.2 44.5±13.1
3 讨论
CO2气腹腹腔镜手术是目前临床治疗直肠癌的主要手段之一[7]。研究表明,麻醉药物可直接影响免疫效应细胞功能和调节炎症介质的表达和分泌,抑制机体细胞和神经体液免疫[8]。对于肿瘤患者,术中创伤性应激反应和麻醉药物的免疫抑制作用可能会增加术后感染几率,促进残余肿瘤细胞的生长和转移,恶化患者预后[9]。因此,探求好的麻醉方法保护肿瘤患者术后的免疫功能具有重要临床意义。本研究从术中患者血液动力学变化情况、术后患者恢复和并发症发生情况、围手术期患者细胞及体液免疫功能变化情况3个方面比较GA、EA及(EA+AHH)3种麻醉方法对CO2气腹腹腔镜下直肠癌手术患者的影响。发现术前采用6%羟乙基淀粉液进行急性高容量血液稀释联合硬膜外复合GA可减少CO2气腹腹腔镜下直肠癌手术患者术中血液动力学改变,改善其术后细胞及体液免疫状态、降低术后感染危险性,较其余两种麻醉方式有优势。
由于手术中GA或腰硬联合麻醉均可阻滞交感神经,扩张组织区域内的血管,同时降低心脏前后负荷,使回心血量减少,从而造成血压波动[10]。而血压的剧烈波动会增加患者的术中风险。AHH是指通过快速输注胶体液,稀释血液来维持高循环血容量,从而减少用血的一种辅助治疗手段[11]。有研究表明,麻醉前联合使用AHH不仅可快速补充有效血容量,起到血液保护和稳定麻醉期间血流动力学的作用,而且能减轻机体炎症反应,提高手术的安全性[12]。
有研究报道,手术创伤及麻醉过程本身均可诱发机体应激反应,在一定时间内影响机体正常的免疫功能[13]。T细胞是一个具有多功能的免疫活性细胞群体,在机体的细胞免疫过程中起着关键作用[14]。NK细胞则为抗肿瘤免疫中重要的免疫调节细胞,对肿瘤的发生、发展及预后均有重要意义[15]。除细胞免疫,体液免疫也在机体的免疫应答中起着重要作用。血清免疫球蛋白及其补体水平是反应体液免疫的重要指标[16]。本研究中,伴随着手术过程的进行,患者体液免疫功能同样受到了不同程度的抑制。
手术创伤和麻醉还可通过经内分泌系统与免疫系统激活中性粒细胞和血管内皮细胞,使其释放IL-6、TNF-α等炎症介质[17]。本研究结果显示,3种麻醉方式均可造成血清炎症因子水平升高,麻醉前联合应用AHH能抑制血清炎症因子IL-6、TNF-α水平的升高,效果优于GA和硬膜外复合GA。
综上所述,术前6%羟乙基淀粉液进行急性高容量血液稀释联合硬脊膜外腔复合GA可改善CO2气腹腹腔镜手术创伤和麻醉造成的患者术后细胞及体液免疫功能下降,并且能减缓术中患者血液动力学指标的波动、减少术后并发症的发生。EA+AHH麻醉方法较另两种麻醉方式优势明显,值得临床推广应用。

