乳腺癌组织磁共振T2WI信号特征与增殖细胞核抗原(Ki-67)表达的相关性
吴健
(海南省三亚市人民医院 放射科,海南 三亚 572000)
由于各种因素的影响,乳腺癌已经成为女性最常见的恶性肿瘤之一,多发病于50岁以上女性,近年来有年轻化的趋势[1-2]。早发现、早诊断、早期治疗是改善乳腺癌患者预后的关键,不过影响乳腺癌的因素比较多,包括淋巴结转移、浸润侵袭状态、肿瘤大小、组织学分型、临床分期、雌激素受体(ER)、孕激素受体(PR)表达等[3-4]。增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)(Ki-67)是一种与增殖细胞相关的核抗原,近年有相关研究认为,其能有效评估肿瘤细胞增殖活性的重要标志物[5]。影像学检查是乳腺癌重要的诊断手段,包括X射线、超声、CT、MRI等,X射线、超声的优势在于操作简单,价格便宜,但是组织分辨率低[6];CT可显示乳腺各层结构,对病灶形态大小、血流也有很好的显示,但是在临床容易误诊[7-8]。磁共振成像(magnetic resonance imaging,MRI)具有多体位多参数扫描、高软组织分辨率等优点,使得病灶能清晰的显示其侵及范围、生长类型、形态结构等,在乳腺癌诊断发挥重要作用[9-10]。当前MRI多采用T1WI和T2WI进行扫查,T1WI主要用于对乳腺腺体、脂肪组织进行检查;T2WI能够对病灶进行更好的观察,乳腺癌病灶在T2WI主要表现为混杂不均信号或稍高信号,乳腺腺体组织呈等信号[11-12]。本文回顾性研究2012年1月-2017年5月在该院行手术治疗,术后经病理证实的乳腺癌患者MRI影像学资料,探讨MRI诊断乳腺癌T2WI信号特征与Ki-67表达的相关性。现报道如下。
1 资料与方法
1.1 研究对象
采用回顾性与随机抽样研究方法,选取2011年9月-2017年4月该院诊治的乳腺癌患者122例作为研究对象。纳入标准:研究得到医院伦理委员会的批准;单侧乳腺癌;临床、影像学与病理资料完整;病理诊断为乳腺癌患者;患者年龄20~90岁。排除标准:MRI检查前接受新辅助化疗者;妊娠与哺乳期妇女;未经手术或穿刺活检病理证实或随访失败患者。
1.2 MRI诊断方法
使用选择GE Signa 1.5 T MR(通用电气公司),配套有专用乳腺相控阵线圈。患者取俯卧位,头足位进入磁场,使双侧乳腺充分暴露,双臂置于头端两侧,自然悬垂于检查线圈内。
扫描序列包括:FSE T1WI轴面:TE 10 ms,TR 480~960 ms;FSE T2WI加脂肪抑制轴面:TE 90~10 ms,TR 2500~3800 ms。矩阵 320×160,层厚4~5 mm,层隔2 mm。对比剂采用钆喷酸葡胺注射液(Gd-DTPA,先灵公司),剂量0.1 mmol/kg,以2 ml/s的速度注入,注入20 s后连续扫描5次。以癌旁正常腺体信号为标准,判断平扫时病灶信号。采用多平面重建,记录病灶强化方式、病灶与周围血管的联系、形态特征等。扩散加权成像(diffusion weighted imaging,DWI)应用回波序列,扩散敏感系数b值分别为800 s/mm2和b=1 000 s/mm2。矩阵128×128,层厚1.0 mm,层距1.0 mm,TR 3 000ms,TE 84 ms,视野320×320 m。在弥散图像上选择病变的感兴趣区(region of interest,ROI),测定与计算表观弥散系数(apparent diffusion coefficient,ADC)值。
1.3 免疫组织化学(简称免疫组化)分析Ki-67
取所有患者的癌组织标本与癌旁组织标本,进行石蜡包埋、切片、常规苏木素-伊红(HE)染色与免疫组化染色,Ki-67检测采用免疫组化方法,阳性结果为胞核呈棕黄色或棕褐色颗粒,阳性细胞数≥14%为高表达,阳性细胞数<14%为低表达。Ki-67表达判定所需的一抗、二抗均选用Bio-rad基因公司的即用型抗体(抗体工作浓度为1∶100)。
1.4 观察指标
记录与调查所有患者的一般资料,包括年龄、家族史、月经状态、病理特征等。
所有病例均由2位有经验的影像科医师采用双盲法进行读片并做出诊断,如意见不同进行协商判定。参照MRI BI-RADS标准,分析患者乳腺癌病灶与正常乳腺癌的MRI形态学表现,包括内部强化特点(均匀/不均匀/环形)、边缘(光滑/不规则/毛刺)等,重点记录T2WI信号(低或等/高/高亮)等。
1.5 统计学方法
数据分析采用SPSS 19.00统计软件,计数资料以构成比或率(%)表示,比较采用χ2检验,相关分析采用Spearman法,影响因素分析采用多因素Logistic回归模型,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
在122例患者中,年龄最小29岁,最大79岁,平均(50.77±5.29)岁;有20例(16.4%)患者有家族史;绝经患者72例(59.0%);组织学类型:浸润性导管癌114例,非浸润性导管癌8例;淋巴结转移45例(36.9%);脉管内癌栓34例(27.9%),神经侵犯6例(4.9%)。
2.2 Ki-67阳性率情况
癌组织的Ki-67阳性率为54.9%(67/122),癌旁组织为23.8%(29/122),癌组织的Ki-67阳性率高于癌旁组织(χ2=7.835,P=0.005)。见表 1。
2.3 MRI信号特征
在T2WI信号特征上,癌组织78例(63.9%)主要表现为高信号与高亮信号,癌旁组织9例(7.4%)主要表现为低或等信号;癌组织T1WI多表现为低信号,癌旁组织表现为高信号;癌组织边缘不规则、边界模糊,病灶内部信号不均匀,可见异常增多血管影。见表1和附图。
2.4 ADC值情况
癌组织的ADC值为(0.89±0.12)×10-3/mm2,低于癌旁组织的(1.67±0.24)×10-3/mm2(t=10.382,P=0.000)。
2.5 相关性分析
在癌组织中,Spearman相关性系数分析显示T2WI高信号与Ki-67阳性率呈正相关(rs=0.724,P<0.05),与ADC值呈负相关(rs=-0.452,P<0.05)。以Ki-67阳性率作为因变量,以MRI指标作为自变量,多因素分析T2WI高信号、ADC值也为影响Ki-67阳性率的危险因素(=0.185,1.842,P<0.05)。见表 2。
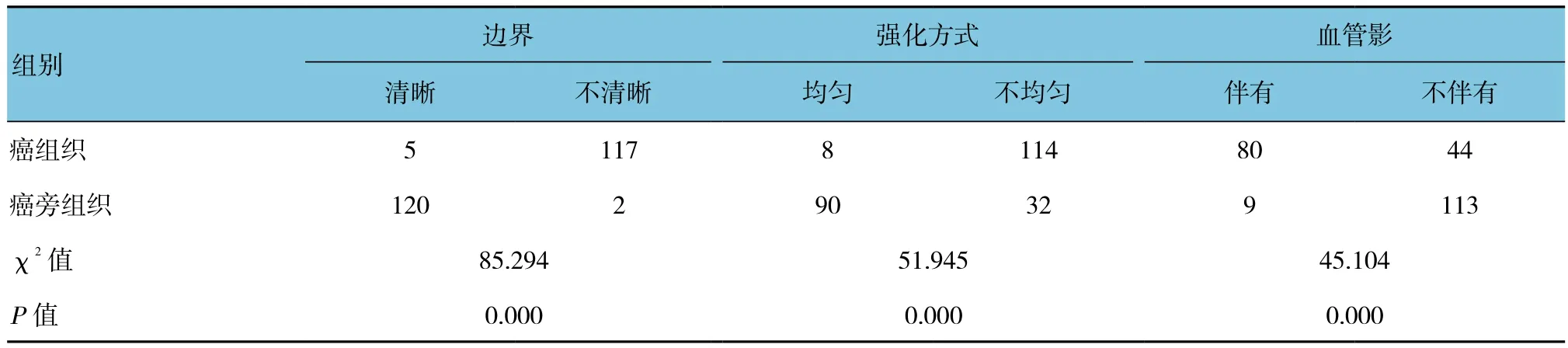
表1 癌组织与癌旁组织的MRI信号特征比较 (n =122)

附图 右侧乳腺癌的MRI特征

表2 影响乳腺癌病灶Ki-67阳性率的危险因素分析 (n =122)
3 讨论
乳腺癌是一种高度异质性的恶性肿瘤,目前缺乏有效的靶向治疗药物。因此研究乳腺癌的分子生物学特征与影像学特征对于判断肿瘤预后、制定临床治疗方案有重要的意义。目前乳腺癌的研究已进入子生物学的时代,各种分子标记物广泛应用于乳腺癌发病、诊断、治疗及预后评估[13-14]。本研究显示,癌组织的Ki-67阳性率为54.9%,癌旁组织为23.8%,癌组织的Ki-67阳性率高于癌旁组织(P<0.05)。Ki-67是细胞增殖相关蛋白,是在增殖细胞核中表达的一种抗原,可用来评估肿瘤细胞的增殖活性。Ki-67在细胞周期的G0期不表达,在G1、S1、G1和M期均有表达,与肺癌、胃肠癌的发生、转移、发展、浸润等作用过程具有密切的关系[15]。Ki-67表达比率越高,肿瘤组织生长越快,恶性程度也更高,预后死亡率也比较高[16-17]。
MRI检查的高敏感性使其成为乳腺癌筛查的重要方法,其能明显显示病灶的侵及范围、生长类型、形态结构围等[18]。乳腺癌的MRI表现可归纳为:病灶形态不一,不规则状、分叶状等结构;边缘不规则,呈毛刺样改变,表现为蟹足状;病灶与周围组织边界模糊不清;增强后病灶边缘呈环形强化;病灶周围有异常增生血管影等。由于乳腺癌生长快常伴有液化、纤维化、坏死、囊变,甚至有出血表现,为此在MRI的信号特征比较复杂[19]。本研究显示在T2WI信号特征上,癌组织主要表现为高信号与高亮信号,癌旁组织主要表现为低或等信号;癌组织T1WI多表现为低信号,癌旁组织表现为高信号,表明要T2WI信号强度以及内部结构的不同表现,对多数乳腺癌均能作出较准确的诊断。
随着MRI技术不断完善成熟,DWI可从分子水平鉴别病理乳腺与正常乳腺的区别,恶性肿瘤细胞密度增高,水分子活动受限,细胞外容积降低,可使得ADC下降[20]。有研究表明ADC值是MRI信号衰减的量化值,能反映肿瘤组织中水分子的弥散运动和组织的微循环血流灌注情况[21-22]。本研究显示癌组织的ADC值低于癌旁组织。主要在于肿瘤细胞密度与ADC值呈负相关,细胞密度越高,ADC值越低。也有研究发现DWI较常规T2WI序列多发现7个病灶,表明DWI较常规序列具有更高的敏感性和特异性[23-24]。
MRI T2WI信号可以同时观察病灶的内部情况、病灶的边缘以及周围的淋巴结,结合DWI技术更加具有高度敏感性与特异性[25]。Ki-67的表达是判断乳腺癌病情的重要指标,Ki-67表达也可预测乳腺癌的预后疗效[26]。本研究显示在癌组织中,Spearman相关性系数分析显示T2WI高信号与Ki-67阳性率呈正相关,与ADC值呈负相关,多因素分析T2WI高信号、ADC值也为影响Ki-67阳性率的危险因素。乳腺组织T2WI信号表现不均匀,可表现为不均匀高信号,也可表现为等信号,而乳腺癌病灶多数表现为均匀高信号,T2WI高信号可作为判断恶性的一个指标。Ki-67高表达的乳腺癌中肿瘤细胞增殖明显,病灶内水分子弥散受限,ADC值降低[27-28]。不过Ki-67的表达与T2WI信号、ADC值的不确定性关系可能与多种因素相关,病例数较少、病理类型较局限均可影响观察结果,将在下一步进行深入分析。
总之,乳腺癌病灶MRI T2WI信号特征多表现为高信号,Ki-67呈现高阳性率表达,伴随有ADC值下降,存在相关性,T2WI信号特征对乳腺癌的筛查及预后判断有积极作用。

