肺保护性通气策略对腹腔镜下食管裂孔疝合并GERD患者肺功能的影响研究
吴新华 谭杰 徐桂萍 李赞林 克力木·阿不都热依木
食管裂孔疝(esophageal hiatus hernia,EHH)是指胃和(或)腹腔内脏器通过膈食管裂孔进入胸腔内的疾病[1]。EHH常与胃食管反流病(gastroesophageal reflux disease,GERD)合并发生,后者除胃灼热、反酸等消化道症状外,呼吸系统症状如咳嗽、睡眠呼吸暂停等也常发生,甚至不同程度的肺功能损伤[2]。近年来,随着腹腔镜的普及,临床上常采用腹腔镜下食管裂孔疝修补术与胃底折叠术治疗食管裂孔疝合并GERD。但腹腔镜操作要求的CO2气腹和患者头低脚高30°体位,二者均可使得麻醉期的呼吸管理变得复杂化,随着全身麻醉机械通气时长的增加,使围手术期肺损伤的发生率增加[3]。因而,本研究旨在运用肺保护性通气策略,探讨肺保护性通气策略对腹腔镜下食管裂孔疝合并GERD患者肺功能的影响。
资料与方法
一、一般资料
按照入院先后顺序选取80例2014年4月至2017年10月在新疆维吾尔自治区人民医院行腹腔镜下行食管裂孔疝修补术与胃底折叠术的患者,并随机分为对照组和观察组。纳入标准:(1)按美国麻醉医师协会体格情况评估分级(ASA分级)为Ⅰ~Ⅱ级的患者;(2)术前心肾功能正常,无严重心脏、肺疾病。排除标准:(1)术中中转开腹手术;(2)术中发现恶性肿瘤;(3)术中出现广泛皮下气肿者;(4)严重心肺疾病如慢性阻塞性肺疾病等。本研究开始前通过伦理委员会的批准,并签署患者知情同意书。对照组40例,其中男24例,女16例;观察组40例,其中男21例,女19例。2组平均年龄为(53.12±5.97)岁和(55.31±6.45)岁、BMI为(20.11±1.32)kg/m2和(19.69±1.42)kg/m2、吸烟年限为(19.33±7.35)年和(23.26±8.73)年,2组间研究对象的年龄、性别、BMI和吸烟分布无统计学差异(均P>0.05),2组平均手术时长也无统计学差异(均P=0.071),见表1。
二、方法
对照组采用传统间歇正压通气模式,按理想体质量(predicted body weight,PBW)将潮气量设置为10 ml/kg,建立稳定CO2气腹,并调节至Tredelenburg体位。观察组采用肺保护性通气策略,按PBW将潮气量设置为6 ml/kg,并给予5 cmH2O呼气末正压通气(positive end expiratory pressure,PEEP)。行气管插管后,给予患者肺复张手法,之后恢复机器(Drager Evita4呼吸机,德国德尔格公司)控制通气。建立稳定的二氧化碳气腹,调节为Tredelenburg位,给予患者肺复张手法后,再次恢复机器控制通气。设置2组患者吸入氧浓度为40%,初始呼吸频率(Respiratory rate,RR)为10/min,将PETCO2维持在35~40 mmHg,调整呼吸频率为16次/min。
三、评价指标
分别在气腹前(T0)、气腹后2 h(T1)、气腹后4 h(T2)记录一次平均动脉压(MAP)、中心静脉压(CVP)。在T0、T1、T2、手术后24 h(T3)记录2组患者肺顺应性(C)、心率(HR)、RR,并抽取血气,计算氧合指数(OI)。
四、统计学方法
结 果
一、一般资料比较
2组患者间基线数据的比较,差异无统计学意义(P>0.05),具有可比性,见表1。
二、2组间观察指标的比较
如表2所示,在观察组和对照组中均发现,相对同组内T0,T1和T2组的MAP、CVP和C指标均较高(均P<0.05)。此外,在同一时间段内,观察组在T0、T1、和T2时间C指标均高于对照组(均P<0.05),但在MAP和CVP 2个指标并未发现同一时段内2组之间存在差异(均P>0.05)。
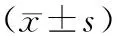
表1 2组患者一般资料比较
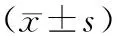
表2 2组患者MAP、CVP、C的比较
注:1与同组内T0时比较,P<0.05;2与同时间内对照组比较,P<0.05
三、2组患者HR、RR、OI的比较
如表3所示,在观察组和对照组中均发现,相对同组内T0,T1和T2组的HR、RR和OI指标均处于较高水平(均P<0.05)。而且,在同一时间段内,观察组在T0、T1、和T2时间HR、RR和OI指标也均高于对照组(均P<0.05)。
注:1与T0时通组内比较,P<0.05;2与同时间内对照组比较,P<0.05
四、肺部并发症
2组患者均在术前30 min预防性应用二代头孢菌素,手术超过3 h加用1次抗菌药物,并于术后预防用抗菌药物3 d。术后2组患者均未出现切口感染、发热、咳嗽、肺部感染、气管炎、肺炎的并发症。其他术后并发症包括吞咽困难、胀气、穿刺部位血肿、呕吐等均未发生。
讨 论
本研究探讨腹腔镜下食管裂孔疝合并GERD患者中探究肺保护性通气策略对肺功能的影响,结果显示,相比术中采用传统容量控制通气模式的患者,采用肺保护性通气策略的患者的HR、RR和OI指标均高于对照组,差异具有统计学意义,但MAP和CVP并无差异。因而,术中采用肺保护性通气策略可能比传统容量控制通气模式更好的保护患者的肺功能。
本研究中术中患者采用手术过程中常用的两种通气模式即传统的机械通气和新一代非保护性通气策略模式。其中,机械通气已成为外科全麻手术中维持患者足够气体交换的必要性支持手段之一。传统外科腹部和胸部手术全身麻醉过程通常采用高潮气量(VT)10~15 ml/kg机械通气来预防麻醉患者发生低血氧症和肺不张[4]。但现有临床和试验证据已表明,机械通气尤其是VT和平台压均有可能引起或加重肺部损伤[5]。相似结果也在本项研究中发现,我们将患者随机分为2组,术中分别采用传统机械通气模式,即容量控制通气模式,以及新一代肺保护性通气策略。结果发现后者在保护患者肺功能方面体现出更好的效益。这是因为传统的机械通气通常采用高VT通气,它可放大生物反应和通气张力从而导致术后肺部并发症发生的敏感性增高[6]。肺泡的过度膨胀引起,非依赖的肺组织和循环变化在被撕裂和破裂的肺泡处产生超微结构损伤可导致通气关联的肺损伤(VALI)发生[7]。本研究2组患者虽均为出现术后肺部并发症患者,但有研究指出5%~10%外科手术患者和30%~40%行胸或腹部手术的全麻患者术后患有肺部并发症[8],从而很大程度上影响了临床与后结局以及术后监护需求的增加,因而预防肺部并发症的发生已成为围手术期的关键一环[9]。本研究较低的术后肺部并发症可能归因于样本量的限制以及研究人群特征的差异,但已有研究证实[7],与常规机械通气相比,肺保护性通气策略的使用可显著降低肺部感染、肺不张等术后肺部并发症的发生率,减少患者的住院时间,尽管如此,大样本、多中心研究验证仍是必须的。
本研究中传统机械通气患者在HR、RR和OI指标上呈现出较差临床表现的原因可能为VALI发生的生物学机制为反复性的启用和关闭远端肺单位(剪切力损伤)和高通气压力(气压伤),这些均可导致炎性因子的产生和释放[10]。本研究中对照组采用的机械通气模式依赖的高VT通气可引起肺过度膨胀,但也有研究指出采用低VT通气或无平台压(或太低的PEEP)也可导致肺功能退化和肺不张的发生[11]。而观察组采用的新一代肺保护性机械通气策略可克服此项弊端,从而在保护患者肺功能方面凸显优越性。与本研究结果相似,诸多研究已经证实采用适当水平的PEEP联合预氧化处理可有效的维持终末肺活量和降低肺不张的发生[12-14]。尽管本研究虽然在MAP、CVP指标上,保护性肺通气并未显现优势作用,但本研究中保护性肺通气可在保护和维持肺的顺应性(C)方面优于传统机械通气组。但需要注意的是单一的采用PEEP并不能有效地恢复已塌陷的肺部,必须联合采用肺泡复张(短期升高肺部跨膜压力)。而在行腹腔镜手术的肥胖患者中已经证明了采用这种通气方式的显著效果[15]。
保护性肺通气是一种采用低VT通气和限制平台压使肺泡膨胀最小化,正向呼气压(PEEP)防止反复启用和关闭远端肺单位,这种通气方式能够提高临床急性呼吸窘迫综合症患者的预后结局[16]。Serpa的研究表明,保护性肺通气可适用更广泛的人群,尤其对于机械通气之初尚无ARDS的患者中[17]。本研究也发现,保护性肺通气在HR、RR和OI指标方面均高于传统机械通气组,再次证实了以往Serpa的研究,说明保护性肺通气对更好的保护肺功能是有一定价值的。目前尚无确切生理学证据否定对全麻手术患者采用保护性肺通气,对于几乎所有的哺乳动物来说,低VT通气是适宜的通气方法[18]。然而,鲜见关于肺部正常手术患者行保护性肺通气对肺功能影响的报道,原因可能在于:首先,全麻患者通常经历短期的机械通气;其次,相比于重症监护病房的患者,其他全身麻醉患者可方便的完成机械通气;第三,呼吸机引起的术后肺部并发症通常高发于术后3~7 d[19],容易忽略通气方式与肺部并发症之间的因果关系。
机械通气对维持全麻患者气体交换是必不可少的的支持性疗法,尽管如此,越来越多的证据表明机械通气会加剧甚至恶化肺损伤,导致术后肺部并发症。而术中采用保护性机械通气,结合较低的VT,适度的PEEP和肺泡复张策略可有助于减少术后肺部发症的发生。本研究发现保护性肺通气可提高肺部的术后顺应性,以及改善HR、RR,和OI指标,提示着保护性肺通气的优势作用,有利于改善患者术后肺功能的保护和恢复,值得在临床上推广。

