二氧化氯制备过程中氯酸盐控制技术
闫云涛,马春元
(山东大学,能源与动力工程学院燃煤污染物减排国家工程实验室,山东济南 250061)
饮用水在消毒过程中,消毒剂会与水体中的有机物发生反应生成消毒副产物(disinfection by-products,DBPs),目前已知的消毒副产物已有600~700种,大多消毒副产物具有致癌、致畸、致突变作用[1]。消毒副产物的产生与水体中有机物种类有关,也与消毒剂的种类有关:氯气杀菌能力强,成本低,是饮用水消毒普遍采用的一种方法,但目前采用氯气消毒的水体中已检测出300多种DBPs,包括三卤甲烷(THMs)、卤乙酸(HAAs)、卤乙腈(HANs)、卤代酮、三氯硝基甲烷、三氯乙醛等[2-6];二氧化氯是一种强氧化剂和优良消毒剂[7],与氯气相比较可产生较少的三氯甲烷和卤乙酸[8-9],二氧化氯的氧化能力是含氯消毒剂的2.5倍,且消毒效果受水质的影响小[10-11],二氧化氯作为氯气的替代品在减少或预防消毒副产物的生成方面具有重要作用[12-14]。
最近几年有学者发现使用复合法二氧化氯发生器进行消毒的水体中检测出了ClO3-,ClO3-属于中等毒性的化合物,会引起肾功能衰竭[15]。研究表明,水体中检测出的ClO3-是由于二氧化氯制备过程中未反应完全的氯酸钠原料随残液进入水体中引起的。朱慧峰等[16]认为反应残留率低与原料泄露是ClO3-消毒副产物超标的主要原因,叶必雄等[17]认为使用纯二氧化氯发生器生成的ClO3-显著低于使用复合法二氧化氯发生器生成的量。国内当前复合法二氧化氯发生器反应釜和消毒液投加管路的材质大多采用硬质PVC材料,这种材料的缺点是高温软化变形,且传热效率低。由于反应釜水浴加热的温度一般不会超过70 ℃,实际反应液的温度一般为40 ℃至50 ℃甚至更低。较低的反应温度,造成部分氯酸钠留存在反应残液中随二氧化氯和氯气一同进入到了自来水中,引起水体中氯酸盐的升高。目前这些研究大多停留在水质结果监测和理论分析阶段,通过研究二氧化氯制备过程来削减与控制氯酸盐消毒副产物的研究未见报道。
基于上述现状,本文模拟复合法二氧化氯发生器反应工艺,研究了反应温度、反应时间两个因素对NaClO3残留率、ClO2收率、有效氯收率,以及消毒液中残留的氯酸钠和有效氯的质量比(η)的影响,并进行了工程试验,研究发现,提高反应的温度和时间可有效削减与控制二氧化氯制备过程中氯酸钠的残留量。

注:1-氮气钢瓶;2-NaClO3滴定管;3-盐酸滴定管;4-加热装置;5-圆底烧瓶;6-广口瓶;7-广口瓶;8-广口瓶;9-广口瓶;10-广口瓶图1 试验装置示意图Fig.1 Schematic Diagram of Experimental Apparatus
1 材料与方法
1.1 主要试验材料
氯酸钠(NaClO3)、盐酸(HCl浓度为36.0%~38.0%)、碘化钾、硫代硫酸钠、重铬酸钾、磷酸氢二钠、磷酸二氢钾、碳酸钠、溴化钾、淀粉,均为分析纯。
1.2 试验原理
自来水厂中使用的复合法二氧化氯发生器所使用的原料是NaClO3和盐酸,设备工作时,NaClO3溶液和盐酸溶液经计量泵按照1∶1的比例连续进入发生器内进行反应,产生出ClO2、Cl2、NaCl和H2O等反应产物,在水射器的抽吸作用下,ClO2、Cl2、NaCl和H2O等反应产物和含有NaClO3和盐酸的反应残液,一同进入水射器中与水混合形成复合二氧化氯消毒液。
虽然NaClO3溶液和盐酸溶液的浓度和投加比例对反应有影响,为获取与实际生产相似的数据,本文仍以类似实际生产中的条件作为试验的条件:NaClO3溶液的浓度为33.3%(质量百分比),盐酸溶液的浓度(以HCl计)为36.0%~38.0%,原料投加的体积比为1∶1,反应结束时,将反应产物和含反应残液混合,形成复合二氧化氯消毒液。NaClO3和盐酸反应时,发生的主要反应如式(1)和式(2)。
2NaClO3+ 2HCl → 2HClO3+ 2NaCl
(1)
2HClO3+ 2HCl → 2ClO2+ Cl2+ 2H2O
(2)
总反应如式(3)。
2NaClO3+ 4HCl → 2ClO2+ Cl2+ 2NaCl + 2H2O
(3)
1.3 试验装置、步骤与条件
图1所示,NaClO3溶液和盐酸溶液的反应在圆底烧瓶内进行,分别设置20、30、40、50、60、70、80、90 ℃反应温度条件下10、30、50、70、90 min五组反应时间的的正交试验。反应开始时,按照体积比为1∶1的比例将NaClO3溶液和盐酸溶液分别加入到圆底烧瓶中,反应产生黄绿色气体,打开氮气钢瓶阀门向烧瓶中通入高纯氮气,烧瓶中的气体被陆续吹出,依次进入5个广口瓶内,被瓶内的水吸收。反应结束时,将5个广口瓶内的液体和圆底烧瓶内的反应残液一同倒入一个棕色广口瓶内,形成浓度均匀的复合二氧化氯消毒液,测试复合二氧化氯消毒液中的NaClO3、ClO2和有效氯等数据。
1.4 分析测试方法及仪器
ClO2、ClO3-含量的测定采用二氧化氯质量浓度测定方法,有效氯浓度的测定采用有效氯浓度测定方法[18]。所用仪器为恒温水浴加热装置,氮气钢瓶,分析天平,酸式滴定管,碘量瓶,各种规格的移液管。
2 试验结果与讨论
2.1 温度和时间对NaClO3转化率的影响
NaClO3和盐酸反应时,NaClO3的转化率越高,未反应的NaClO3就越少,因此,提高NaClO3的转化率可有效降低复合二氧化氯消毒液中NaClO3的残留量。由图2可知,升高反应温度或延长反应时间均可提高NaClO3的转化率。其中反应温度从20 ℃升高到90 ℃时,NaClO3的转化率可平均提高17.91%,反应时间从10 min延长至90 min时,NaClO3的转化率可平均提高2.98%,反应温度对NaClO3转化率的影响更明显。这是因为反应温度直接影响化学反应的活化能和溶液中活化分子的百分数,延长反应时间只能使已达到或超过活化分子所具有最低能量的ClO3-尽可能地发生,而不能使未达到活化分子所具有最低能量的ClO3-发生反应所致。

图2 反应温度、反应时间与NaClO3转化率的关系Fig.2 Relationship among Reaction Temperature,Reaction Time and Conversion Rate of NaClO3
2.2 温度和时间对ClO2收率的影响
ClO2是NaClO3和盐酸反应所要获取的主要目标产物,ClO2的收率越高,意味着单位质量的NaClO3产生的ClO2的量越大。由图3可知,升高反应温度或延长反应时间,均可提高ClO2的收率,且在80 ℃条件下达到最大,这是由于提高反应温度直接提高了溶液中活化分子的百分数,从而直接提高了ClO2的收率。
值得注意的是,90 ℃时ClO2的收率低于80 ℃时的情况,是由于未检测图1装置中5号吸收瓶末端溢出的尾气造成的。图1装置采用5个广口瓶串联进行ClO2和Cl2的吸收,反应进行时第5个广口瓶的末端有少量气体溢出,尾气溢出量随反应温度的升高而增大,当溢出量的增幅低于反应量的增幅时,图3显示的检测数据就会出现ClO2的收率不增反降的情况。20~80 ℃,反应温度升高,反应量的增幅大于溢出量的增幅,图3实测数据显示ClO2的收率随反应温度的升高而升高。80~90 ℃,温度提升对反应的贡献已非常微弱,而90 ℃时的溢出量远大于80 ℃时的溢出量,因此,图3实测数据显示90 ℃时ClO2的收率低于80 ℃。
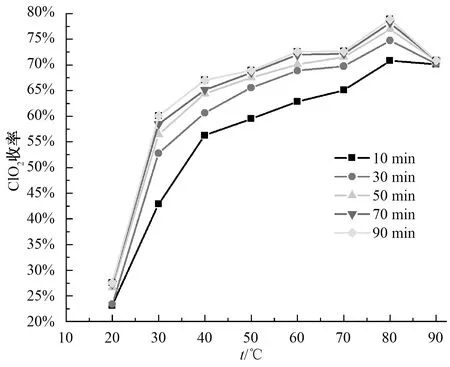
图3 反应温度、反应时间与ClO2收率的关系Fig.3 Relationship among Reaction Temperature,Reaction Time and Yield of ClO2
2.3 温度和时间对有效氯收率的影响
复合二氧化氯用于饮用水消毒时,消毒液的投加量大多是以有效氯来计算的,NaClO3和盐酸反应时,有效氯的收率越高,意味着单位质量的NaClO3产生的有效氯的量越大。图4为不同反应温度、不同反应时间对有效氯收率的影响。由图4可知,升高温度或延长反应时间,均能够有效提高有效率的收率。20~80 ℃,有效氯的收率随反应温度的升高而升高,这是由于提高反应温度直接提高了溶液中活化分子的百分数,从而直接提高了有效氯的收率。90 ℃时有效氯的收率低于80 ℃时的收率,是未检测图1装置中5号吸收瓶末端溢出的尾气造成的。
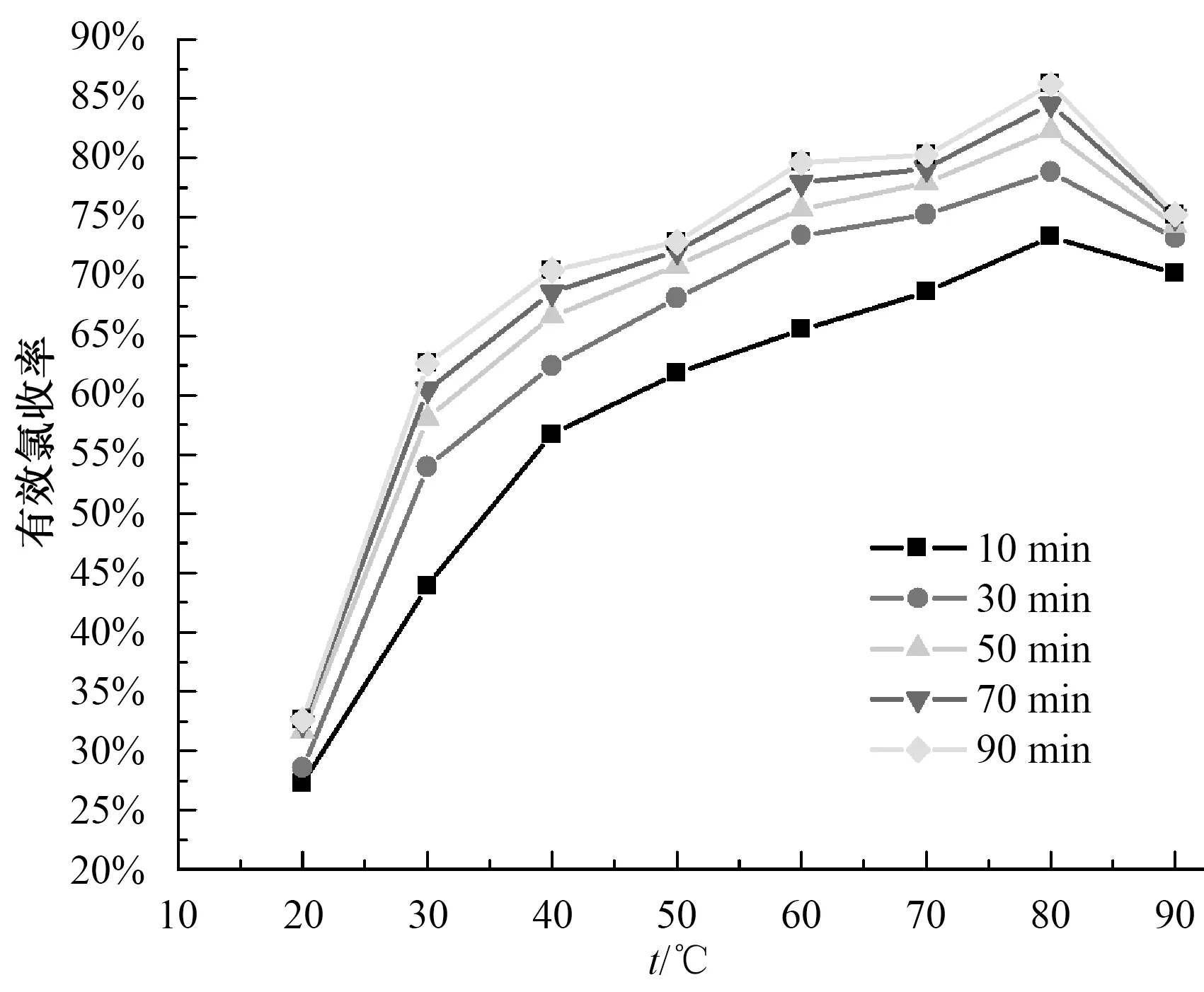
图4 反应温度、反应时间与有效氯收率的关系Fig.4 Relationship among Reaction Temperature,Reaction Time and Yield of Available Chlorine

图5 反应温度、反应时间与η的关系Fig.5 Relationship among Reaction Temperature,Reaction Time and η
2.4 温度和时间对η的影响
图5为不同反应温度、不同反应时间对氯酸钠残留量与有效氯质量比η的影响。由图5可知,提高反应温度或延长反应时间均可降低η值。
2.5 消毒后水体中NaClO3浓度分析
反应残液随二氧化氯和氯气一并进入消毒水体中的生产工艺,消毒后水体中的氯酸钠的浓度c与消毒液有效氯的投加浓度C、氯酸钠残留量与有效氯质量比η的关系如式(4)和式(5)。
c=η·C
(4)
η=m/M
(5)
其中:c—消毒后水体中的氯酸钠的浓度,mg/L;
C—有效氯的投加浓度,mg/L;
η—质量比;
m—二氧化氯消毒液中反应残留的氯酸钠的质量,mg/L;
M—二氧化氯消毒液中有效氯的质量,mg/L。
由式(4)可知,二氧化氯用于饮用水消毒时,消毒后水体中的氯酸钠的浓度c是η和C的乘积。C与原水的水质有关,在达到相同消毒效果的情况下,水体中有机物或微生物的含量越低,C值越低。当C值固定时,c随η的降低而降低。
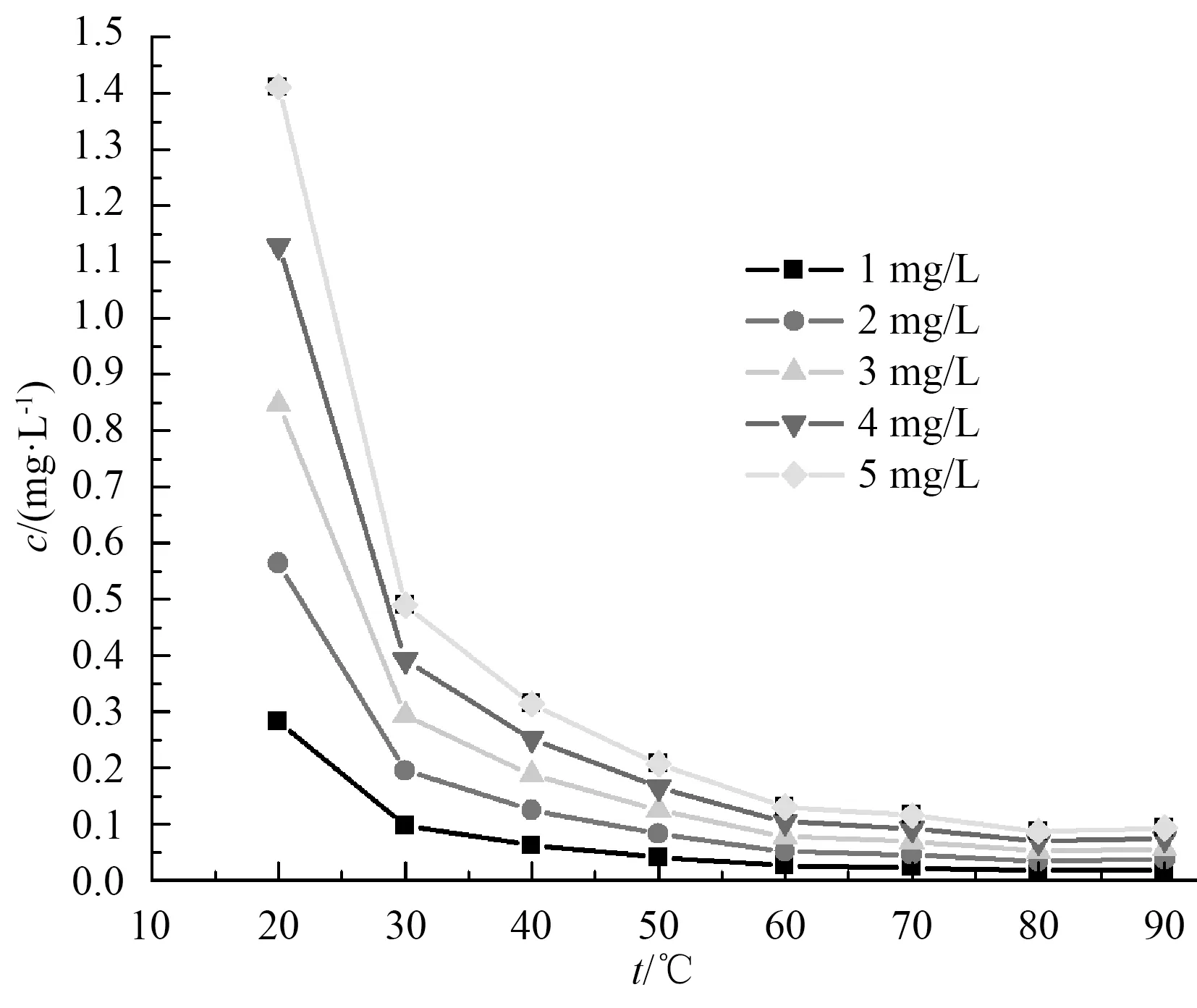
图6 消毒水体中NaClO3的浓度与反应温度和投加量的关系Fig.6 Relationship among NaClO3Concentration in Disinfected Water, Reaction Temperatures and Flocculant Dosags Addition
图6为反应时间为90 min条件下产生的二氧化氯消毒液在不同温度下分别1~5 mg/L的有效氯投加浓度对自来水厂滤后水消毒后水体中NaClO3的浓度变化曲线。当有效氯投加浓度相同时,消毒后水体中NaClO3的浓度,随反应温度的升高而降低,反应温度为20 ℃时消毒后水体中NaClO3的浓度是反应温度为90 ℃时的15倍。反应温度相同时,消毒后水体中NaClO3的浓度,随有效氯投加浓度的升高而升高,且基本成正比例关系。
3 结论
(1)NaClO3和盐酸反应,反应温度在20~90 ℃,反应时间在10~90 min时,升高反应温度或延长反应时间均可提高NaClO3的转化率。
(2)反应时间在10~90 min,相同反应时间条件下,反应温度在20~80 ℃时,ClO2的收率随反应温度升高而升高。
(3)反应时间在10~90 min,相同反应时间条件下,反应温度在20~80 ℃时,有效氯的收率随反应温度升高而升高。
(4)消毒后水体中氯酸钠的浓度c受消毒剂有效氯的投加浓度C和二氧化氯消毒液中反应残留的氯酸钠和有效氯的质量比η二者影响。当C固定时,降低η可降低c。提高反应温度或延长反应时间均可降低η的数值。

