鹅脱氧胆酸诱导细粒棘球蚴原头节凋亡作用机制的初步研究
汤光耀,李佳洁,马斌,姜玉峰,吕海龙*
(1石河子大学医学院第一附属医院肝胆外科,新疆 石河子832008;2石河子大学医学院人体解剖与组织胚胎学教研室,新疆 石河子832008)
细粒棘球蚴病(cystic echinococcosis,CE)又称囊型包虫病(echinococcosis),是由细粒棘球绦虫(Echinococcosis granulosus,Eg)的幼虫阶段寄生于人体或者宿主动物而引起的疾病,主要流行于新疆等畜牧业发达的地区[1]。细粒棘球蚴病主要发生在肝脏,治疗上以手术为主。胆瘘是囊型肝包虫病最常见的并发症[2-3],本课题组[4]在临床工作中发现,肝细粒棘球蚴病合并胆瘘患者包虫内原头节大部分已经死亡,并且肝包虫进入胆道后原头节无法发育成包虫。因此推测胆汁进入囊型肝包虫囊内是导致囊型肝包虫死亡的原因之一。孙冯等[5]将不同浓度胆汁体外作用于细粒棘球蚴原头节观察到胆汁可抑制原头节的活力。胆汁包含许多成分,具体哪种成分导致细粒棘球蚴原头节的死亡,目前并不清楚。胆汁酸是胆汁的主要成分,胆汁酸具有细胞毒性,可以破坏细胞膜的完整性,促进活性氧的产生并氧化修饰蛋白等细胞成分,高浓度胆汁酸可引起肝细胞变形坏死[6]。研究发现,疏水性胆汁酸可通过线粒体途径、内质网应激、死亡受体途径诱导肝细胞凋亡和坏死[7]。本课题组史红娟等[8]使用不同浓度鹅脱氧胆酸体外作用于原头节,发现鹅脱氧胆酸能够诱导细粒棘球蚴原头节凋亡,并具有时间和浓度关系。但具体鹅脱氧胆酸通过何种机制诱导原头节凋亡并不明确。本实验拟采用鹅脱氧胆酸(chenodeoxycholic acid,CDCA)体外作用于细粒棘球蚴原头节,检测鹅脱氧胆酸对细粒棘球蚴原头节活力的变化,并通过检测氧化-抗氧化相关蛋白水平变化,初步探讨鹅脱氧胆酸诱导原头节凋亡的作用机制,以期为临床发现新型抗包虫药提供一种理论基础。
1 材料与方法
1.1 材料
含细粒棘球蚴囊泡的羊肝买自昌吉屠宰场。鹅脱氧胆酸购于美国sigma公司;Nrf2多克隆抗体购自美国 abcam公司;Caspase-3、ROS、GSH-PX和 TPX检测试剂盒均购于南京建成公司;RPMI1640培养基购自上海哈灵生物公司,胎牛血清购自杭州四季青公司。
1.2 原头节的体外培养
获取含细粒棘球蚴病囊泡的羊肝,用双蒸水及75%酒精分别清洗肝脏囊泡表面,在无菌条件下抽取含原头节的囊液置于培养瓶中,静置,抽掉上清,用 PBS(PH7.2)液洗涤4~6遍,用0.1%伊红染液做染色排斥实验,98%以上拒染时可用于实验。将原头节移至含10%胎牛血清的1640培养基(青霉素及链霉素各100 U/mL)的培养瓶中,37℃、5%CO2培养箱中培养。
1.3 CDCA作用于细粒棘球蚴原头节
将原头节分为空白对照组及 500、1000、2000、3000 μmol/L CDCA 组。于无菌条件下用PBS清洗体外培养后的细粒棘球蚴原头节至其活力≥98%;取六孔板,按照设置好的体系及分组加入相应培养基,每组培养基中加入约2500个原头节,放于37℃、5%CO2条件下培养,从加药24 h开始,每天抽取100 μL培养液,用0.1%伊红染色法检测原头节活力并在倒置显微镜下观察计数。无活力或者活力差的原头节会被染成红色;活力较好的头节不被染色,且可活动。间隔3天更换培养液,重新加药。实验重复3次。
1.4 Caspase-3的酶活力测定
取空白组及1000、3000 μmol/L CDCA组作用24、48 h后的细粒棘球蚴原头节,PBS清洗3次后。每3 mg原头节中加入120 μL裂解液,超声破碎(功率、时间、次数),4℃12000 g高速离心10 min后,抽取上清液。按照 Caspase-3检测试剂盒步骤将反应体系加入96孔板中,于37℃避光孵育,待颜色变化较明显时,用 Bio-RAD酶标仪检测吸光度(A405值)。实验重复3次。
1.5 ROS水平的测定
收集空白组及 1000、3000 μmol/L CDCA 组作用2、4 d后的原头节,更换含DCFH-DA 10 μmol/L无血清培养基,37℃避光孵育1 h,弃培养液,PBS清洗3次,静置,待自然沉淀后收集原头节,用Bio-RAD荧光酶标仪检测DCFH OD值,488 nm激发波长,525nm 发射波。实验重复3次。
1.6 Western blot检测Nrf2蛋白的表达
收集不同浓度CDCA处理后的原头节。用含PMSF(1∶100)的 RIPA裂解缓冲液在冰上裂解 15分钟,用细胞超声破碎机粉碎,4℃ 12000 g离心10 min,收集上清液,BCA法测定蛋白浓度。1∶4比例加 5×上样缓冲液,100℃煮沸样品 9min,SDS-PAGE分离目标蛋白质,然后电转膜至 PVDF膜上,用含5%脱脂奶粉的 PBST封闭2 h,4℃一抗孵育过夜,用 PBST漂洗3次,二抗孵育3 h,用PBST漂洗3次后用 ECL发光液暗室显影1~3 min。ImageJ软件测算β-actin蛋白灰度值与目的蛋白灰度值的比值,并计算目的蛋白的相对表达量。
1.7 抗氧化酶GSH-Px和TPx活性的测定
分别取空白组及1000、3000 μmol/L CDCA 作用2、4 d的原头节,按照GSH-Px和TPx检测试剂盒中所述方法提取原头节蛋白,并用超微量紫外可见分光光度计测定蛋白浓度。取上清液,按照 GSH-Px和TPx检测试剂盒使用说明书方法检测原头节抗氧化酶活性;用超微量紫外可见分光光度计检测OD值。实验独立重复3次。
1.8 统计学分析
采用SPSS 17.0统计软件进行单因素方差分析(ANOVA)和最小显著差法(LSD)检验,以P<0.05为差异有统计学意义。
2 结果
2.1 CDCA作用原头节后活力的变化
CDCA 作用后的原头节活力曲线(图1)。随着时间的延长,同一药物浓度下原头节存活率逐渐降低;在同一时间下,随着药物浓度的增加,原头节存活率也降低。由此表明CDCA诱导原头节死亡具有时间和浓度依赖性。
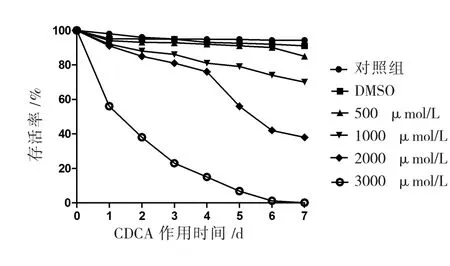
图1 CDCA作用后原头节的活力变化Fig.1 Survival of E.granulosus protoscoleces after in vitro exposure to CDCA
2.2 CDCA作用后原头节体内Caspase-3酶活性的变化
体外培养24、48 h后的各组原头节分别进行caspase-3酶活性检测,结果如图2所示。在相同时间内,随着药物浓度的增加,caspase-3酶活性逐渐增强,CDCA作用组同空白组比具有统计学意义(P<0.05)。
对 Caspase-3酶活性检测数据进行单因素方差分析,组间比较有统计学意义(F=655.038,P<0.05),以 3000 μmol/L CDCA 浓度组 caspase-3酶活性增加更显著。
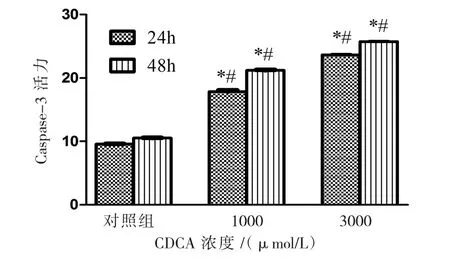
图2 CDCA作用24、48 h后原头节caspase-3酶活性变化Fig.2 Activity of caspase-3 in E.granulosus protoscoleces incubated with CDCA for 24 h and 48 h
2.3 CDCA作用后原头节内ROS水平的变化
CDCA 处理原头节2、4 d,采用 DCFH-DA 荧光染色后,CDCA组原头节可见绿色荧光,ROS的荧光强度变化见图3,荧光酶标仪检测显示终浓度1000、3000 μmol/L CDCA 作用 2 d后 ROS 荧光强度分别为对照组 2.47、3.83倍;作用 4 d后ROS荧光强度分别为对照组 3.560、4.91倍。由图3可见ROS随CDCA药物浓度的增加和作用时间的延长,ROS水平明显升高,采用单因素方差分析,差异有统计学意义(F=1631.77,P<0.05)。
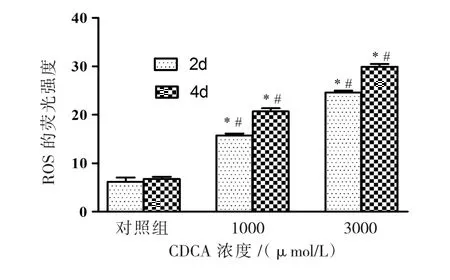
图3 CDCA作用2、4 d后原头节ROS水平变化Fig 3.Impact of CDCA on ROS level in E.granulosus protoscoleces after 2 d and 4 d post-incubation
2.4 CDCA抑制Nrf2蛋白的表达
利用western blot技术检测Nrf2蛋白的表达(图4),发现与对照组相比,1000、3000 μmol/L CDCA作用2 d后可见Nrf2蛋白表达降低,差异具有统计学意义(P<0.05);随着时间的延长,作用4 d后可见Nrf2蛋白的表达明显降低,说明CDCA可抑制Nrf2蛋白的表达,破坏了抗氧化防御系统。
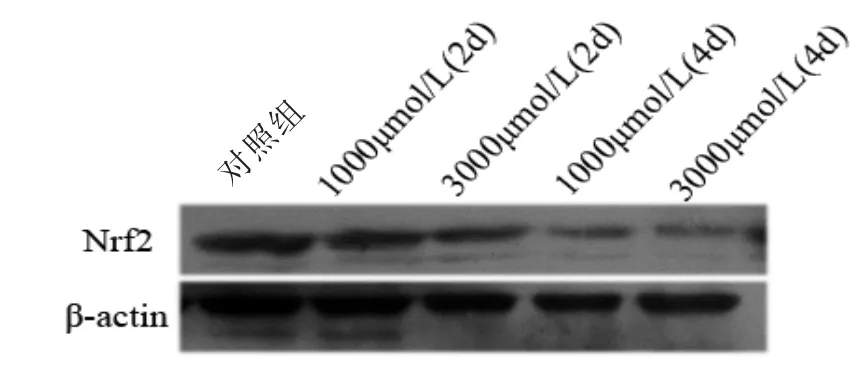
图4 CDCA作用2、4 d后原头节内Nrf2蛋白的表达情况Fig.4 Level of Nrf2 protein in E.granulosus protoscoleces incubated with CDCA for 2 d and 4 d
2.5 CDCA对细粒棘球蚴原头节抗氧化物酶GSH-Px和TPx酶活性的影响
CDCA处理原头节后GSH-Px和TPx酶活性检测结果见图 5,1000、3000 μmol/L CDCA 作用后的原头节与空白组相比较差异均有统计学意义(F=756.033、608.848,P<0.05)。 1000μmol/L CDCA作用原头节2、4 d后 GSH-Px和TPx的活性降低,采用单因素方差分析,差异均有统计学意义(F=756.033、608.848,P<0.05)。3000 μmol/L CDCA 组GSH-Px和TPx活性呈现类似的变化趋势。
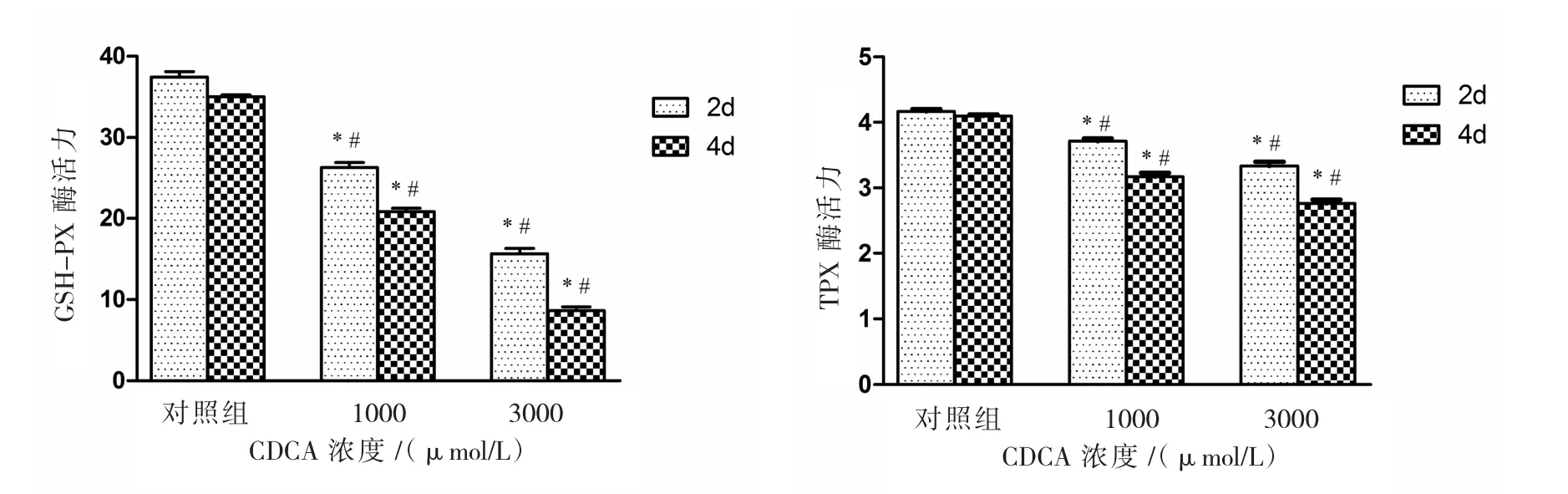
图5 CDCA作用2、4 d后原头节内GSH-Px和TPx酶活性的变化Fig.5 Impact of CDCA on GSH-Px and TPx activity in E.granulosus protoscoleces after 2d and 4d post-incubation
3 讨论
手术过程中原头节外溢是细粒棘球蚴病复发的主要原因[9],因此术中使用有效的化学药物是极其有必要的[10],但目前尚未报道既有效又安全的化学药物[11]。有关实验证实[8],CDCA能够诱导细粒棘球蚴原头节凋亡,但具体通过何种机制诱导原头节凋亡并不明确。
本实验结果显示随着CDCA浓度增加体外抑制细粒棘球蚴原头节的作用越明显,这同本课题组前期研究具有一致性[8]。原头节的活力曲线显示3000 μmol/L CDCA对原头节的抑制作用显著强于其他低浓度组 (1000、2000μmol/L CDCA)。此外 2000 μmol/L CDCA 作用2d时原头节的存活率为85%,作用4 d时其存活率下降到76%。提示CDCA具有潜在的抗肝囊性包虫病作用。
细胞凋亡又称为细胞程序性死亡,是机体的一种自我调节方式,而当机体的这种调节方式被破坏时则会诱发疾病的产生。在不同的病理过程中,由于许多的分子信号通路均可调节caspase-3,故caspase-3通常被当做凋亡的关键蛋白。本实验应用鹅脱氧胆酸体外作用于细粒棘球蚴原头节,观察到鹅脱氧胆酸能诱导原头节的凋亡,使caspase-3的酶活性升高,这与相关文献[8]的研究结果类似,进一步验证了鹅脱氧胆酸可抑制原头节的生长并可诱导原头节凋亡。
氧化应激(Oxygen stress)主要是通过使膜脂质过氧化从而改变生物膜功能并破坏酶的活性而引起不同程度的细胞损伤,甚至诱导细胞凋亡。转录因子NF-E2相关因子 2(Nuclear factor E2-related fator 2,Nrf2)是细胞内的一种转录因子,主要存在如肝脏、皮肤[12]等代谢器官中,可参与维持氧化还原平衡、凋亡等过程[13]。Nrf2是细胞抗氧化应激的关键因子,在细胞质中与Keap1相结合,能够使细胞逃避不良刺激。
有关实验表明[14],胆汁酸具有的细胞毒性能破坏细胞质膜,诱导细胞内活性氧(Reactive oxygen species,ROS)的产生,而 ROS可进一步增强胆汁酸的细胞毒性作用,最终诱导细胞的凋亡。有关研究表明[15],在体外研究条件下,过量的ROS能够导致线粒体结构受损,产生凋亡诱导因子,从而激活下游的caspase途径,最终激活caspase-3诱导细胞凋亡。而Nrf2主要是通过抑制线粒体途径起到抗凋亡作用[16]。Nrf2可被外界和内部多种刺激因子激活,当受到ROS的刺激后,Nrf2被磷酸化并与Keap1解离[17],之后磷酸化的Nrf2转位进入细胞核,启动下游抗氧化酶GSH-Px和TPx等基因的转录,这些酶和蛋白可灭活内源性ROS,避免ROS浓度过高诱发的细胞损伤[18],但当ROS浓度超过机体的抗氧化系统的防御机制时,就会导致抗氧化系统破坏,会诱导细胞发生凋亡[17]。
在本研究中,我们观察到细粒棘球蚴原头节早期就能够产生ROS。在用 CDCA处理后2、4 d后,我们观察到细粒棘球蚴原头节内ROS明显增加,并且随着CDCA药物浓度的增加和作用时间的延长,原头节内 ROS的水平也明显的升高,说明CDCA能够导致原头节出现氧化损伤;同时western blot检测到原头节内Nrf2蛋白的表达降低,抗氧化物酶试剂盒检测到其下游基因GSH-Px和TPx的表达也降低,并且具有浓度与时间关系。
目前,许多研究证实氧化应激与肿瘤细胞凋亡之间存在联系,细胞内ROS水平的变化可引起凋亡相关信号通路发生变化,可最终激活caspase-3,诱导细胞凋亡[19]。本实验结果证实氧化应激参与CDCA诱导原头节凋亡的过程中,这提示CDCA诱导细粒棘球蚴原头节凋亡可能是通过氧化应激途径起作用的,但进一步的作用途径的有待下一步研究探讨。

