早期血管内介入治疗进展性脑卒中15例
封 灏, 谭华桥,方 淳, 严 烁,徐霁充, 韩洪杰,马 林
进展性脑卒中(stroke in progression,SIP)指脑卒中发生后一段时间(6 h至2周)内神经功能缺损症状仍呈进行性或阶梯式加重的缺血性脑卒中[1],又称为进展性脑梗死、演变型卒中、恶化型卒中等,其判定标准通常依据加拿大神经功能量表(CNS)评分下降≥1分、斯堪地那维亚卒中量表(SSS)评分下降≥2分、美国国立卫生研究院卒中量表(NIHSS)评分下降≥3分、改良Rankin量表(mRS)评分下降≥1分[2]等。SIP具有危险因素多、发病机制复杂、致残率和病死率高等特点,内科治疗较为棘手。本研究回顾性分析血管内介入治疗的15例SIP患者临床资料,初步评价早期血管内干预的可行性、安全性及效果。
1 材料与方法
1.1 临床资料
收集2015年10月至2017年6月采用血管内介入治疗的15例SIP患者临床资料(表1)。其中男11例,女4例,年龄46~83岁;前循环病变10例,后循环病变5例;发病至病情进展时间为24 h~14 d;单纯颈内动脉重度狭窄4例,单纯颈内动脉闭塞1例,颈内动脉重度狭窄伴同侧大脑中动脉(MCA)栓塞1例,颈内动脉重度狭窄伴对侧颈内动脉闭塞1例,MCA M1段狭窄3例,双侧V4段闭塞1例,一侧V4段闭塞伴对侧椎动脉重度狭窄2例,一侧V4段闭塞伴基底动脉串联重度狭窄2例;病情进展期平均NIHSS评分为8.3±4.4。纳入标准:①发病24 h~14 d期间经严格内科药物治疗仍表现神经功能缺损症状加重;②神经影像学检查证实责任病变区颅内或颅外大血管严重狭窄或闭塞;③责任病变区侧支循环代偿不良。排除标准:①神经影像学检查证实病情进展原因为梗死后出血或其它血管发生新梗死;②存在近期大面积脑梗死灶;③严重感染、高热、心肾功能不全、低血容量或全身性低血压所致病情进展。
1.2 影像学检查与评估
所有患者均在病情进展加重时接受头颅CT平扫检查,排除梗死后出血;接受脑血管MRA/CTA检查重建,必要时接受螺旋CT灌注(CTP)成像检查,检测急性颅脑损伤后局部脑血流参数:局部脑血流量(rCBF)、局部脑血容量(rCBV)、血液通过组织平均通过时间(MTT),并分析低灌注部位。
1.3 手术方法
术前所有患者常规口服阿司匹林肠溶片(100 mg/d)、硫酸氢氯吡格雷(75 mg/d),用药不足 3 d 者术中应用替罗非班联合抗血小板集聚药物。
手术在气管插管全身麻醉下进行,全身肝素化,造影确认责任病变,遂行病变血管成形术——对重度狭窄,采用6 F/8 F Envoy导引导管(美国Johnson&Johnson公司)超选至病变血管近端,球囊由小至大依次扩张病变段,并视情况通过支架植入相关技术使残留狭窄<30%;对完全闭塞病变,采取9 F近端阻断球囊导引导管(意大利Invatec公司)分别阻断颈内动脉、颈外动脉血流,微导丝带微导管小心通过闭塞段,造影确认位于血管真腔并远端血管通畅,以交换技术用球囊分次扩张闭塞段,行支架植入术,沿导管回抽颈动脉停滞血液约60 mL,直至抽吸血液无碎片,沿球囊放气恢复血流;对责任病变为颅内2级分支血管闭塞,采用Solitaire FR支架(美国Medtronic公司)取栓后评估血流,伴发原位狭窄行球囊扩张支架成形术;对责任病变为动脉夹层,采用6 F/8 F Envoy导引导管超选至病变血管近端,视血管病变程度行球囊预扩后支架成形术。术中根据不同情况分别选用Gateway球囊、Sterling球囊(美国Boston科技公司)、Hyperform球囊(美国Medtronic公司)以及Enterprise支架(美国Johnson&Johnson 公司)、Wingspan 支架、Wallstent支架(美国 Boston 科技公司)、Protégé RX 支架(美国Medtronic公司)。
1.4 术后处理与疗效评价随访
术后严格控制血压,检测神经功能,常规给予硫酸氢氯吡格雷(75 mg/d)、阿司匹林肠溶片(100 mg/d)6个月,结合应用他汀类药物。根据造影复查情况决定是否减少阿司匹林用量。支架植入患者术后72 h内均皮下注射低分子肝素。
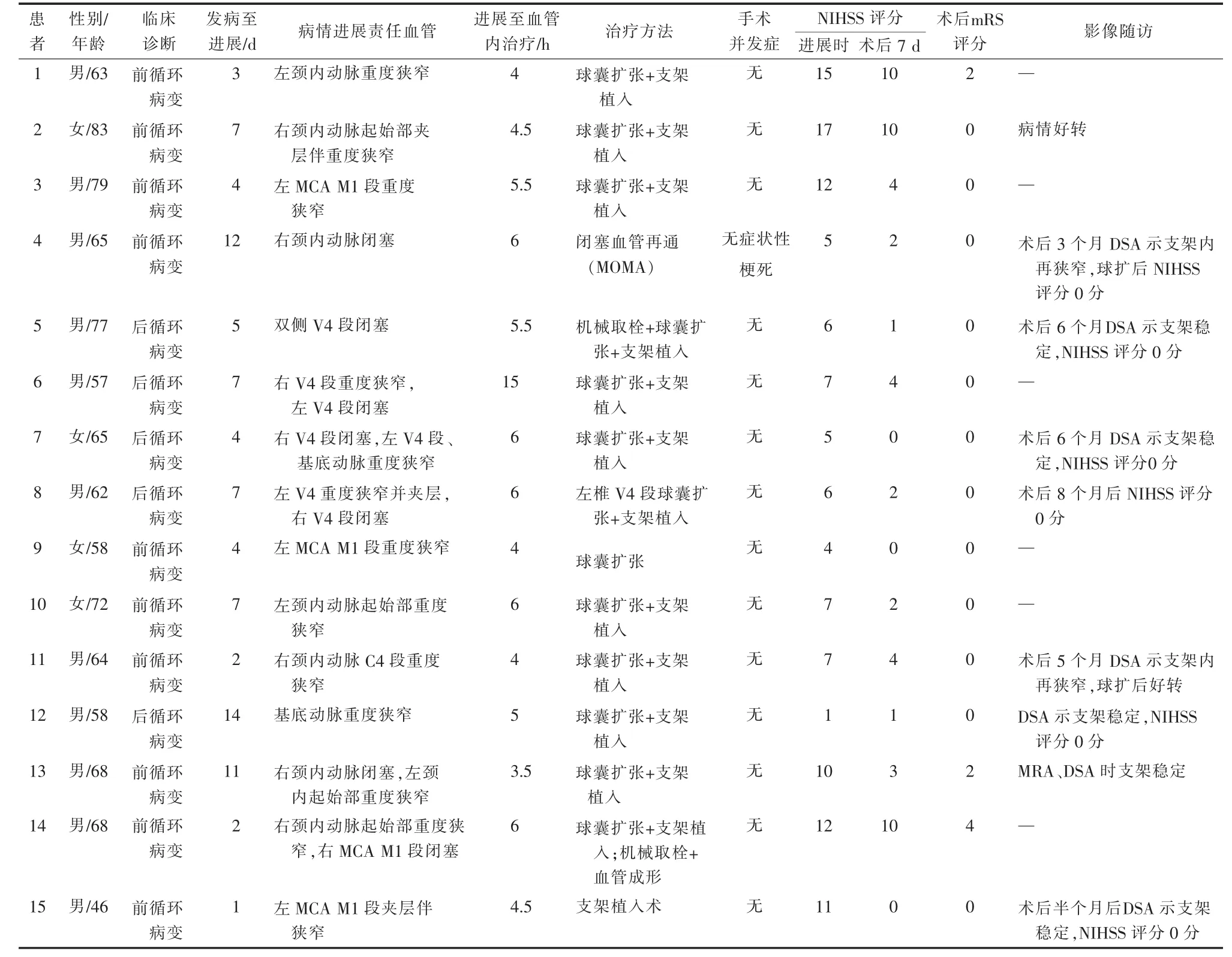
表1 SIP患者临床资料与血管内治疗结果
术后根据脑梗死溶栓(TICI)治疗后血流分级评价血管再开通情况。术后1周评估NIHSS评分,配对样本t检验评估神经功能改善情况,P<0.05为差异有统计学意义;术后3个月采用mRS评分评估术后残障程度。术后3、6、12个月临床随访,此后每年1次;6个月内首次复查造影。
2 结果
15例SIP患者均接受血管内介入治疗,其中病情进展期6 h内干预14例,15 h后干预1例(后循环病变)。手术技术成功率100%(图1)。10例前循环病变患者中颈动脉闭塞开通1例,球囊扩张+支架植入6例,单纯球囊扩张1例,单纯夹层支架植入1例,颈内动脉近端球囊扩张+支架植入+同侧MCA机械取栓1例;5例后循环病变患者中椎动脉机械取栓+球囊扩张+支架植入1例,球囊扩张+支架植入4例。术后脑血管造影显示所有责任血管均开通(TICI 3级),头颅CT复查均无即刻高灌注出血,仅1例术后3 d头颅MRI可见无症状性点状梗死灶。15例术后7 d平均NIHSS评分为3.5±3.6,与术前 8.3±4.4 相比显著降低(P<0.05)。
临床随访1~18个月,平均5.3个月。病情稳定,均无死亡,无新发神经功能缺损、无再发脑梗死及短暂性脑缺血发作(TIA)等发生;mRS评分0分12例(80%)、2分2例、4分1例。MRA/DSA随访8例(53.3%)平均 6.1(3~12)个月,其中 2 例内膜增生致支架内再狭窄(>50%),经球囊扩张后恢复血流至TICI 3级;6例随访不足6个月,尚无影像学随访资料。
3 讨论

图1 典型患者血管内治疗过程影像
SIP临床常见,多与短期内预后不良密切相关,发生率为27%~33.6%[3],致残率和病死率均较高[4]。影响SIP患者的全身因素主要有高血压/低血压、糖尿病、高同型半胱氨酸血症、发热与感染、高脂血症等,颈动脉粥样硬化程度、颈动脉狭窄程度、软斑及溃疡斑为危险因素[5]。血管狭窄/闭塞所致血流灌注不足、代偿血管建立不佳为本组患者主要病因(14例,93.3%),临床表现多为分水岭梗死和TIA反复发作,与相关文献报道相符[6]。大血管狭窄引起的栓子脱落栓塞也是病变进展原因之一,本组1例颈内动脉起始段夹层、重度狭窄伴同侧MCA M1段急性栓塞患者通过MCA机械取栓和颈内动脉近端球囊扩张、支架植入后血流恢复灌注。SIP发病机制与缺血半暗带增大有关[7],病情进展、发病严重程度和持续时间与缺血半暗带大小直接相关。SIP后缺血性半暗带局部灌流储备利用已达到最大限度,其压力流量自动调节机制丧失,流量与压力呈线性相关,灌流压稍有下降即可使功能尚存的脑细胞死亡。
SIP早期血管内介入治疗旨在抑制缺血半暗带进展性增大,挽救低灌区脑组织活性。目前有文献报道选择性颞浅动脉(STA)-MCA旁路移植术早期治疗急性缺血性脑卒中或SIP,可改善大部分患者神经功能,并认为早期STA-MCA旁路移植术对影像上伴有较小梗死核心患者或许是有益的[8]。有研究认为后循环脑卒中更易发生进展,原因在于后循环血管走行及分支生理变异较大,约60%供应脑干的深穿支较细,且许多小分支如内听动脉、小脑前下动脉及后下动脉等均为终末动脉,极易受血流动力学和血管管腔改变的影响[9]。但后循环脑卒中进展不易早期发现,无法精确评估神经功能缺损,为早期介入干预增加了难度。本组后循环SIP 5例(33.3%),血管内干预时间除1例为病情进展后15 h,余4例在6 h内,均获临床神经功能改善。SIP血管内介入干预时间缩短可使患者获益增加,本组患者病情进展至介入干预平均时间在前循环病变为(4.8±1.0)h,后循环病变为(7.9±4.8) h,符合急性缺血性脑卒中早期血管内介入治疗指南[10]要求。
SIP具有突发性、危险因素多、发病机制复杂、致残率和病死率高等特点,要求血管介入干预更积极和快速。本研究纳入发病24 h至14 d内神经功能缺损症状进展性加重患者,对超过溶栓/取栓时间窗患者积极介入干预,给予神经功能改善的最后机会。这也是SIP早期干预迫切性不同于症状性颅内大血管狭窄支架植入术的主要特点。
SIP血管内介入治疗主要风险有过度灌注综合征、梗死区出血转化、栓塞事件等,其中过度灌注综合征是最危险并发症,导致高达30%~50%致残率和致死率[11]。目前认可的过度灌注综合征危险因素主要包括高血压、糖尿病、病变狭窄程度、既往脑卒中史、Willis环等[12],本组患者通过术后严格控制血压和延长麻醉时间等措施避免了过度灌注综合征发生。术后梗死区出血转化是另一主要风险。有研究报道认为介入术后梗死区出血转化,可能主要由严重再灌注损伤和梗死区血管通透性增加等多重因素使血液外渗所致[13]。本组患者在术前CT排除大面积脑梗死后接受血管内介入治疗,避免了术后梗死区出血转化发生。另有研究报道认为即使患者已有大面积脑梗死,经过恰当的影像学筛选,大面积缺血核心与大面积成像不匹配患者也可从血管内介入治疗中获益[14]。该理论有助于指导SIP早期血管内干预时筛选病例及进一步前瞻性研究。
总之,在严格选择筛选病例,做好围手术期处理基础上,早期血管内介入治疗大血管闭塞或狭窄所致SIP安全有效,可改善缺血症状,促进患者相应功能障碍恢复,不增加出血或低灌注综合征风险。但远期疗效仍需扩大样本远期随访证实。

