核因子-κB和炎性反应因子对经导管动脉栓塞术后肝细胞损伤的作用探讨
王贝然, 杜 伟, 余义俊, 吴春华
肝细胞癌(HCC)起病隐匿、生长快、较早发生转移,患者确诊时大多已失去外科手术切除机会,手术切除率不足 20%[1-2]。经导管动脉栓塞术(transcatheter arterial embolization,TAE)已广泛用于治疗中晚期HCC患者,但术后常出现不同程度的肝脏损害,甚至发展为肝衰竭,导致死亡率上升[3]。因此,如何减轻和避免TAE术对肝功能造成损害,成为改善预后的关键。研究表明核因子(nuclear factor,NF)-κB在细胞坏死和炎性反应发生过程中发挥着重要作用[4],肿瘤坏死因子(TNF)-α 和白细胞介素(IL)-10作为参与炎性反应过程的重要炎性因子亦受到NF-κB调控[5-6]。本研究通过建立兔VX2肝癌模型并行TAE治疗观察癌旁组织中NF-кB表达以及TNF-α、IL-10含量变化,探讨它们在TAE后肝细胞损伤中的可能作用。
1 材料与方法
1.1 实验动物与主要器材
后腿皮下荷VX2瘤兔2只(东南大学附属中大医院惠赠),健康新西兰大白兔70只(大理大学实验动物中心提供),体质量为(2.8±0.28) kg,雌雄不拘,普通饲料喂养。
主要实验器材包括Philips 16排螺旋CT机、Toshiba TITAN 3.0T型 MR机、GE Innova-3100IQ型DSA机、自制实验兔手术台、自制小洞巾、各型号注射器、3%戊巴比妥钠、硫酸庆大霉素注射液、0.9%氯化钠溶液、碘化油、碘海醇、眼科剪、眼科镊、培养皿、超净台、动脉夹、18 G穿刺针、4 F导管鞘、3 F SP微导管、微导丝、NF-κB鼠抗兔多克隆抗体(武汉博士德公司)、二抗(抗鼠/兔)试剂及二氨基联苯胺(DAB)显色试剂(丹麦 Dako 公司)以及 IL-10、TNF-α兔双抗夹心法检测试剂盒(上海古朵生物科技公司)。
1.2 兔VX2肝癌模型制作
随机选取荷瘤种兔1只,经耳缘静脉推注3%戊巴比妥钠(30 mg/kg)麻醉(本实验均采取此麻醉方法)并固定,于后肢肿瘤处常规备皮、消毒,切开表皮,剥离肿块并将周边坏死组织清理干净,最后将边缘生长旺盛的鱼肉样肿瘤组织置于含50 mL 0.9%氯化钠溶液和2万U庆大霉素混合液培养皿中,用眼科剪将瘤块剪成约1 mm3碎块(图1①②);1 mL注射器抽吸瘤粒混合液(15~20个瘤粒/mL)后套用18 G穿刺针送至健康兔后腿皮下,以保种传代;将实验兔麻醉固定,备皮、消毒并铺巾,剑突下正中偏左侧纵向切开腹部,充分暴露肝脏,用眼科镊将肝左叶完整拉出,1 mL注射器换用18 G穿刺针呈30°斜穿刺入肝脏1.5~2 cm,回抽未见血液及胆汁回流后注入瘤粒混合液1 mL(图1③)并迅速用明胶海绵填塞穿刺通道,腹腔内洒入庆大霉素40万U,纱布压迫穿刺点止血3~5 min,无渗血后将肝脏放回腹腔内,关闭并缝合腹腔切口。为预防感染,术后连续3 d肌内注射庆大霉素40万U[7]。
1.3 实验模型分组及处理
造模后21 d分别行CT、MR检查追踪肿瘤种植及生长情况(图1④~⑧)。共计造模成功60只,造模成功率87%(60/69)。将60只VX2肝癌模型兔随机分为TAE组(碘化油0.2 mL栓塞供血肝动脉)、造影组(仅行肝动脉插管造影)(图1⑨⑩)和对照组(不作处理),每组20只。兔全身麻醉后固定于操作台上,右腹股沟附近10 cm范围内备皮、消毒后皮肤切一小口,用18 G穿刺针穿刺进入股动脉后引入导丝,拔去穿刺针后引入4 F导管鞘,经导管鞘放入4 F导管,通过导丝选入腹腔干;3 F微导管通过4 F导管超选入肝总动脉,造影明确肿瘤供血动脉;进一步超选至肿瘤供血动脉作造影,可看到肿瘤区
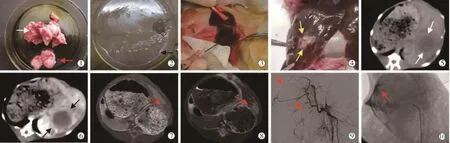
图1 兔VX2肝癌模型制作与实验处理影像
出现“抱球征”,通过3 F微导管推注碘化油后用明胶海绵栓塞,术毕按压穿刺点15 min。
1.4 实验标本存取
TAE术和造影完成后24 h,3组实验兔均统一处死,左上腹剑突下腹正中切口切取完整肝脏,分离瘤组织与周围正常肝组织,选取癌旁正常肝组织(距肿瘤>2 cm)[8];对分离出的各组癌旁组织标本作标记,放入5 mL塑料试管经液氮罐冷却,12 h后转移至-80℃冰箱保存备用。
1.5 NF-кB 表达判定
将实验标本固定后行石蜡包埋,切片后用EnVisionTM两步法免疫组化法作NF-кB苏木精-伊红(HE)染色,具体步骤按照说明书进行。每张切片于400倍镜下选取10个视野,依据细胞阳性表达数与被检测蛋白表达部位阳性信号强度作出综合评分。细胞阳性表达数计分:阳性表达细胞<5%为0分,5%~25%为1分,>25%~50%为2分,>50%为3分;阳性信号强度计分:细胞无染色为0分,染成淡黄色为1分,染成黄棕色为2分,染成深棕色为3分。将细胞阳性表达数评分和阳性信号强度评分相加之和,作为判定结果标准:<2分为阴性(-)表达,2~3 为弱阳性(+)表达,4~5 分为阳性(++)表达,6~7分为强阳性(+++)表达。
1.6 TNF-α、IL-10 蛋白含量检测
采用酶联免疫吸附试验(ELISA)法检测标本中TNF-α、IL-10蛋白水平,具体步骤按照试剂盒说明书进行。
1.7 统计学分析
采用SPSS 22.0软件对全部数据进行统计学分析。计量资料用t检验,以均数±标准差±s)表示,组间比较计数资料用χ2检验,P<0.05表示差异有统计学意义。
2 结果
免疫组化分析结果显示,TAE组、造影组、对照组癌旁正常组织中NF-кB阳性表达率分别为75%(15/20)、35%(7/20)和 20%(4/20);各组数据卡方检验显示,造影组与对照组差异无统计学意义(P>0.05),TAE组与造影组差异有显著统计学意义(P<0.001),TAE组与对照组差异有统计学意义(P=0.011),见图2、表 1。
ELISA检测显示,TNF-α、IL-10值在TAE组最高,高于造影组,对照组最低;方差分析对比显示,造影组与对照组差异无统计学意义(P>0.05),TAE组与对照组差异有统计学意义(P<0.05),TAE组与造影组差异有统计学意义(P<0.05),见表2。
3 讨论
肝动脉和门静脉为肝脏提供双重血供,动脉血流阻塞时门静脉可代偿供血,以维持肝脏正常功能。约99%肝肿瘤由肝动脉供血,这为TAE治疗HCC提供了理论支持[9],因此TAE为无法外科手术治疗的中晚期HCC患者提供了另一处理方案,有助于延长患者生命周期,提高生存率。然而即使采用超选栓塞治疗,TAE依旧会对肝脏造成损伤。由于肝血窦及肝内侧支循环丰富等特征,栓塞剂不可避免地进入癌旁正常肝组织并沉积于微小动脉和毛细血管,引起组织缺血缺氧,从而刺激肝组织产生大量活性氧和炎性因子,引发一系列复杂的内源性反应,导致肝细胞坏死、肝功能损伤[10],影响患者预后。
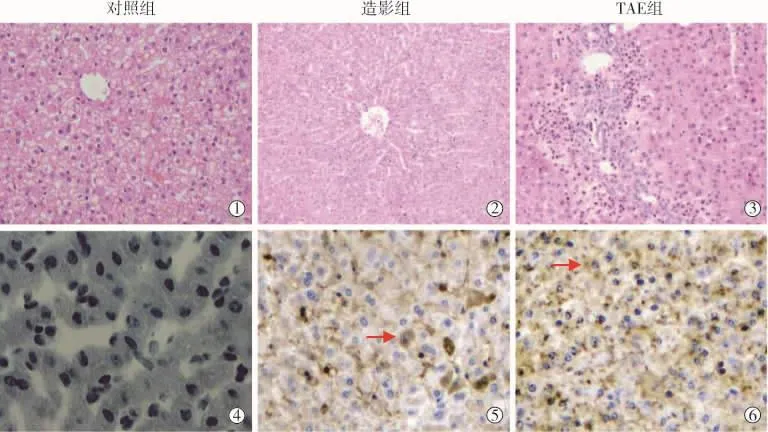
图2 3组癌旁肝组织HE染色与NF-кB表达

表1 NF-кB在癌旁肝组织中表达

表2 癌旁组织中TNF-α、IL-10测定值 ng/L
炎性反应是临床最常见病理生理过程之一,可发生于机体任何器官和组织,急性炎症时发生红、肿、热、痛等变化,且时常伴随发热、白细胞增多等全身症状。炎性反应实质是以TNF-α为代表的致炎因子与以IL-10为代表的抗炎因子之间全面抗争的自我保护过程,其分歧抗争贯穿炎性反应过程始终[11-12]。TNF-α 主要来源于单核巨噬细胞,一方面与TNF-α受体结合,破坏溶酶体致使酶外露而损伤组织,另一方面通过诱导组织上皮细胞活化,增高毛细血管通透性致使水肿液聚集阻碍细胞灌注和气体交换而加重组织损伤[13]。鉴于TNF-α强烈的毒性作用,其在TAE后肝组织损伤中可能起到助推器作用。IL-10则主要来自单核-巨噬细胞和辅助性T细胞,通常具有抗炎和免疫调节双重作用,能直接对内皮细胞和巨噬细胞等多种细胞产生强烈的抗炎和免疫抑制作用,减轻组织损伤[14]。机体受到各种原因所致刺激时,一方面致炎因子TNF-α等含量会增加,使局部组织细胞变性、坏死,发生损伤,另一方面通过激发抗炎因子IL-10释放发挥机体抵抗疾病的潜能,以利于更好地清除致炎因子,修复损伤组织,从而使机体恢复至正常状态[15]。如果促炎与抗炎双方旗鼓相当,那么机体内环境就会相对平稳,损伤最终得以修复;相反,如果其中任何一方由于失控而表达过度,平衡就会打破,从而加重器官或组织损伤[16]。本研究发现TAE组汇管区及肝小叶周边见大量中性粒细胞浸润(图2①~③),提示癌旁组织发生了严重损伤,而TAE组癌旁组织中TNF-α和IL-10浓度明显升高,推测可能是TAE术中各种原因引起癌旁组织缺血缺氧,导致了炎性反应发生。
NF-кB 是由 p105、p100、p50、p52、RelA/p65、c-Rel和RelB等7种蛋白组成的发挥转录活性功能的二聚体,正常生理状态下主要分布在细胞质中,与其抑制蛋白IκBα结合而不发挥转录功能。当细胞受到TNF-α、IL-10、缺血缺氧等致炎因素刺激时,IκBα发生氧化磷酸化被降解,NF-κB便失去束缚,进入细胞核中发挥转录活性功能,调控其下游多种炎性因子反应,对机体产生保护效应[17-19]。Chandra等[20]研究发现,严重缺血缺氧会导致NF-κB活化过度,使下游炎性因子TNF-α表达增强,进一步刺激IL-10合成,使炎性反应过程中促炎、抗炎平衡被打破,引起细胞坏死,最终导致组织损伤。本研究结果表明,与对照组和造影组相比,TAE组癌旁组织中NF-кB阳性表达率明显升高,与上述观点一致。
综上所述,TAE术后癌旁肝组织功能损伤可能是术中栓塞剂进入癌旁肝组织引起缺血缺氧,NF-кB活化过度并调控下游炎性因子TNF-α和IL-10使其合成增多,破坏了炎性反应过程中促炎、抗炎平衡所致。因此,在今后临床实践中,可将NF-кB作为保护肝功能的靶点,通过抑制其过度表达减少TNF-α和IL-10过度释放,尽可能减少甚至避免炎性反应过程中促炎、抗炎失衡发生,从而减轻对癌旁正常肝细胞的损伤,保护患者术后肝脏储备功能,提高生存率。

