不同评分系统对胃癌伴幽门梗阻患者术前营养状态评估的比较
杨东,郑志超,赵岩,张涛,刘勇
胃癌是常见的消化道恶性肿瘤之一,国内胃癌的发病率在各种恶性肿瘤中居第二位[1]。由于早期诊断率低,患者首诊时多为进展期,对于胃下部肿瘤常常伴有幽门梗阻,因消化道梗阻、饮食摄入不足、肿瘤消耗等原因导致营养不良发生率更高[2]。文献报道,新辅助化疗可提高进展期胃癌伴幽门梗阻患者的总体治疗效果[3],但因患者不能正常饮食,给新辅助化疗的实施带来了很大影响。因此,对于进展期胃癌伴幽门梗阻患者的营养支持尤为重要,而在营养支持实施之前,一套适合于评估此类患者营养状态的评分系统显得更为重要。目前有多种营养状态评分系统用于患者营养状态的评估,但效果不一。本文分别应用营养风险筛查表(NRS2002)和患者主观整体评估法(patient generated subjective global assessment,PG−SGA)对进展期胃癌伴幽门梗阻患者的术前营养状态进行评价,比较两者的优劣。
1 资料与方法
1.1 一般资料 收集2016年7月—2017年7月辽宁省肿瘤医院胃外科患者114例,男64例,女50例,年龄24~82岁,中位年龄62岁。肿瘤分期根据2010年国际抗癌联盟标准,Ⅱ期35例、Ⅲ期79例。纳入标准:(1)术前经胃镜、组织病理活检确诊为胃癌伴幽门梗阻。(2)术前CT等检查未发现远处转移。(3)以胃癌为主要疾病,不合并其他重要脏器的严重疾病。(4)无精神疾病,沟通自如,对答切题。(5)对本研究问卷调查知情同意并积极配合。排除标准:不符合NRS2002评分系统初筛条件,如患者体质量指数(BMI)≥20.5 kg/m2,过去3个月没有体质量下降,在过去1周内没有摄食减少,没有严重疾病。
1.2 方法
1.2.1 患者一般情况收集 患者入院后询问病史,包括首发症状、排便习惯、病程等,并于次日清晨空腹称体质量及测定皮下脂肪,记录患者病程中体质量下降情况。本研究以患者血清白蛋白为金标准判断患者是否有营养不良。患者清晨空腹采集静脉血4 mL,2 h内完成检测。采用OLYMPUS AU2700全自动生化分析仪,使用科华试剂及配套定标液(批号20120732)测定血清白蛋白,正常参考值为37~55 g/L,低于30 g/L诊断为营养不良。
1.2.2 PG−SGA评分 PG−SGA包括详细的病史及身体评估参数,每个部分的分值为0~4分,最后算出总得分。根据总分判断是否需要营养支持干预,同时也对收集的数据进行量化,其结果可以连续测定,动态观察,总分越高提示营养状况越差。主要包括4个方面:(1)体质量丢失的评分。对1个月内或6个月内体质量丢失情况进行评价。(2)疾病和年龄的评分。疾病包括肿瘤、艾滋病、肺性或心脏恶病质、褥疮、开放性伤口或瘘、创伤,年龄≥65岁。(3)代谢应激状态的评分。包括发热、发热持续时间、糖皮质激素用量。(4)体格检查评分。脂肪、肌肉、体液、总体消耗的主观评估。评估结果:根据是否需要营养干预分为无/轻度营养不良组(≤3分)和中/重度营养不良组(≥4分)。0~1分,此时无需干预,常规定期进行营养状况评分;2~3分,由营养师、护士或临床医生对病人及家属的教育指导,并针对症状和实验室检查进行恰当的药物干预;4~8分,需要营养干预及针对症状的治疗手段;≥9分,迫切需要改善症状的治疗措施和恰当的营养支持。本研究中将≥4分认定为患者营养不良。
1.2.3 NRS2002评分 主要包括3项内容:(1)营养受损状况评分(0~3分)。1分,近3个月体质量下降>5%,或近1周进食减少25%~50%;2分,近2个月体质量下降>5%,或近1周进食减少50%~75%,或18.5 kg/m2<BMI<20.5 kg/m2或白蛋白<35 g/L;3分,近1个月体质量下降>5%,或近1周进食减少75%以上,或BMI<18.5 kg/m2或白蛋白<30 g/L。(2)疾病严重程度评分(0~3分)。1分,一般恶性肿瘤、髋部骨折、长期血液透析、糖尿病、慢性疾病,如肝硬化、慢性阻塞性肺疾病(COPD)等;2分,血液恶性肿瘤、重度肺炎、腹部大手术、脑卒中;3分,颅脑损伤、骨髓移植、重症监护患者。(3)年龄评分(0~1分)。0分,年龄≤70岁;1分,年龄>70岁。3项评分相加得出总分(0~7分)。本研究中总分≥3分提示患者存在营养不良。
1.3 统计学分析 资料录入EXCEL数据库中,采用SPSS 17.0统计软件进行统计。首先对各组连续变量进行正态性检验,对满足正态分布的变量采用均数±标准差(±s)表示,偏态分布的计量资料以M(P25,P75)表示。采用受试者工作特征(ROC)曲线评价两种评分系统的诊断价值,并计算曲线下面积(AUC)。P<0.05为差异有统计学意义。
2 结果
2.1 入组患者营养不良发生率 114例患者根据血清白蛋白诊断营养不良80例,营养不良发生率为70.1%。
2.2 NRS2002和PG−SGA营养风险筛查结果 114例患者均完成NRS2002和PG−SGA评分调查。NRS2002筛查结果显示,114例患者中,≥3分70例,营养风险发生率为61.4%(70/114)。PG−SGA评估结果显示,114例患者中,≥4分76例,营养不良发生率为66.7%(76/114)。
2.3 NRS2002和PG−SGA评分的诊断价值 以患者血清白蛋白为金标准,判断患者有营养不良为阳性,比较PG−SGA及NRS2002两种评分系统对胃癌伴幽门梗阻患者营养不良的敏感度和特异度,绘制ROC曲线,结果显示,PG−SGA的敏感度和特异度均高于NRS2002,见图1、表1。
3 讨论
3.1 胃癌伴幽门梗阻患者的营养风险较高 营养不良在进展期胃癌中的发生率较高,而伴幽门梗阻患者由于术前长期营养摄入不足、消化功能障碍及肿瘤消耗增加等,营养状况进一步恶化,同时手术治疗、创伤及应激等进一步加重了患者机体代谢的紊乱,从而降低患者对手术、化疗等肿瘤综合治疗的耐受性,给患者的临床治疗效果造成直接不良影响。营养不良对于可根治性手术切除的胃癌患者最突出的影响是患者术后并发症发生率的增高及平均住院日的延长[4],而对于进展期胃癌伴幽门梗阻患者最主要的影响是新辅助化疗是否可以安全实施。传统治疗观点认为,进展期胃癌伴幽门梗阻是手术适应证。自从1989年将新辅助化疗用于治疗晚期胃癌患者以来,目前新辅助化疗在国际上已经成为进展期胃癌综合治疗的主要手段。研究显示新辅助化疗并不增加手术并发症的发生率[5]。胃癌伴幽门梗阻的患者采用直接手术治疗,可能失去降低分期及根治性切除的机会,因饮食摄入不足,很难耐受新辅助化疗。文献报道,营养支持有助于新辅助化疗等抗肿瘤治疗的实施,能改善胃癌伴幽门梗阻患者的营养状况,提高生活质量[6]。因此采用一套适当、有效的营养评估系统评估此类患者的营养状态,并对存在营养不良的患者尽早给予合理的营养支持显得十分重要。

Fig.1 ROC curve of NRS2002 and PG−SGA for evaluation of malnutrition in patients with advanced gastriccancer and pyloric obstruction图1 NRS2002及PG−SGA评价进展期胃癌伴幽门梗阻患者营养不良的ROC曲线
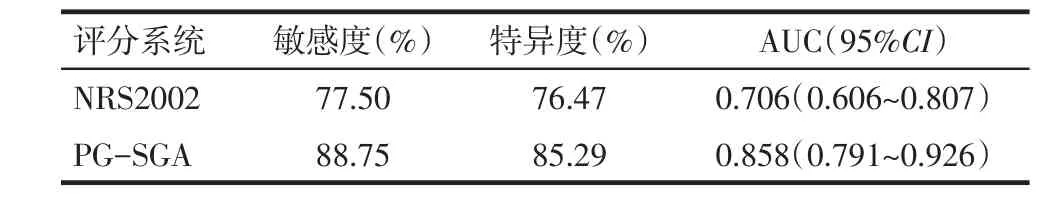
Tab.1 Diagnostic efficacy of NRS2002 and PG-SGA for malnutrition in patients with advanced gastric cancer and pyloric obstruction表1 NRS2002及PG-SGA对进展期胃癌伴幽门梗阻患者营养不良的诊断效能
3.2 NRS2002和PG−SGA评分系统的临床应用 NRS2002在2002年由欧洲肠内与肠外营养学会提出[7],目前已经被广泛应用于腹部常见恶性肿瘤,如胃癌、大肠癌等患者的术前营养状态评估。2016年美国肠外与肠内营养学会(ASPEN)将NRS2002推荐为首选营养风险筛查工具[8]。研究显示,应用NRS2002评估胃癌患者术前营养状态,营养不良组术后并发症的发生率明显高于营养良好组(26.2%vs.13.8%),根据NRS2002评分给予适当的营养支持对减少患者术后并发症有较大意义[6,9]。研究表明,应用NRS2002对胃癌患者术前营养不良的诊断率可达93.1%[6]。本研究结果显示NRS2002对胃癌伴幽门梗阻患者术前营养不良的诊断率为61.4%,低于文献报道,可能与研究样本量少及入组患者为胃癌伴幽门梗阻的特定患者、存在一定的偏倚有关。
PG−SGA是由美国Ottery[10]于1994年提出,是在主观整体评估(Subjective global assessment,SGA)的基础上发展而来,是专门针对肿瘤患者研究设计的营养评估系统。研究显示,PG−SGA是肿瘤患者特异性的营养评估系统,因此得到美国营养师协会(American Dietetic Association,ADA)等机构的广泛推荐和应用[11]。Gabrielson等[12]研究表明PG−SGA评分表是针对恶性肿瘤患者进行营养状态评估最合适的一种评价方法。美国营养学协会将PG−SGA评分表推荐为对恶性肿瘤患者进行营养评估的首选方法[11]。澳大利亚营养师协会推荐将PG−SGA评分表用于恶性肿瘤患者放疗后的营养评价[13]。中国临床肿瘤学会(CSCO)肿瘤营养治疗专家委员会认为,PG−SGA评分表是现阶段应用于恶性肿瘤营养风险评估最广泛的方法之一(1类证据)[14]。罗茜等[15]认为,PG−SGA对消化系统恶性肿瘤患者营养状况评价具有较高的应用价值。部分学者研究发现,与NRS2002相比,PG−SGA对常见恶性肿瘤患者的营养状况诊断具有更高的敏感度,因此更适合恶性肿瘤患者的营养评估[16]。另有研究表明PG−SGA可以有效评估消化道恶性肿瘤患者的营养状态,可以作为临床医务人员营养治疗的参考[17]。临床工作中,营养筛查系统要求简便、快捷、敏感度高。Bauer等[5]研究发现PG−SGA评分有很好的敏感度(98%)和特异度(82%)。本研究结果显示PG−SGA对胃癌伴幽门梗阻患者术前营养不良评估的敏感度为88.75%,特异度为85.29%,其敏感度低于文献报道,可能与研究样本量少、判断营养不良的界值不同及入组患者为胃癌伴幽门梗阻的特定患者、存在一定的偏倚有关。而本研究中评分为3分者有5例,如将其纳入营养不良,则敏感度为93.75%,特异度为82.35%,结果将与文献结果相近。国际上对PG−SGA的研究早已开展多年,并已经将其广泛应用于肿瘤、肾病、脑卒中等患者的营养评估,但国内对PG−SGA的研究相对较少。营养评估的目的是发现已经存在的或潜在的营养不良患者,以便及时对其给予合理的营养支持,改善患者临床结局。
3.3 NRS2002和PG−SGA对胃癌伴幽门梗阻患者营养风险评估的适用性 本研究结果表明,PG−SGA更适合于对进展期胃癌伴幽门梗阻患者的术前营养状况评估。研究工作中应用PG−SGA评估1例患者的营养状态通常可在15 min内完成,稍长于NRS2002(10 min内),这可能是由于PG−SGA所含项目较多、专业性较强所致,若事先对进行评分的医务人员给予专业培训并熟练掌握,耗时会缩短。基于NRS2002系统年龄划分为70岁,PG−SGA评分年龄划分为65。不同的年龄划分可能与NRS2002、PG−SGA两者在营养相关评价上的侧重点不同,NRS2002侧重于营养风险的筛查,而PG−SGA侧重于营养状况的评估。
总之,PG−SGA评分系统更适合于进展期胃癌伴幽门梗阻患者术前营养状态的评估,有较高的敏感度和特异度,可为此类患者营养支持的实施提供有力的指导。

