土人参Actin基因片段的克隆及序列分析
叶玉妍,陈 晓,杨礼香
(广州大学生命科学学院,广东 广州 510006)
发掘野生植物资源和药用植物资源的优异功能基因是当前植物分子生物学的研究热点之一。探究功能基因的表达模式是植物分子生物学的重要方面,基因表达模式的研究通常需要一个稳定表达的持家基因作为参考[1]。Actin即肌动蛋白,在不同物种中高度保守,是细胞骨架的重要组成部分,能参与多种植物细胞的功能调控,响应不同的信号转导事件。编码Actin的Actin基因普遍存在于真核生物中,能够在植物体的不同组织表达,并且在同一时空保持相同的表达水平[2]。因此,在植物分子生物学研究中,常作为植物功能基因的内参基因。Actin基因是一段高度保守的序列,是一个典型、庞大的基因家族,可通过设计简并性引物扩增不同植物的Actin基因片段[1]。目前,已从多种植物中克隆出了Actin基因片段,如厚藤(Ipomoea pescaprae)[2]、草海桐(Scaevola sericea)[3]、葡萄(Vitis vinifera)[4]、桑树(Morus alba)[5]、四翅滨藜(Atriplex canescens)[6]、碱蓬(Suaeda glauca)[7]、拟南芥(Arabidopsis thaliana)[8]等。
土人参(Talinum paniculatum)又名水人参、土高丽参等,为马齿苋科土人参属一年生或多年生草本植物[9],广泛分布于长江以南各地,如广西、广东、贵州等省(区)[10]。土人参易于栽培,富含黄酮类、多糖等活性物质,茎叶可作为蔬菜食用,根可作为炖汤原料,营养丰富,有补血益气等作用[11-12]。此外,土人参的提取物还具有抗菌和抗氧化作用[13-14],具有较高的食用和药用价值。目前关于药用植物药用价值和活性成分提取方面的研究较多,但对功能基因的研究鲜见报道,本试验利用逆转录PCR(reverse transcription)技术克隆到土人参Actin基因的cDNA片段,可作为后期研究土人参功能基因的内参基因,为药用植物土人参功能基因表达和调控的研究提供参考。
1 材料与方法
1.1 试验材料
以土人参嫩叶为试验材料。土人参为华南植物园表观遗传学实验室培育,将土人参种子(购自北京绿金蓝种苗有限责任公司)种植于混合土壤(蛭石与营养土为1∶3)中,22℃温室培育30 d后,幼苗移至室外,继续培养14 d,收集叶片,锡纸包裹置于液氮速冻,保存备用。
主要试剂:大肠杆菌DH5α由华南植物园表观遗传学实验室保存。RNA提取采用HiPure Plant RNA Kits ( R4151)试剂盒法(Magen公司)。cDNA链按照TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix说明书(全式金公司)进行合成。DNA回收采用HiPure Gel Pure DNA Kits(Magen公司)。高保真Taq酶为ProbestTM DNA Polymerase(TakaRa公司)。pGEM-T载体购于TakaRa公司,其他生化试剂均为进口或国产分析纯。
1.2 试验方法
1.2.1 引物合成 参照郭艳等[1]的方法,在NCBI上查询多种植物Actin基因序列,根据所查核苷酸序设计简并性引物ActinP1和ActinP2,用于土人参Actin基因片段的扩增,推测目的片段的长度为598 bp。
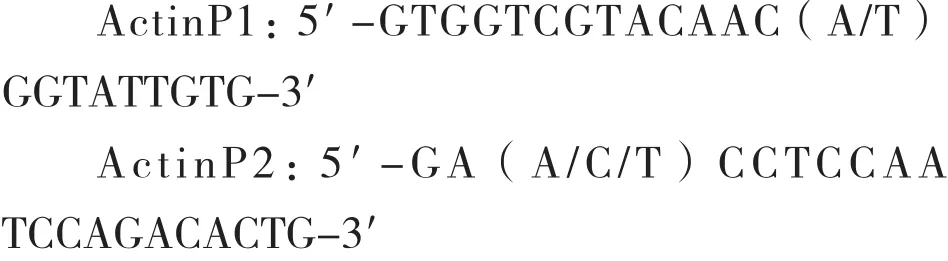
1.2.2 总RNA提取 选取土人参嫩叶,按照Magen公司的HiPure Plant RNA Kits ( R4151)中的说明书方法提取土人参叶片总RNA,采用琼脂糖凝胶电泳和NanoDrop 1000核酸蛋白检测仪检测所提RNA的浓度。
1.2.3 RT-PCR扩增 PCR扩增反应体系参考郭艳等[1]的方法,以总RNA为模板进行逆转录反应获取cDNA第一链。cDNA单链的合成依照全式金公司TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix 的说明书进行。反应程序为:预变性(94℃,5 min);变性(94℃,30 s)、退火(56℃,45 s)、延伸(72℃,45 s),循环30次,72℃延伸10 min。
RT-PCR扩增所得产物用1%琼脂糖电泳检测,获得单一DNA片段,为RT-PCR扩增所得的Actin基因片段。目的DNA片段的回收按照Magen公司的HiPure Gel Pure DNA Kits说明书方法进行。
1.2.4 阳性克隆的筛选与鉴定 将回收的DNA片段连接于pGEM-T载体上,并转化至大肠杆菌感受态DH5α中,涂布在含有100 μg/mL AMP的LB固体培养基上,倒置于37℃培养箱培养12 h,随机用所设计的简并引物ActinP1和ActinP2进行菌落PCR鉴定,挑取符合条件的菌落进行质粒提取,送至广州英潍捷基公司测序。
1.2.5 序列的生物信息学分析 通过ORF finder网站(https://www.ncbi.nlm.nih.gov/orffinder/),获得测序所得核苷酸序列ORF阅读框以及预测的氨基酸序列。在NCBI上通过BLAST比对,选取较常见且与TpActin1同源性较高的8种植物的Actin基因,下载它们的肌动蛋白基因序列,包括大豆(Glycine max,XP_003523242.1)、拟南芥(Arabidopsis thaliana,NP_001319585.1)、甜菜 actin1(Beta vulgaris,AGW21693.1)、马齿苋(Portulaca oleracea,AIW52352.1)、红肉火龙果(Hylocereus polyrhizus,ASZ85168.1)、甜菜actin2 (Beta vulgaris,AGW21694.1)、刺儿菜(Cirsium setosum,AEY77415.1)、玉米(Zea mays,ONM08622.1),进行多序列比对并构建系统进化树。
TpActin1的氨基酸序列同源性分析采用Clustal Omega程序,在Clustal网站(http://www.clustal.org/)上进行,序列的着色在BoxShade网站(https://embnet.vital-it.ch/software/BOX_form.html)上进行。TpActin1的系统进化树构建采用MEGA6生物软件中Neighbor-Joining算法。
2 结果与分析
2.1 总RNA检测结果
将土人参嫩叶提取的总RNA进行琼脂糖凝胶电泳检测,结果显示,28S rRNA、18S rRNA条带清晰可见,说明提取的RNA无明显降解情况;NanoDrop 1 000核酸蛋白检测仪检测OD260nm/OD280nm的平均值约为2.17,无蛋白质等杂质污染,表明RNA纯度较高,总RNA浓度为239 ng/μL。通过琼脂糖凝胶电泳以及NanoDrop 1 000核酸蛋白检测仪检测后,确认获得的总RNA可用于下一步RT-PCR扩增试验。
2.2 RT-PCR扩增
以土人参鲜嫩叶片提取的总RNA逆转录得到cDNA第一链为模板,进行Actin基因PCR扩增。通过琼脂糖凝胶电泳检测扩增产物发现,在Marker 500~800 bp之间有1条清晰明显的特异条带,该DNA分子大小与预测的目的Actin基因片段(598 bp)相符(图1),可能是土人参Actin基因片段,可进行下一步试验验证。
2.3 阳性克隆的鉴定与测序
将回收的DNA目的片段连接到pGEM-T载体上转化至大肠杆菌DH5α。将转化菌液涂布于LB固体 (含100 μg/mL Amp)培养基平板上,37℃培养12 h。随机挑取单菌落,用所设计的简并引物ActinP1和ActinP2进行菌落PCR检测,得到的扩增片段DNA分子量大小约为598 bp(图2),与RT-PCR检测结果一致,表明此克隆为阳性克隆,可以提取质粒,进行测序。
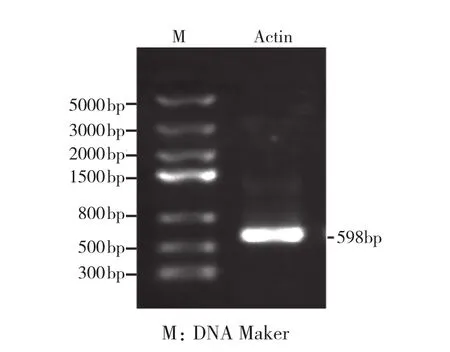
图1 土人参Actin基因的扩增结果
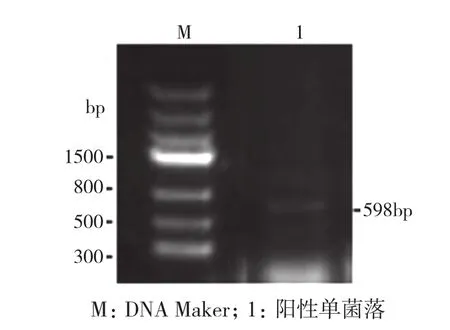
图2 重组克隆的菌落PCR检测结果
2.4 序列分析
将阳性克隆扩增培养后提取质粒,重组质粒测序结果显示,获得一段大小为598 bp的基因片段可编码198个氨基酸(图3)。将该序列在NCBI中进行Blast对比,发现克隆所得片段的核苷酸序列与同为原产热带美洲的红肉火龙果ACT7(MF356257.1)的同源性最高、达93%;与其他Actin基因的核苷酸序列的同源性也在85%以上。克隆所得片段编码的氨基酸序列与同为马齿苋科的马齿苋(AIW52352.1)的同源性最高、达97%;与藜科的甜菜(AGW21693.1)同源性也达97%。表明克隆所得片段为土人参的Actin基因片段,将该基因命名为TpActin1,登录在GenBank,序列号为MH333039。

图3 土人参Actin(TpActin1)cDNA片段的核苷酸序列及推测的氨基酸序列
将推测出的土人参Actin基因的氨基酸序列片段与GeneBank数据库中与土人参Actin基因同源性较高且常见的植物Actin基因编码的氨基酸进行多重比较,发现TpActin1编码的保守氨基酸序列多达194个,而非保守氨基酸序列仅有4个,表明TpActin1基因片段在氨基酸水平上同样高度保守(图4)。
由图5可知,马齿苋科的土人参TpActin1的氨基酸与藜科的甜菜 (Bvactin2)以及豆科的大豆 (Gmactin7)同源性最高,其次为藜科的甜菜 (Bvactin1)、菊科的刺儿菜 (Csactin)、仙人掌科的红肉火龙果 (Hpactin7)、十字花科的拟南芥 (Atactin2)、马齿苋科的马齿苋(Poactin)、禾本科的玉米 (ZmActin1)。本试验克隆所得的片段在核苷酸和氨基酸水平均高度保守,确定为土人参的Actin基因片段,可应用于下一步基因功能研究。
3 结论与讨论
肌动蛋白是真核生物中一种重要的结构蛋白,在细胞活动中发挥着重要作用,其氨基酸序列具有高度的同源性和保守性。Zhu等[15]、Kozuka等[16]、Papakonstanti等[17]认为,肌动蛋白可参与细胞骨架结构的维持及细胞运动、细胞分裂、细胞转录等,在细胞内发挥重要的生理功能。Chang等[18]、Calvo等[19]认为,编码肌动蛋白的Actin基因参与持家基因(House-keeping gene)基本功能的表达,因此常被作为常规基因表达的内源参照。在高等植物中,有关Actin基因结构与表达的研究已较深入,Mcdowell等[20]在拟南芥中报道了8个功能性肌动蛋白基因和2个肌动蛋白假基因。而克隆Actin基因用于发掘植物优异基因,是植物分子生物学研究的重要内容。不同植物Actin基因的克隆和序列分析可进一步用于植物优异基因的研究,为农作物重要功能基因的表达分析提供内参基因,或为研究植物抗逆性基因(抗旱、抗盐碱)的发掘和表达模式分析提供内参基因[21-23]。
本试验以土人参嫩叶为材料,提取总RNA,通过反转录的方法扩增Actin基因片段,随机挑取扩增所得的Actin基因片段,克隆得到土人参Actin基因的cDNA片段,大小为598 bp,与盐生植物碱蓬[7]、多浆旱生植物霸王[22]、旱生植物梭梭[23]克隆所得的基因片段大小相同。将其命名为TpActin1,并登陆在GenaBank,登录号为MH333039。序列分析表明,TpActin1基因片段的核苷酸序列与同为原产热带美洲的红肉火龙果ACT7(MF356257.1)的同源性最高,氨基酸序列与同为马齿苋科的马齿苋(AIW52352.1)的同源性最高,达97%;与藜科的甜菜(AGW21693.1)同源性也达97%。此外,TpActin1基因片段与其他已在GenaBank登录的植物Actin基因核苷酸序列的同源性均在85%以上,氨基酸序列一致性均在86%以上。因此,确认TpActin1为高度保守且稳定表达的持家基因,可作为土人参的内参基因并用于其功能基因的研究。

图4 TpActin1与其他植物Actin基因氨基酸序列的多重对比
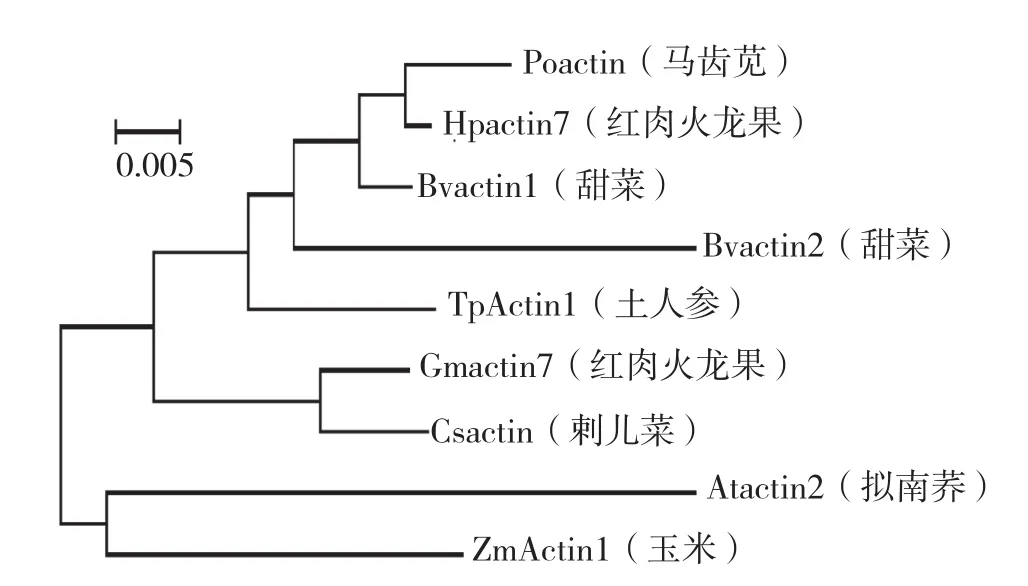
图5 TpActin1与其他植物Actin基因的氨基酸序列同源性分析

