降钙素基因相关肽对大鼠肺泡上皮Ⅱ型细胞间质转分化的作用及机制*
李先伟, 蒋莉莉, 左东泽, 郝 伟, 吴海龙
(皖南医学院药理学教研室 安徽省多糖药物工程技术研究中心, 芜湖 241002;安徽师范大学生命科学学院, 芜湖 241000)
肺纤维化是多种肺部疾病的最终转归,其发病率高,预后差,且缺乏有效治疗方法[1]。因此,探究肺纤维化的发病机制,寻找积极、有效、安全的治疗方法,具有重要的理论和现实意义。近年来,肺泡上皮细胞间质转分化(alveolar epithelial-mesenchymal transition, EMT)在肺纤维化中的作用逐渐获得认可[2]。大量研究表明,转化生长因子-β1(transforming growth factor-β1,TGF-β1)在EMT过程中起着重要作用,被认为是肺纤维化发病机制中的“开关”,可以诱导肺泡Ⅱ型上皮细胞向成纤维细胞和肌成纤维细胞转分化,同时也是诱导EMT的主要细胞因子[3]。最近研究发现,TGF-β1可以激活Notch信号转导通路,二者通过协同作用影响EMT进程,参与肺纤维化的发生与发展,但具体的机制不明[4]。
降钙素基因相关肽(calcitonin gene-related peptide, CGRP)是由37个氨基酸残基组成的感觉神经肽,包括α和β两种亚型[5]。文献表明,在内皮素转化酶-1基因敲除小鼠中,CGRP通过cAMP信号通路抑制博莱霉素诱导的肺纤维化[6]。最新文献报道,eIF3a参与了TGF-β1诱导的肺泡EMT[7],但具体的机制不明。研究发现,CGRP通过抑制eIF3a的表达进而调控博莱霉素诱导的肺纤维化[8,9]。而CGRP是否通过影响TGF-β1激活的Notch信号通路、进而抑制eIF3a的表达从而抑制肺泡EMT的进程,未见文献报道。本研究拟在培养的肺泡上皮Ⅱ型细胞上,观察CGRP抑制肺泡EMT的作用及机制,旨在为肺纤维化发病机制研究提供新的理论依据,并为寻找抗肺纤维化药物提供新的思路。
1 材料与方法
1.1 材料
大鼠肺泡上皮Ⅱ型细胞(RLE-6TN细胞)购于北京北纳创联生物技术研究院。Dulbecco's Modified Eagle Medium(DMEM)高糖培养基、胎牛血清(fetal bovine serum, FBS)购于美国Hyclone公司。TGF-β1购于美国RD公司。噻唑蓝(MTT)、二甲基亚砜(DMSO)、CGRP、CGRP8-37购于美国 Sigma公司。Masson染色试剂盒购于北京索莱宝科技有限公司。抗Notch1、α-SMA、E-cadherin 及collagen Ⅲ抗体均购于英国Abcam公司;抗eIF3a、GAPDH抗体分别购于美国Cell Signaling和Santa Cruz公司。LunimataTM Crescendo发光液购于美国Millipore公司。反转录试剂盒(货号:RR037Q)和荧光定量PCR试剂盒(货号:RR430A)及引物设计合成均购于北京宝日医生物技术有限公司。
1.2 方法
1.2.1 RLE-6TN培养及实验分组 将RLE-6TN细胞置于含10% FBS的DMEM高糖培养基中,在5% CO2、37℃培养箱中传代培养,3~6代细胞用于实验。待细胞生长至70%~80%密度时,用0.25%胰蛋白酶液消化,按1∶3传代。根据文献及前期的研究基础[5,8],实验设Control组、TGF-β1(5 ng/ml)、CGRP (1、10、100 nmol/L)组、CGRP8-37 (1 μmol/L)+CGRP 100 (nmol/L)组。每组设9个复孔。Control组细胞用灭菌双蒸水处理48 h,其余各组细胞分别用CGRP和(或)CGRP8-37预处理1 h,再用TGF-β1处理48 h。
1.2.2 MTT 法测定细胞活性 计数细胞后接种于96 孔板(5 000 cells/well),每组设6个复孔。在细胞培养液中加入相应药物处理48 h后,每孔加入MTT 15 μl,继续培养4 h。弃上清后,加入DMSO 150 μl, 避光溶解10 min,用Infinite M200 Pro多功能酶标仪测定490 nm波长处的吸光度 (A490nm)值。根据公式[(对照组A490nm值-实验组A490nm值) /对照组A490nm值]×100%,计算细胞抑制率。
1.2.3 实时荧光定量PCR检测eIF3a、Notch1 、E-cadherin、α-SMA和collagen Ⅲ mRNA的水平 用Trizol、氯仿、异丙醇等试剂提取细胞总RNA后,测定RNA浓度后将总RNA逆转录为cDNA。按照荧光定量PCR试剂盒说明书,用2 μl cDNA为模板,以GAPDH为内参照,PCR扩增基因片段。PCR 反应条件参照我们前期研究方法[8,9]。用7 500 System SDS Software分析数据,统计ΔΔCt 值,计算RQ值以比较各组mRNA的表达。引物如下(表1)。

Tab. 1 Sequences of primers for qPCR
1.2.4 蛋白质印迹法检测eIF3a、Notch1、E-cadherin、α-SMA和collagen Ⅲ蛋白表达 低温下提取蛋白质,二喹啉甲酸(BCA)法测定蛋白质浓度。每组取50 μg蛋白质,蛋白质变性后于12%SDS-PAGE分离样品,然后转至PVDF 膜上,5%BSA封闭1 h,分别滴加抗Notch1、eIF3a、α-SMA、E-cadherin 及collagen Ⅲ一抗,以GAPDH为内参,4℃过夜。洗膜3次,每次5 min,加入相应二抗37℃孵育1 h。洗膜3次后加入发光液,Bio-Rad ChemiDoc XRS+凝胶成像系统进行拍照用,Image J 1.43图像分析软件分析条带的灰度值,以目的条带的灰度值与内参的灰度值比值的表示蛋白质相对表达水平,分析并比较各组蛋白质表达差异。
1.3 统计分析

2 结果
2.1 CGRP对TGF-β1诱导的RLE-6TN细胞活力抑制作用及collagen III mRNA和蛋白质表达的影响
与control组相比,TGF-β1处理组细胞活力明显减低、而collagen III mRNA和蛋白表达水平明显升高(P<0.01)。与TGF-β1处理组相比,不同剂量CGRP组细胞活力明显升高、而collagen III mRNA和蛋白表达水平均不同程度降低(P<0.05,P<0.01),但CGRP的这些作用均可被其抑制剂CGRP8-37所取消(P<0.01,表2,图1)。
2.2 CGRP对TGF-β1诱导的RLE-6TN细胞α-SMA和E-cadherin表达的影响
与control组相比,TGF-β1处理组肺泡上皮细胞E-cadherin mRNA和蛋白质表达水平明显降低,而α-SMA mRNA和蛋白质表达水平明显升高(P<0.01)。与TGF-β1处理组相比,不同剂量CGRP组E-cadherin mRNA和蛋白质表达水平均明显升高而α-SMA mRNA和蛋白质表达水平均明显减低(P<0.05或P<0.01),但CGRP的这些作用均可被其抑制剂CGRP8-37所消除(表3,图2,图3)。这些结果提示,CGRP对肺泡上皮细胞间质转分化具有一定的抑制作用。
2.3 CGRP对TGF-β1诱导的RLE-6TN细胞Notch1和eIF3a表达的影响
与control组相比,TGF-β1组Notch1、eIF3a mRNA和蛋白质表达水平明显升高(P<0.01)。与TGF-β1组相比,不同剂量CGRP组Notch1、eIF3a mRNA和蛋白质表达水平均不同程度降低(P<0.05,P<0.01),但CGRP的这些作用均可被其抑制剂CGRP8-37所消除(表4,图4、图5)。
3 讨论
肺纤维化(PF)的发病机制错综复杂,放射性因素、粉尘以及药物(如百草枯和博莱霉素等)毒副作用等是PF的主要诱发因素[10]。其典型特征是肺组织内大量肌成纤维细胞聚集,细胞外基质(extracellular matrix, ECM)沉积并伴有炎细胞浸润和损伤。肌成纤维细胞(myofibroblasts, MFb)的过量增殖是造成ECM聚集的主要原因[11]。PF的本质是肺组织修复过程紊乱所致,其基本过程为:诱发因素导致肺泡上皮细胞间的紧密连接消失,表型蛋白(如上皮细胞钙粘蛋白(E-cadherin)和紧密连接蛋白-1)表达降低,而波形蛋白、纤维连接蛋白和α-平滑肌肌动蛋白(α-SMA)表达升高,且肌动蛋白重构,肺泡原有基底膜破坏,进而导致肺泡上皮出现上皮-间质转换(epithelial-mesenchymal transition, EMT),最终导致肺泡上皮细胞出现迁移、侵袭等肌成纤维细胞(MFb)具有的生物学功能和形态学特征[12]。与成纤维细胞显著不同的是,MFb具有合成和分泌、收缩以及产生多种细胞因子的特点[13]。此外,MFb还可以增加ECM的合成,导致其在肺间质过度沉积,从而形成PF。由此可见,探讨PF发生发展过程中EMT发生的分子机制,并以此为抑制靶点,抑制MFb的聚集,有望缓解或逆转PF的发生发展,从而改善PF患者的肺功能,提高其生存质量。
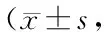
Tab. 2 Effects of CGRP on cell vitality and the expression of collagen III in cultured RLE-6TN cells treated by TGF-β1 n=9)
CGRP: Calcitonin gene-related peptide; CGRP8-37: CGRP receptor inhibitor
**P<0.01vscontrol group;#P<0.05,##P<0.01vsTGF-β1 group;△△P<0.01vsCGRP (100 nmol/L) group

Tab. 3 Effects of CGRP on the expressions of α-SMA and E-cadherin induced by TGF-β1 in cultured RLE-6TN n=9)
CGRP: Calcitonin gene-related peptide; CGRP8-37: CGRP receptor inhibitor; TGF-β1: Transforming growth factor-β1
**P<0.01vscontrol group;#P<0.05,##P<0.01vsTGF-β1 group;△△P<0.01vsCGRP (100 nmol/L) group
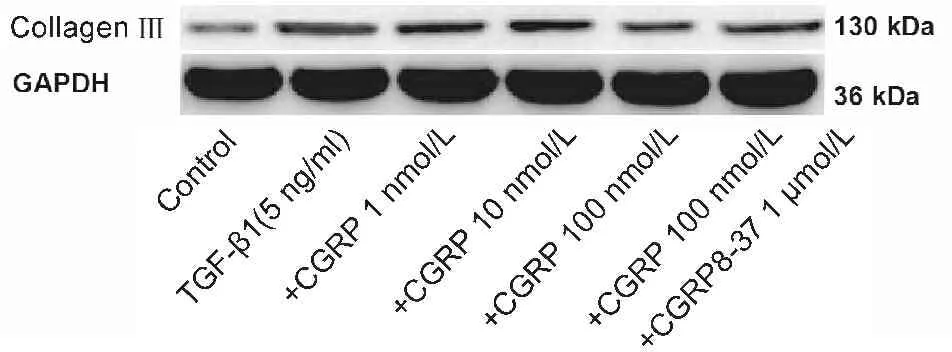
Fig.1Effects of CGRP on the expression of collagen III induced by TGF-β1 in cultured RLE-6TN cells

Fig.2Effects of CGRP on the expression of α-SMA induced by TGF-β1 in cultured RLE-6TN cells

Tab. 4 Effects of CGRP on the expressions of Notch1 and eIF3a induced by TGF-β1 in cultured RLE-6TN cells n=9)
CGRP: Calcitonin gene-related peptide; CGRP8-37: CGRP receptor inhibitor
**P<0.01vscontrol group;#P<0.05,##P<0.01vsTGF-β1 group;△△P<0.01vsCGRP (100 nmol/L)group

Fig.3Effects of CGRP on the expression of E-cadherin induced by TGF-β1 in cultured RLE-6TN cells

Fig.4Effects of CGRP on the expression of Notch1 induced by TGF-β1 in cultured RLE-6TN cells

Fig.5Effects of CGRP on the expression of eIF3a induced by TGF-β1 in cultured RLE-6TN cells
CGRP是一种生物活性多肽,由37个氨基酸残基组成,是辣椒素敏感感觉神经的主要递质,广泛分布于中枢和外周神经系统及心血管及肺血管床内[14]。最新的文献表明,在内皮素转化酶-1基因敲除小鼠中,CGRP通过cAMP信号通路抑制博莱霉素诱导的肺纤维化[6]。我们前期研究发现,在博莱霉素诱导大鼠肺纤维化模型中,肺组织CGRP的表达水平明显降低,而用辣椒素(capsaicin)耗竭内源性CGRR后能够明显加重博莱霉素诱导的大鼠肺纤维化[8,9]。而CGRP是否参与了肺纤维化肺泡EMT的进程,未见文献报道。本研究发现,外源性CGRP能够明显抑制TGF-β1诱导的肺泡上皮细胞α-SMA的表达、显著抑制E-cadherin下调。这些结果表明,CGRR参与了肺泡EMT进程,外源性CGRP能够抑制肺泡EMT,进而减轻肺纤维化的发生与发展。
eIF3为真核细胞翻译起始因子(eukaryotic initiation factor, eIF) 家族成员,由13 个亚单位组成。eIF3a是eIF3中最大的亚基,分子量为170 kDa[15]。最新的文献报道,eIF3a参与了TGF-β1诱导的肺泡EMT[7]。前期研究发现,eIF3a参与了肺纤维化成纤维细胞的增殖活化,而CGRP通过抑制eIF3a的表达而抑制肺成纤维细胞的增殖,进而抑制肺纤维化[8-9]。研究发现,TGF-β1可以激活Notch信号转导通路,进而诱导肺成纤维细胞向肌成纤维细胞的转化,是肺纤维化的关键信号通路之一[3,16]。当使用Notch抑制剂DAPT后,可以阻止肺成纤维细胞向肌成纤维细胞的转化,降低了Notch1和α-SMA mRNA及蛋白质的表达,从而抑制肺纤维化的发生与发展[4]。本研究发现外源性CGRP能够明显抑制TGF-β1诱导的肺泡上皮细胞Notch1和eIF3a的表达。
综上所述,TGF-β1诱导的肺泡EMT可能是肺纤维化发病的机制之一。大量研究表明,阻断TGF-β1信号传导通路可起到抑制或治疗肺纤维化的作用,而我们发现CGRP对TGF-β1诱导肺泡上皮细胞间质转分化同样具有一定的抑制作用,其机制可能与其抑制Notch1、eIF3a表达有关。本研究为肺纤维化发病机制提供新的实验依据、为寻找新型抗纤维化药物提供了新的思路。

