Myostatin信号通路在4周离心耐力运动改善2型糖尿病大鼠骨骼肌萎缩中的作用*
王 继, 周 越, 张 荷, 李文博, 黄 怡
(北京体育大学 运动人体科学学院, 北京 100084)
研究发现,在多种肌肉萎缩性疾病中,如恶病质、长期糖皮质激素治疗和2型糖尿病等引起的肌萎缩,均伴有骨骼肌中肌肉生长抑素(myostatin)及相关蛋白表达上调[1]。Myostatin又称生长分化因子8(growth differentiation factor 8,GDF-8),属于转化生长因子β(transforming growth factor β,TGF-β)超家族成员,是骨骼肌的强有力的负调控因子。Myostatin主要通过Smads ( mothers against decapentaplegic homologs)家族介导其下游的信号转导。磷酸化的Smad2/3可与Smad4形成复合物而被转运到细胞核内,通过与DNA及其他核因子相互作用激活肌萎缩蛋白基因的表达。肌萎缩盒F蛋白(muscle atrophy F-boX,MAFbx/atrogin-1)是肌肉特异性泛素E3连接酶,在肌萎缩中表达并导致结构蛋白和收缩蛋白降解、肌肉体积和质量减小[2]。
体育运动能改善肌萎缩,但不同肌肉收缩形式不同,导致肌肉肥大的效应不同,这似乎与蛋白质分解系统的相关性更大[3]。研究发现[4],与向心运动相比,12周中等强度离心运动后,atrogin-1及其调节蛋白FOXO3A 的mRNA表达水平显著降低,提示离心运动可能有更好的肌萎缩抑制效应。但尚未见离心运动对2型糖尿病肌萎缩影响的报道。
本研究通过9周高脂饮食联合STZ注射建立2型糖尿病大鼠模型,观察4周离心耐力运动对2型糖尿病大鼠骨骼肌萎缩的影响及myostatin/Smad/atrogin-1信号通路在此过程中的作用。本研究旨在为离心耐力运动改善2型糖尿病肌萎缩进而改善糖代谢紊乱提供理论依据。
1 材料与方法
1.1 主要实验试剂及器材
Mercodia大鼠胰岛素酶联免疫(ELISA)试剂盒购自北京优尼康生物科技有限公司(10-1250-01);链脲佐菌素(streptozotocin,STZ)购自Sigma公司(S0130);一抗抗GDF-8/11和抗Smad3抗体购自Santa Cruz Biotechnology公司(sc-398333,sc-101154),Phospho-Smad3 (Ser423/425)购自Cell Signaling Technology公司(C25A9),Anti-Fbx32购自Abcam公司(ab74023);二抗(生物素标记羊抗兔IgG)及免疫组化试剂盒购自北京博奥森生物技术有限公司(SP-0023);其余试剂均为分析纯,购自国药集团化学试剂有限公司。血糖仪购自强生(上海)医疗器材有限公司(稳择易血糖仪),酶标仪及电泳装置均购自Bio-Rad公司。
1.2 实验动物及分组
39只6周龄雄性SD大鼠,购自北京维通利华实验动物技术有限公司(许可证号:SCXK/京2012-0001),体重(214.1±7.7) g。分笼饲养,自由进食、饮水。环境温度20~24℃,相对湿度45%~55%,昼夜12 h~12 h循环照明。
随机抽取15只大鼠组成普通饲料组(normal chow diet,NCD组,n=15),普通饲料饲养9周;其余24只大鼠构成高脂饲料组(high fat diet,HFD组,n=24),给予高脂饲料(北京华阜康生物科技股份有限公司,H10045;能量比:脂肪60%、碳水化合物20%、蛋白质20%)饲养9周。高脂饲料组于饲养9周后间隔3 d注射2次STZ,单次剂量为25 mg/kg bw,普通饲料组腹腔注射相应剂量的枸橼酸钠缓冲液。注射STZ后1周,高脂饲料组大鼠尾静脉采血测定空腹血糖浓度。糖尿病成模标准:空腹血糖浓度≥11.1 mmol/L。剔除造模不成功的大鼠。1周后复查大鼠空腹血糖浓度,标准同上,再次剔除造模不成功大鼠,最终得到2型糖尿病(type 2 diabetic mellitus,T2DM)模型组大鼠20只,建模成功率为83.3%。
将普通饲料组大鼠随机分为2组:对照组(C,n=6)和运动组(E,n=9);将2型糖尿病模型组大鼠随机分为2组:糖尿病对照组(D,n=8)和糖尿病运动组(DE,n=12)。
1.3 运动方案
本研究参照Armstrong离心运动方案[5],参与实验的所有大鼠在正式实验前进行为期3 d的适应性跑台训练:跑速16 m/min。第1天跑台坡度0°,训练时间5 min;第2天跑台坡度-5°,训练时间10 min;第3天跑台坡度-5°,训练时间30 min,第4、5天休息,第6天开始正式训练。
运动方案:坡度-5°,跑速16 m/min,每次训练时间60 min。每周训练5 d,共4周。
1.4 血样采集与测试
1.4.1 血液指标测试 注射STZ后,所有大鼠禁食12 h。然后取尾血,血糖仪测定空腹血糖浓度(fasting blood glucose,FBG);全血4℃静置2 h后,3 000r/min离心10 min取血清,酶联免疫吸附法(ELISA)检测空腹血清胰岛素(fasting serum insulin,FINS)水平,计算胰岛素敏感性。胰岛素抵抗指数(Homa insulin resistance index,HOMA-IR)=FINS(mU/L)×FBG(mmol/l)/22.5;胰岛素敏感性指数(insulin sensitivity index,ISI)=1/FBG(mmol/L)×FINS(mU/L)。
1.4.2 葡萄糖耐量试验 所有糖尿病大鼠腹腔注射葡萄糖作葡萄糖耐量试验(intraperitoneal glucose tolerance test,IPGTT):糖尿病大鼠禁食12 h,首先检测尾静脉空腹血糖,按照2 g/kg体重的剂量腹腔注射50%葡萄糖溶液, 30、60、120 min时分别于尾静脉采血检测血糖。以时间为横坐标,血糖水平为纵坐标作图,计算血糖曲线下面积(area under the curve of blood glucose,AUCBG)。4周运动干预后,取所有大鼠重复上述FINS、FBG和IPGTT测试。
1.5 骨骼肌样本采集与测试
4周运动干预后,大鼠称重。腹腔注射水合氯醛(浓度10 %,0.4 ml/100g bw)麻醉,腹主动脉取血;仔细分离比目鱼肌,切成约0.5 cm×0.3 cm×0.3 cm的块状,放入盛有OCT的方盒中,于液氮预冷的异戊烷中固定,然后用锡纸包裹存放于-80℃冰箱中,以备部分用于切片,部分用于蛋白样品制备。
1.5.1 免疫组化分析 制取比目鱼肌冰冻切片,切片厚8 μm,置4℃预冷的4%多聚甲醛中室温固定10 min,PBS(pH7.4)冲洗3次,每次5 min。甩干后用组化笔画圈,以5%羊血清封闭20 min,甩干后加一抗抗Fbx32(1∶200),放入湿盒内4°C孵育过夜。复温10 min,PBS冲洗3次,每次5 min。甩干后加入二抗(生物素标记羊抗兔IgG,1∶300)室温孵育40 min,PBS冲洗3次,每次5min。显微镜下观察DAB显色3~5 min,待出现棕色沉淀立即用流水冲洗10 min。苏木精复染2 min,盐酸酒精分化后流水冲洗10 min。酒精梯度脱水,二甲苯透明,中性树胶封片,数码体视显微镜拍片。观察肌萎缩蛋白(Atrogin-1)分布情况,分析肌纤维平均横截面积。
1.5.2 Western blot蛋白半定量分析 取比目鱼肌组织块解冻后,称重、剪碎、匀浆,加裂解液(1:10)4℃裂解30 min。离心取上清,BCA法蛋白定量,统一调整蛋白质浓度,加样品缓冲液,煮沸变性蛋白。按10 μl/孔上样,SDS-PAGE分离(电泳90 V,30 min;120 V,60 min),转膜(200 mA,90 min),5% BSA常温封闭2 h。分别加入一抗:抗GAPDH抗体(1∶1 000)、抗肌生成抑制蛋白(myostatin,1∶100)抗体、抗Smad3抗体(1∶200)、抗p-Smad3抗体(1∶1 000)和抗Fbx32抗体(1∶1 000),室温孵育30 min后转4℃过夜。室温下用TBST洗10 min×3次,加入二抗(1∶3 000),室温孵育2 h,TBST洗10 min×3次。均匀涂抹发光液后,将膜置于凝胶成像仪中曝光、拍照,image J分析条带灰度值,以目的蛋白和内参GAPDH灰度值的比值评价蛋白相对表达量。
1.6 统计方法
2 结果
2.1 高脂膳食联合STZ注射对大鼠胰岛素敏感性和糖耐量的影响
9周高脂膳食联合STZ注射后,2型糖尿病模型组大鼠(HFD+STZ)空腹血糖>11.1 mmol/L,明显高于对照组(P<0.01);血清胰岛素水平明显低于对照组(P<0.01),表明9周高脂膳食联合STZ注射成功制备2型糖尿病大鼠模型(表1)。
与普通饲料组相比,2型糖尿病模型组大鼠胰岛素抵抗指数HOMA-IR非常明显下降(P<0.01),胰岛素敏感性指数ISI明显下降(P=0.03),血糖曲线下面积AUCBG明显高于普通饲料组(P<0.01)。腹腔注射葡萄糖后120 min时,普通饲料组大鼠血糖基本恢复至基线水平,但2型糖尿病模型组大鼠血糖仍高于基线水平(图1)。

Fig.1Effects of high fat diet combined with STZ injection on glucose tolerance in rats
NCD: Normal chow diet; T2DM: Type 2 diabetic mellitus

Tab. 1 Comparison of sensitivity and glucose tolerance index between two groups after STZ
FINS: Fasting serum insulin; FBG: Fasting blood glucose; HOMA-IR: Homa insulin resistance index; ISI: Insulin sensitivity index; AUCBG: Area under the curve of blood glucose; NCD: Normal chow diet; T2DM: Type 2 diabetic mellitus
*P<0.05,**P<0.01vsNCD group
2.2 4周离心运动对2型糖尿病大鼠胰岛素敏感性和糖耐量的影响
4周离心运动后,与C组相比,E组FINS、HOMA-IR显著降低(P<0.01,P=0.01),FBG有降低趋势(P=0.21),ISI非常明显地升高(P<0.01),AUCBG无显著变化(P=0.39);与D组相比,DE组HOMA-IR和AUCBG显著降低(P<0.01,P<0.01),FINS和FBG有降低趋势,ISI有升高趋势,但均无统计学差异(P=0.17,P=0.12,P=0.23,表2 ,图2)。

Tab. 2 Results of insulin sensitivity and glucose tolerance in each group after 4 weeks of eccentric
FINS: Fasting serum insulin; FBG: Fasting blood glucose; HOMA-IR: Homa insulin resistance index; ISI: Insulin sensitivity index; AUCBG: Area under the curve of blood glucose; C: Control group; E: Exercise group; D: Diabetic group; DE: Diabetic+exercise group
*P<0.05,**P<0.01vsC group;#P<0.05,##P<0.01vsD group
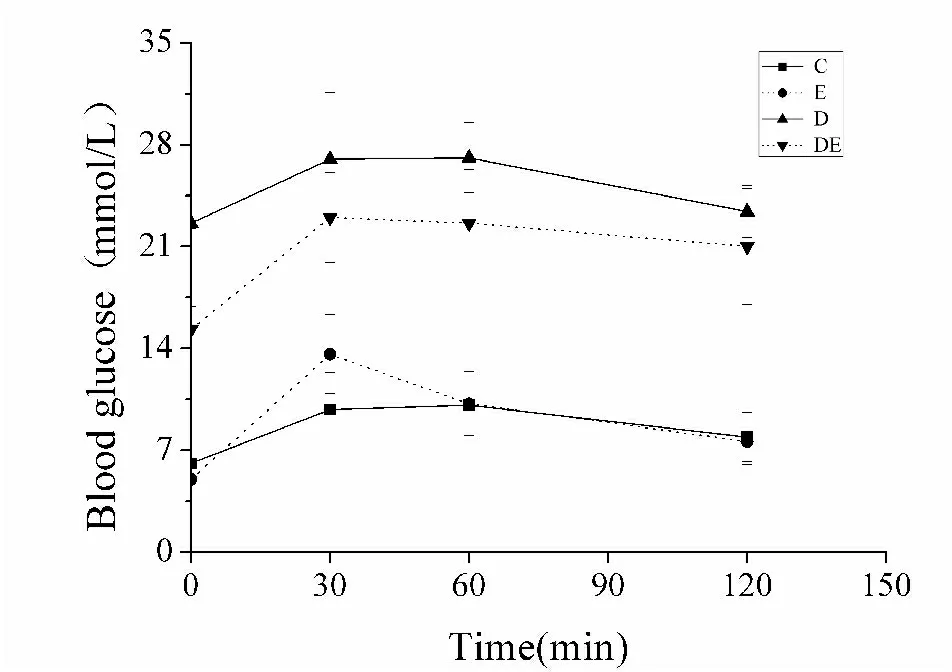
Fig.2Comparison of AUCBG among groups after 4 weeks of eccentric exercise
C: Control group; E: Exercise group; D: Diabetic group; DE: Diabetic+exercise group
2.3 4周离心运动对大鼠体重、比目鱼肌相对重量和肌纤维横截面积的影响
实验4周后,与C组相比,D组体重、比目鱼肌质量/胫骨长和肌纤维横截面积(cross-sectional area,CSA)非常明显下降(P<0.01)。4周离心运动后,与C组相比,E组体重非常显著下降,肌纤维横截面积显著增加(P<0.01),比目鱼肌质量/胫骨长无明显变化(P=0.41);与D组相比,DE组体重无明显变化(P=0.22),比目鱼肌质量/胫骨长呈现上升趋势(P=0.09),肌纤维横截面积显著升高(P=0.03,表3)。
2.4 4周离心运动对大鼠比目鱼肌atrogin-1的影响
4周离心运动后,免疫组化观察肌萎缩情况。如图3所示,C组和E组大鼠比目鱼肌中atrogin-1表达较弱,C组偶见胞浆中有黄褐色沉淀(箭头处),E组黄褐色颗粒呈散在颗粒状分布。D组大鼠比目鱼肌中atrogin-1表达明显高于C组和E组,表现为广泛、大面积黄褐色沉淀;DE组胞浆中黄褐色沉淀呈散在斑块状分布,但颜色较D组略浅(图3,见彩图页Ⅳ)。


GroupnBody weight(g)Soleus mass/tibia length(g/m)CSA(μm2)C6636.5±49.96.74±0.744032.8±415.7E9546.4±33.1**6.43±0.634762.9±509.9**D8462.7±57.6**5.21±0.14**3288.7±309.1**DE12448.7±30.15.90±0.883836.8±559.8#
C: Control group; E: Exercise group; D: Diabetic group; DE: Diabetic+exercise group; CSA: Cross-sectional area of muscle fiber
**P<0.01vsC group;#P<0.05vsD group
2.5 4周离心运动对大鼠比目鱼肌myostatin/Smad3/atrogin-1信号通路的影响
Western blot结果显示:与C组相比,D组大鼠比目鱼肌myostatin、Smad3、p-Smad3和atrogin-1表达升高非常明显(P<0.01)。4周离心运动后,与C组相比,E组大鼠比目鱼肌myostatin、p-Smad3和atrogin-1蛋白表达显著降低(P<0.01,P<0.01,P=0.02),Smad3表达无明显差异(P=0.55);与D组相比,DE组大鼠比目鱼肌myostatin、p-Smad3和atrogin-1蛋白表达显著降低(P=0.03,P<0.01,P=0.02),Smad3表达无明显差异(P=0.27,图4)。
3 讨论
3.1 4周离心运动改善2型糖尿病大鼠糖代谢障碍
2型糖尿病与肥胖、胰岛素抵抗、胰岛β细胞功能和数量缺陷密切相关。这些代谢紊乱严重影响胰岛素对葡萄糖、脂肪和蛋白代谢的调节作用,最终促使2型糖尿病的发生与发展。符合2型糖尿病特征的动物模型是探寻控制和治疗2型糖尿病的重要工具,其中包括遗传性自发性糖尿病模型和实验性非自发性糖尿病模型。高脂饮食联合链脲佐菌素(STZ)注射构建的2型糖尿病模型是最常见的非自发性糖尿病模型。本研究通过9周高脂饲料饲养联合STZ注射构建2型糖尿病模型。与对照组相比,模型组大鼠血糖浓度非常显著升高,血清胰岛素含量显著降低,稳态模式胰岛素抵抗指数(HOMA-IR)非常显著降低,胰岛素敏感性指数(ISI)显著降低;腹腔注射糖耐量实验(IPGTT)发现,模型组大鼠血糖曲线下面积(AUCBG)非常显著高于对照组,提示模型组大鼠存在严重的葡萄糖利用障碍。

Fig.2Expression of myostatin/Smad3/atrogin-1 signaling pathway protein in soleus muscle of each group after 4 week experiment
C: Control group; E: Exercise group; D: Diabetic group; DE: Diabetic+exercise group
*P<0.05,**P<0.01vsC group;#P<0.05,##P<0.01vsD group
在2型糖尿病不同类型的运动疗法中,以有氧运动疗法种类最多,操作也较方便。有氧运动(健步走、游泳、太极拳等)能在不同程度上改善2型糖尿病的糖、脂代谢障碍及相关并发症[6,7]。但在针对2型糖尿病人群的运动处方中,仍强调多种运动方式相结合的重要性[8]。不习惯的离心收缩诱导损伤进而降低骨骼肌中葡萄糖转运蛋白4(glucose transporter 4, GLUT4)的水平,是导致一过性胰岛素抵抗的重要原因[9,10];但规律的离心耐力运动却能对增强葡萄糖耐量产生积极作用[11]。本研究显示,4周离心耐力运动虽然对2型糖尿病大鼠血清胰岛素无明显影响,但能在一定程度上降低空腹血糖,最终降低HOMA-IR和AUCBG、升高ISI。这可能与离心耐力运动提高骨骼肌质量有关。Robin[12]研究发现,与单纯有氧运动相比,有氧联合离心运动能明显改善2型糖尿病患者身体质量指数,提高大腿肌肉质量,这将直接提高患者基础代谢率和运动表现,对改善2型糖尿病、提高患者生活质量至关重要。
3.2 4周离心运动对2型糖尿病肌萎缩的改善作用
研究发现,与无糖尿病老年人相比,老年糖尿病患者肌肉质量每年约降低26%,肌肉力量约降低33%[13]。骨骼肌负责全身约80%葡萄糖的摄取,其质量下降将导致骨骼肌容量降低、胰岛素敏感性下降,外周组织处理血糖的能力随之减弱,进一步加快了2型糖尿病的进展。本研究显示,2型糖尿病大鼠比目鱼肌质量/胫骨长比值显著低于正常大鼠,肌纤维平均横截面积(CSA)显著降低,表明2型糖尿病大鼠骨骼肌明显萎缩。而4周离心耐力运动能显著提高骨骼肌平均CSA,改善2型糖尿病导致的骨骼肌萎缩。
离心运动可作用于肌细胞膜和细胞外基质,使其受到较大刺激进而产生适应性肌肉肥大,在改善肌萎缩方面有重要作用[14,15]。规律的中等强度运动导致骨骼肌中GLUT4含量和活性增加是运动降低胰岛素抵抗,改善2型糖尿病糖、脂代谢障碍的重要原因[16]。其中骨骼肌容量增加是GLUT4含量增加的重要原因。Stefanetti[4]研究发现,与向心运动相比,12周中等强度离心运动后,atrogin-1及其调节蛋白FOXO3A 的mRNA表达水平显著降低,提示离心运动增加骨骼肌容量、抑制肌萎缩效应可能与蛋白分解系统有关。
3.3 Myostatin信号通路在肌萎缩改善中的作用
进一步研究发现,2型糖尿病导致肌萎缩的分子机制可能与myostatin及其下游信号蛋白激活有关。骨骼肌能以自分泌/旁分泌的形式产生myostatin,成熟的myostatin二聚体-C端主要通过结合到Ⅱ型受体ActRⅡB和ActRⅡA ( ActRⅡB比ActRⅡA更容易结合)上,Ⅱ型受体活化后可磷酸化激活Ⅰ型受体(ALK4和ALK5),进而使Smads( mothers against decapentaplegic homologs) 磷酸化。Smad3处于myostatin下游,磷酸化的Smad3可与Smad4形成复合物而转运到细胞核内,通过与DNA及其他核因子相互作用激活肌萎缩蛋白基因的表达。肌肉环状指蛋白1(muscle rING finger 1,MuRF1)和atrogin-1是两个肌肉特异性泛素蛋白E3连接酶,参与底物识别并与靶蛋白序列特异性结合或降解决定子,从而调节靶蛋白的降解序列与速率。
在健康的肌肉中,受损或未折叠蛋白质的分解是维持细胞内稳态的关键因素。在2型糖尿病的发展过程中,蛋白质分解途径的持续激活增高收缩蛋白的降解率,导致蛋白质净损失增多,最终加剧肌萎缩[17]。本研究显示,2型糖尿病大鼠比目鱼肌中myostatin、Smad3、p-Smad3和atrogin-1蛋白表达水平均显著高于对照组大鼠,而4周离心耐力运动能降低正常大鼠和2型糖尿病大鼠比目鱼肌中myostatin、p-Smad3和atrogin-1的水平。
有报道[18],pSmad2/3上调与MuRF1的表达相互独立,但与atrogin-1的表达成正相关,提示atrogin-1可作为myostatin/Smad下游重要的基因表达产物参与肌萎缩调控。此外,atrogin-1还可作用于真核生物翻译起始因子3亚基F(eukaryotic translation initiation factor 3 subunit F,eIF3-f)、MyoD和myogenin等,降低其活性,从而抑制骨骼肌纤维合成与再生[19]。在本研究中,运动能诱导myostatin及其下游蛋白表达下降,但2型糖尿病运动组大鼠myostatin、p-Smad3和atrogin-1表达仍远高于对照组大鼠,提示4周离心运动虽能抑制2型糖尿病大鼠肌萎缩相关蛋白表达,但尚不能使其恢复到正常大鼠水平。单纯离心耐力运动干预能在一定程度上抑制2型糖尿病伴随的肌萎缩,进而控制2型糖尿病进程,而myostatin信号通路抑制剂或许能成为改善2型糖尿病患者骨骼肌萎缩进而改善及其代谢障碍的重要靶点。
综上所述,本研究通过高脂膳食联合STZ注射成功建立2型糖尿病大鼠模型。模型组大鼠胰岛素敏感性下降,葡萄糖利用严重障碍,同时伴有明显的骨骼肌萎缩。其中myostatin/Smad3/atrogin-1信号通路上调是导致2型糖尿病肌萎缩的重要原因;而4周离心耐力运动可下调myostatin、p-Smad3和atrogin-1表达,这可能是离心耐力运动抑制肌萎缩,提高骨骼肌容量,进而改善2型糖尿病代谢障碍、提高胰岛素敏感性的重要机制之一。

