丙泊酚与七氟醚对胃癌根治术患者免疫功能的影响对比*
蔚海霞 ,史文文 ,闫怀军 ,李春岩 ,单佩佩
目前,胃癌的治疗主要有手术治疗、化学治疗(简称化疗)、放射治疗、分子靶向治疗等,其中针对早、中期胃癌最有效的治疗是内镜下的手术根治[1]。但手术治疗伴随的机体过度应激会引起免疫功能变化,为肿瘤复发及转移提供了可能[2]。因此,尽可能减少引起机体免疫功能降低的因素对于胃癌根治术术后恢复至关重要。部分全身麻醉(简称全麻)药物的应用也会对患者的免疫功能产生直接影响,从而间接影响术后恢复[3]。丙泊酚和七氟醚是临床常用全麻药物,广泛用于胃癌根治术。本研究中比较了两者对胃癌根治术患者免疫功能的影响,现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:符合《胃癌诊断标准(2010 年版)》[4];年龄35~75岁;发病至入院时间为6个月至3年;本研究经医院医学伦理委员会批准,患者签署知情同意书。
排除标准:肝肾功能、电解质检查异常;合并其他严重心血管系统疾病;合并其他严重感染和并发症或精神疾病;胃癌根治术禁忌证。
病例选择与分组:选取青岛市城阳区人民医院肿瘤科2014年1月至2017年1月收治的择期行胃癌根治术的原发性胃癌患者96例,按就诊顺序随机分为对照组和观察组,各48例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。

表1 两组患者一般资料比较(n=48)
1.2 方法
两组患者术前均给予常规访视,监测心电图(ECG)、有创血压(IBP)、血氧饱和度(SpO2)、中心静脉压(CVP)及肛温变化,手术开始后先建立静脉通路,采用注射用顺苯磺阿曲库铵(浙江仙琚制药股份有限公司,国药准字 H20090202,规格为每支 5 mg)0.15 mg/kg 及枸橼酸舒芬太尼注射液(宜昌人福药业有限责任公司,国药准字 H20054256,规格为每支 5 mL ∶250 μg)1 ~2 mg/kg进行麻醉前诱导。行气管插管并行机械通气,维持呼吸频率为 10~12次/分、潮气量8~10 mL/kg,术中间断静脉注射舒芬太尼注射液 0.4~0.6 μg/kg维持麻醉。对照组患者予8%七氟醚(日本丸石制药株式会社,国药准字H20090714,规格为每瓶250 mL)、新鲜气体流量5 L/min吸入麻醉前诱导,2% ~3%七氟醚吸入维持麻醉,维持最小肺泡内浓度为0.8~1.2。观察组患者予丙泊酚注射液(西安力邦制药有限公司,国药准字H20123318,规格为每支 50 mL ∶1.0 g)2.0 ~ 4.0 mg/kg静脉注射麻醉前诱导,4.0 ~ 6.0 mg/(kg·h)丙泊酚静脉维持麻醉。所有患者术中均监测麻醉深度指数(CSI),通过调节丙泊酚输入速度及七氟醚吸入浓度使脑电双频指数(BIS)维持为50~60。手术结束前0.5 h停用注射用顺苯磺阿曲库铵和舒芬太尼,手术结束后开始缝合时停用七氟醚及丙泊酚,静脉注射地佐辛注射液(扬子江药业集团有限公司,国药准字H20080329,规格为每支1 mL∶5 mg)5~8 mL行替代性镇痛。
1.3 观察指标
所有患者于麻醉前 30 min(T0)、麻醉后 1 h(T1)、麻醉后 3 h(T2)、术后即刻(T3)、术后 24 h(T4)、术后 72 h(T5)时采静脉血8 mL,利用高速低温离心机以3 000 r/min速率离心并分离血清,采用美国FACSCalibur流式细胞仪测定两组患者各时间点外周血CD4+及CD8+T细胞浓度;采用酶联免疫吸附(ELISA)法测定T0及T5时白细胞介素 2(IL-2)、肿瘤坏死因子 -α(TNF-α)、C 反应蛋白(CRP)等血清学相关因子。操作步骤严格按说明书进行。记录两组术后不良反应发生情况。
1.4 统计学处理
采用SPSS 19.0统计软件处理。计量资料以均数±标准差(X±s)表示,采用独立样本 t检验;计数资料行χ2检验。P<0.05为差异有统计学意义。
2 结果
结果见表2和表3。术后对照组发生恶心呕吐1例、头痛 2 例、胀气 3 例,发生率为 12.50%(6 /48);观察组恶心呕吐、头痛各2例,胀气1例,发生率为10.42%(5 /48),两组不良反应发生率无明显差异(χ2= 0.297,P = 0.748)。
3 讨论
以手术及化疗为主的多学科综合治疗模式是目前胃癌的主要治疗手段[5]。在影响胃癌根治术治疗后复发的众多因素中,免疫功能降低是其重要原因之一[6],如何提高胃癌根治术患者术后免疫功能是影响胃癌根治术结局的重要研究课题。不同麻醉方式及麻醉药品使用均可减少肿瘤患者手术引起的应激反应,且麻醉药品本身可影响患者的免疫功能,尤其对患者淋巴细胞免疫功能产生重要影响[7]。
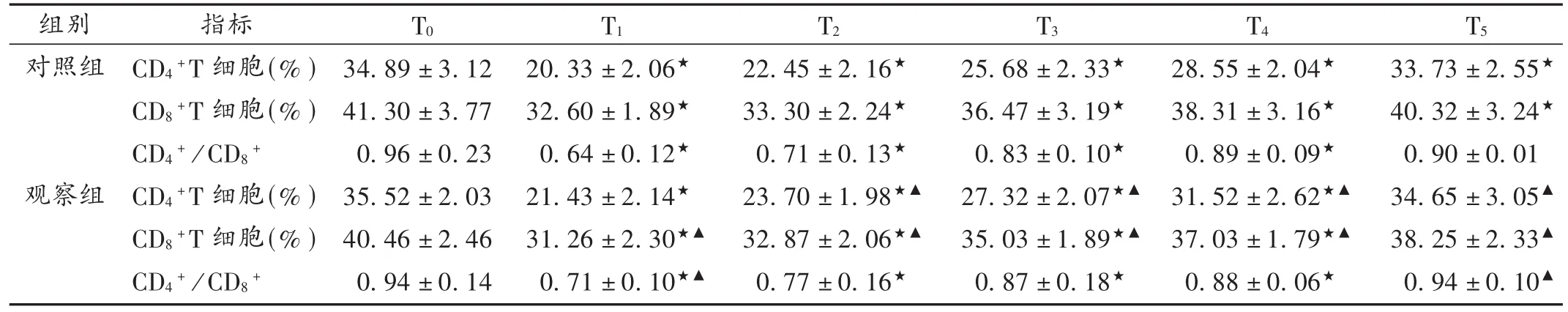
表2 两组患者外周血中CD4+,CD8+T细胞浓度术前及术后各检测时间比较(X ± s,n=48)
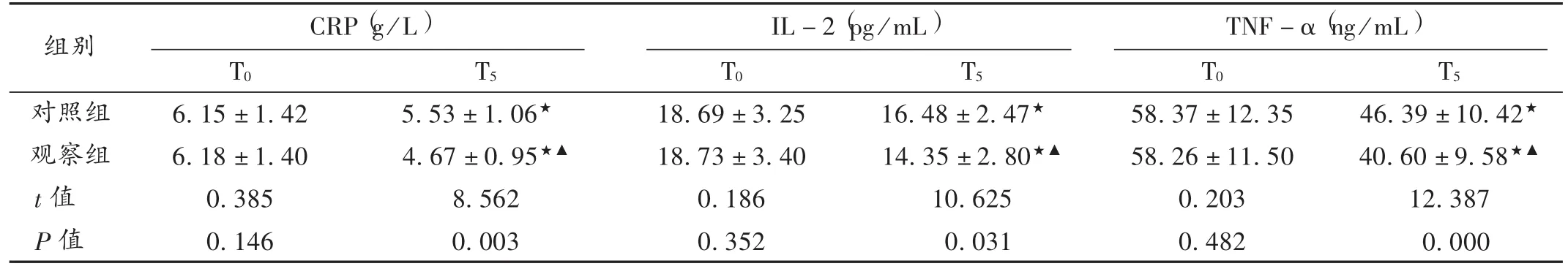
表3 两组患者CRP,IL-2,TNF-α 水平比较(X ± s,n=48)
T淋巴细胞根据其表面分子特征及抗原类型可分为杀伤性 T 细胞(Tc)、诱导辅助性 T 细胞(Ti/Th)、抑制性 T 细胞(Ts)及迟发型超敏反应 T 细胞[8]。而 CD4和CD8分别是 Ti/Th,Ts细胞的表面标志物。CD4+T 细胞是在胸腺内发育成熟的抑制自身免疫和移植排异反应的细胞群,占T细胞总数的5%~10%,在免疫调节过程中发挥重要作用[9]。同时,CD4+T 细胞能通过抑制Th1细胞免疫反应,导致其分泌的干扰素γ(IFN-γ)、IL-2等细胞因子减少,激活巨噬细胞,减轻机体炎性反应,在胃癌病理进程中起重要作用[10]。CD8+T细胞作用与CD4+T细胞相反,能通过自身及分泌的抑制因子在机体免疫反应中起负向调节作用[11],可抑制CD4+T细胞及B淋巴细胞功能,从而抑制抗体的形成,加重胃癌肿瘤细胞的感染。CD4+/CD8+反映了 Ti/Th 细胞和Ts细胞之间的动态平衡关系。
IL-2又称为T细胞生长因子(TCGF),主要由机体内T淋巴细胞产生,促进T淋巴细胞生长、分化,促进自然杀伤细胞、B淋巴细胞增殖,在机体免疫防护中起重要作用[12]。CRP是由肝脏合成的一种急性时相蛋白,是机体发生应激反应、免疫反应、组织损伤及炎性反应过程中的敏感蛋白,对机体免疫功能状态的诊断和预测起着重要作用。丙泊酚是临床常用麻醉药品,可短时间内起效,具有起效迅速、术后苏醒时间短的优势,且术后恢复较好,不良反应少,广泛应用于各种手术麻醉[13]。七氟醚又称七氟烷或七氟异丙甲醚,能平稳、迅速地发挥麻醉功效,常用于术前麻醉诱导和术中麻醉维持,并具有肌肉松弛作用,广泛应用于临床[14]。
本研究结果显示,随着麻醉时间的延长,两组患者外周血CD4+及CD8+T细胞浓度均呈先减后增趋势(P<0.05),提示丙泊酚和七氟醚对术中患者免疫功能均有影响。从T2开始,观察组CD4+T细胞增加较观察组明显;从T1开始,对照组CD8+T细胞增加较观察组明显(P<0.05),提示丙泊酚在术后长时间提升免疫功能方面的作用优于七氟醚,且在术后72 h丙泊酚对CD4+及CD8+T细胞浓度的影响及对两者动态平衡的调节强于七氟醚。由表3可知,两药均可降低术后炎性因子IL-2,CRP,TNF-α水平,而丙泊酚的作用效果优于七氟醚。结果提示,丙泊酚在改善术后炎症状态和增强免疫能力更显著。两组术后不良反应发生率未见差异,可能是因为研究样本量不够,有待进一步研究。
综上所述,与七氟醚相比,丙泊酚静脉麻醉改善胃癌根治术患者免疫功能更明显,并可减轻术后炎性反应,值得推广。

