MicroRNA-3198、microRNA-8084、microRNA-7515和microRNA-3613-3P在卵巢癌中的表达及临床意义
杨 波,刘丽爽,吴小华,梁 军
卵巢癌是女性生殖器官常见的恶性肿瘤之一,是病死率和复发率高而治疗方案选择性很小的实体瘤之一[1]。2012年,全世界约23万女性确诊为卵巢癌,约15万人死于卵巢癌[2]。卵巢癌早期临床症状不明显,多数患者确诊时已是临床晚期。尽管该病的手术及化疗方案很明确,但其5年生存率仍<30%[3]。miRNA是一类长19~24 nt的非编码微小RNA,与靶基因的3' 末端结合,在转录后水平调节基因表达[4]。miRNA参与卵巢癌的很多生物学过程,包括细胞增殖与分化、细胞凋亡、侵袭与转移、复发等。本实验通过检测miRNA-3198、miRNA-7515、miRNA-8084和miRNA-3613-3P在初治卵巢癌原发灶、转移灶、复发卵巢癌和卵巢上皮性良性肿瘤组织中的表达情况,比较各组表达差异,并探讨其差异性表达可能的机制,以期发现miRNA在卵巢癌的发生、侵袭与转移及复发中的作用,为卵巢癌的诊治提供新的方向。现报告如下。
1 材料与方法
1.1材料 无菌条件下收集在解放军白求恩国际和平医院妇产科从2010年10月—2016年11月手术的病理组织,共60例:初治卵巢癌原发灶组织(A组)15例、初治卵巢癌转移灶组织(B组)15例、复发卵巢癌组织(C组)16例和卵巢上皮性良性肿瘤组织(D组)14例。所有组织置于-80℃冰箱冷藏。所有初治卵巢癌患者手术前均未行任何相关手术及辅助治疗。所有复发卵巢癌患者满足二次减灭术适应证。所有组织均有术后病理确诊。A组年龄(41~67)岁,中位年龄55岁;初治卵巢癌的临床分期、病理分型及组织分级见表1。B组与A组为同一组病例,其中转移灶分别为:表面腹膜3例(结肠、直肠、膀胱各1例)、脾组织1例和大网膜组织11例。C组年龄(33~68)岁,中位年龄61岁。第一次和第二次肿瘤细胞减灭术术后病理分型及组织分级见表2。D组年龄为(20~58)岁,中位年龄41岁;黏液性囊腺瘤10例,浆液性囊腺瘤4例。见表1、2。
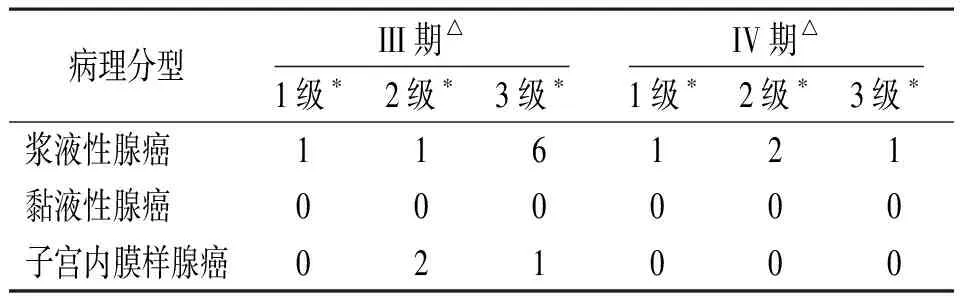
表1 A组初治卵巢癌的临床分期、病理分型及组织分级(例)
注:△为卵巢癌FIGO手术病理分期(2014年);*为组织分级
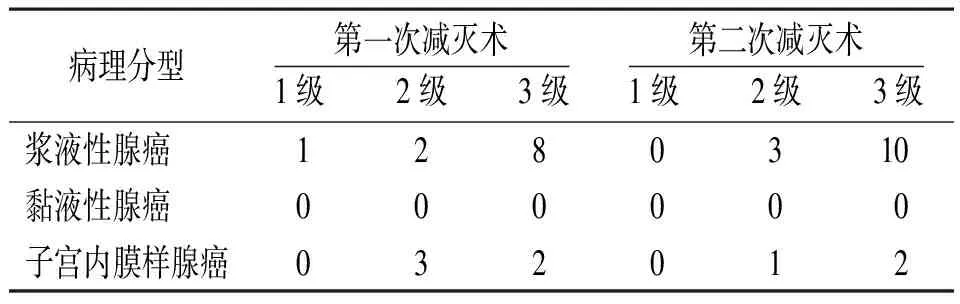
表2 C组复发卵巢癌第一次和第二次肿瘤细胞减灭术术后病理分型及组织分级(例)
1.2实验方法 先设计与合成引物:由Primer Premier 5.0软件设计,生工生物工程(上海)股份有限公司合成。再分别提取4组组织中的miRNA,对miRNA 3' 末端进行加Poly(A)处理及逆转录反应,形成cDNA,最后再进行实时荧光聚合酶链反应(qRT-PCR)检测。
2 结果
2.1miRNA-3198在4组中表达情况的比较 4组中miRNA-3198的表达水平差异有统计学意义(χ2=20.32,P<0.001)。两两比较:B组低于A、C、D组,A、C组低于D组(P<0.05);A组与C组差异无统计学意义(P>0.05)。见图1、表3。
2.2miRNA-7515在4组中表达情况的比较 4组中miRNA-7515的表达水平差异有统计学意义(χ2=19.23,P<0.001)。两两比较:D组miRNA-7515高于A、B、C组(P<0.05);而A、B、C组比较差异无统计学意义(P>0.05)。见图1、表3。
2.3miRNA-8084在4组中表达情况的比较 4组中miRNA-8084的表达水平差异具有统计学意义(χ2=18.70,P<0.001)。两两比较:D组miRNA-8084高于A、B、C组(P<0.05);而A、B、C组比较差异无统计学意义(P>0.05)。见图1、表3。
2.4miRNA-3613-3P在4组中表达情况的比较 4组miRNA-3613-3P的表达水平不全相同,差异具有统计学意义(χ2=17.81,P<0.001)。两两比较:B、C组miRNA-3613-3P低于A、D组(P<0.05);B组与C组、A组与D组比较差异均无统计学差异(P>0.05)。见图1、表3。

表3 四种miRNA在卵巢上皮肿瘤中表达情况的比较
注: A组为初治卵巢癌原发灶,B组为初治卵巢癌转移灶,C组为复发卵巢癌,D组为卵巢上皮性良性肿瘤组织;与A组比较,aP< 0.05;与C组比较,cP< 0.05;与D组比较,eP<0.05
3 讨论
在初治卵巢癌原发灶中miRNA-3198、miRNA-7515和miRNA-8084的表达水平均低于卵巢上皮性良性肿瘤。研究表明,miRNA在肿瘤组织或细胞中低表达,其通过调节靶基因抑制肿瘤细胞增殖。miRNA-217、miRNA-1271高表达分别抑制IGFIR、CCNG1,从而抑制卵巢癌细胞生长;但二者在卵巢癌中均呈低表达[5-6]。miR-302b与miR-498在卵巢癌中均呈低表达,前者高表达下调RUNX1致STAT信号通路失活,使细胞周期停滞在G0/G1期;后者高表达下调cyclin D1从而阻止细胞进入S期,二者均可达到抑制卵巢癌细胞增殖的目的[7-8]。因此,miRNA-3198、miRNA-7515和miRNA-8084可能抑制卵巢癌的发生。
本研究结果显示,在初治卵巢癌原发灶和转移灶中miRNA-3198表达水平均低于卵巢上皮性良性肿瘤,初治卵巢癌转移灶低于原发灶。目前尚无关于miRNA-3198作用机制的报道。miRNA-3198的同族基因miRNA-4309,在发作性睡病患者中高表达,其可能有降调TAC1、PENK、SOCS2和CPT1B的作用[9]。SOCS2作为SOCS家族成员之一,可激活JAK / STAT的反馈回路,负性调节促炎细胞因子[10]。在卵巢癌中,miRNA-572可抑制SOCS1和p21,增加Cyclin D1,缩短G1/G0阶段,加速S期,从而增强SKOV3 和OVCAR3细胞的生长能力,增加克隆代数,促进卵巢癌的发生、发展[11]。既往研究表明,低表达的SOCS1减弱STATs活性,使JAK-STAT信号通路的负性调节受到抑制[12]。因此,miRNA-3198可能是通过增加SOCS1/SOCS2的表达,激活JAK-STAT信号通路,抑制了卵巢癌的发生、发展。
本研究结果显示,在初治卵巢癌原发灶和转移灶中miRNA-7515的表达水平均低于卵巢上皮性良性肿瘤。在肺癌细胞株中,miRNA-7515下调c-Met,一方面减少p-Rb、CDK2、cyclin E等细胞周期相关蛋白;另一方面减少c-Met下游的p-ART、p-Erk1/2,从而抑制肺癌细胞增殖、运动力和迁移能力[13]。c-Met由c-Met原癌基因编码,有多功能跨膜酪氨酸激酶活性,与细胞增殖、运动性和侵袭性有关。在卵巢癌中miRNA-199a-3p低表达,其高表达抑制c-Met磷酸化,减少ERK、AKT,抑制MAPK-PI3K信号通路,从而抑制卵巢癌细胞增殖,减少细胞粘附性和细胞侵袭能力[14]。因此,miRNA-7515可能是通过抑制c-Met的表达,抑制MAPK-PI3K信号通路,从而参与卵巢癌的发生、发展的过程。。
本研究结果显示,初治卵巢癌转移灶中miRNA-3613-3P的表达水平低于初治卵巢癌原发灶和卵巢上皮性良性肿瘤。研究表明,在IgA肾病患者的尿沉渣中miRNA-3613-3P低表达,其高表达抑制Wnt信号通路,从而抑制B淋巴细胞活化,减少免疫球蛋白的分泌[15]。Wnt信号途径引起β-catenin积累,β-catenin可调节基因表达,其异常表达可引起肿瘤的发生、发展。在卵巢癌细胞株中miRNA-939高表达,上调了Cyclin D1,MY和ECF,激活了Wnt/β-catenin信号通路,从而使卵巢癌细胞以悬浮增长的形式进行细胞增殖[16]。在卵巢癌SKOV3细胞株中miRNA-92a高表达,其抑制Wnt拮抗剂DKK1,增加STAT3,激活Wnt/β-catenin信号通路,从而促进卵巢癌细胞球体形成,进而促进卵巢癌细胞转移与耐药[17]。因此,miRNA-3613-3P可能通过抑制Wnt信号通路,减缓了卵巢癌细胞球体形成,减少了癌细胞的转移;而初治卵巢癌原发灶中miRNA-3613-3P的表达水平与卵巢上皮性良性肿瘤比较差异无统计学意义,猜测其可能在卵巢癌发生、发展过程中作用不大。
复发卵巢癌中miRNA-3613-3P的表达水平低于初治卵巢癌原发灶。肿瘤干细胞有高致癌潜能,在肿瘤发生、发展,耐药及复发过程中起重要作用[18]。在卵巢癌的组织细胞中,miRNA-1207均高表达,其抑制SFRP1、AXIN2和ICAT,增加β-catenin,激活Wnt/β-catenin信号通路,从而诱导卵巢癌球体形成,促使卵巢癌细胞向肿瘤干细胞样转化[19]。由此推测,miRNA-3613-3P可能参与卵巢癌细胞向卵巢癌干细胞转化,从而参与卵巢癌的复发。
肿瘤干细胞在常规化疗后可存活,导致肿瘤复发,且耐药性越强侵袭能力越强[20]。在耐卡铂卵巢癌细胞株A2780/CP20中Rad6高表达,其可促进卵巢癌细胞向干细胞样转化,促进卵巢癌细胞耐药和复发[21]。在卵巢癌细胞株A2780S和OV8中,miRNA-214通过抑制p53,正性调节Nanog,从而促进卵巢癌细胞向干细胞样转化,进而促进耐药和复发[22]。本研究结果显示,复发卵巢癌中miRNA-3198的表达水平高于初治卵巢癌转移灶,推测miRNA-3198可能通过参与卵巢癌细胞向干细胞样转化及耐药,从而参与卵巢癌的复发。
本实验研究了初治卵巢癌原发灶、转移灶、复发卵巢癌和卵巢上皮性良性肿瘤组织中miRNA-3198、miRNA-7515、miRNA-8084和miRNA-3613-3P的表达,后期还需采用生物信息学方法预测miRNA的靶基因,探讨miRNA及其靶基因的作用机制,最终在蛋白质水平上验证miRNA的生物学功能。

