不同降温方式下晚采鸭梨PAL基因相对表达与果心褐变的关系
韩艳文,池 明,樊晓岚,赵 航,闫师杰,3,*
(1.天津农学院园艺园林学院,天津 300384;2.天津农学院食品科学与生物工程学院,天津 300384;3.天津市农副产品深加工技术工程中心,天津 300384)
鸭梨(Pyrus bretschneideri Rehd. cv. Yali)是我国特有的古老品种,其产量大、品质好、耐贮藏[1]。鸭梨采摘时间一般为每年的8月20日到9月底,采摘时间持续一个月之久,根据农户采摘经验,9月底采摘的鸭梨已经过了最适采收期,称其为晚采鸭梨。晚采鸭梨成熟度相对较高,果心更容易褐变[2]。目前鸭梨的贮藏方式为冷库(0±1)℃贮藏,贮藏之前一般采用缓慢降温的方式进行降温,防止鸭梨冷害导致的果心褐变[3]。
目前关于鸭梨褐变的机理研究较多,有研究认为鸭梨果心褐变与鸭梨组织内的多种酶类、酚类以及膜脂过氧化等因素有关[4],苯丙氨酸解氨酶(phenylalanine ammonian-lyase,PAL)就是其中的一种酶。PAL是连接初级代谢和苯丙氨酸途径的关键酶,是苯丙氨酸途径的限速酶,也是催化苯丙烷类代谢途径第一步反应的酶[5-6],对果实的生长、机械损伤愈合以及抗寒抗逆性等方面具有重要的作用[7]。目前已经从新鲜莲蓬[8]、鲜切马铃薯[9]、甜樱桃[10]以及桃系新品‘保佳俊’[11]等的研究中得知PAL的活力与果实褐变的发生具有密切的联系。PAL可以促进酚类物质的合成与积累[12-14],再通过多酚氧化酶(polyphenol oxidase,PPO)的作用,发生酶促褐变,导致了果实褐变[15]。通过有效的手段减少酚类物质的合成与积累,在一定程度上可以减少酚类物质与过氧化物酶的反应,从而减少褐变的发生[16-18]。近几年来,对于植物中PAL的研究多集中在基因克隆及表达特性方面,陈卫卫等[19]通过同源克隆得到了PpPAL基因的cDNA序列,并编码蛋白质,得知PpPAL是典型的PAL家族基因,对木质素的合成起着重要的作用。孙润泽等[20]对葡萄的PAL基因家族进行全基因组鉴定并做了表达分析,发现基因家族不同成员的作用不尽相同,其中VviPAL2和VviPAL15的表达与酚类物质的积累密切相关。Irisarri等[21]采用cDNA末端快速扩增技术-聚合酶链式反应(rapid-amplification of cDNA ends-polymerase chain reaction,RACE-PCR)技术分离了杏的2 个PAL基因,分别为ParPAL1和ParPAL2,并做了cDNA全长克隆和氨基酸序列比对,结果显示杏中的PAL基因与其他直系同源的植物同源性较高,其中ParPAL1参与黄酮类化合物的合成。靳祯亮[22]为了研究麦角硫因抑制采后双孢蘑菇酶促褐变的效应与机理,对PAL基因做了相对表达量分析,结果表明麦角硫因抑制了PAL1和PAL2基因的表达,从而抑制了双孢蘑菇的褐变。但是却鲜有关于鸭梨果实PAL基因的研究,目前只有闫洪波等[23]对鸭梨果实PAL基因进行了克隆及表达的分析,在鸭梨中获得了2 个PAL基因,分别命名为PbPAL1和PbPAL2。本实验采用缓慢降温和急速降温的方法处理晚采鸭梨后进行贮藏,通过观察这两种处理的鸭梨在贮藏期间的各项生理指标及PAL活力的变化和PbPAL1和PbPAL2这两种基因的表达特性,来进一步分析PAL基因表达对鸭梨褐变的影响,以期从分子水平找到控制鸭梨果心褐变的方法,从而降低鸭梨果心褐变导致的相关经济损失。
1 材料与方法
1.1 材料与试剂
鸭梨(Pyrus bretschneideri Rehd. cv. Yali)采自河北省深州市,根据当地农户大量采收经验,9月中旬为适时采收期,本实验鸭梨采自2015年9月23日(可溶性固形物质量分数为13.1%,果实硬度为10.36 kg/cm2),为晚采鸭梨。晚采鸭梨果实质量约230 g,无机械伤、无虫害,采后套网套装入内衬保鲜膜(大小85 cm×70 cm、厚度0.05~0.06 mm、孔径15~20 μm,由国家农产品保鲜工程技术研究中心生产)的纸箱中运抵天津农学院冷库。
硼酸 天津市科密欧化学试剂有限公司;硼酸钠 天津市科威有限公司;聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVPP)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、氯仿、异丙醇、乙醇(均为国产分析纯) 国药集团化学试剂有限公司;β-巯基乙醇 北京索莱宝科技有限公司;L-苯丙氨酸 广州翔博生物科技有限公司;MM032 RNA提取试剂盒、MM061 cDNA Synthesis Kit、MQ051 2×SYBR Green qPCR Master mix 江苏ProbeGene公司。
1.2 仪器与设备
CA-10 CO2测定仪 美国Sable Systems仪器公司;GC-14C气相色谱仪 日本岛津公司;TA.XT. Plus质构仪 英国Stable Micro Systems仪器公司;2000c型紫外分光光度计 美国Thermo Fisher Scientific科技有限公司;VORTEX-GENIE2漩涡混匀器 江苏天翎仪器有限公司;ABI2720 PCR仪器 美国应用生物系统公司;Gene9600定量PCR仪器 杭州博日科技有限公司;Multifuge1L-R高速冷冻离心机 德国Hermle公司;ChemiDoc MP全能型凝胶成像分析系统美国Bio-Rad有限公司;雪花状制冰机 日本SANYO公司;超净工作台 苏净集团;Synergy超纯水机美国Millipore公司;TanonES100电泳仪 上海朗赋实业有限公司。
1.3 方法
1.3.1 材料预处理
晚采鸭梨分2 个处理,分别为急速降温和缓慢降温。急速降温:将采摘的鸭梨直接放入(0±1)℃的冷库贮藏;缓慢降温:将采摘的鸭梨先放入(12±1)℃的冷库中预冷,待品温到12 ℃时开始降温,每5 d降温2 ℃,用6 个周期将温度降到(0±1)℃贮藏(从放入冷库开始计贮藏时间)。样品每30 d进行1次实验,随机从2 个处理组的鸭梨中分别选取45 个果,15 个果做生理指标测定;将剩下的30 个果沿果心外侧切分果实,迅速将果心切成块状用液氮急冻,然后置于-80 ℃下保存备用。以贮藏0 d的鸭梨果实(即为刚采摘的新鲜鸭梨)作对照组。
1.3.2 果实生理指标的测定
果心褐变指数的测定:沿鸭梨果实果心的外侧线切分果实,观察果实横切面果心部位的褐变情况。褐变级别分为4级:无褐变为0级,果心子房内壁出现褐斑为1级,1~2 个果心子房室褐变(果心褐变面积20%~50%)为2级,3~4 个果心子房室均出现褐变(褐变面积50%~80%)为3级,果心子房室全部褐变(褐变面积80%~100%)为4级。将每次实验选取的45 个果分3 次统计作为平行,每次统计15 个。褐变指数按照下式计算。

果实质量损失率参考邓冰等[24]的方法测定;果实硬度参考邓冰等[25]的方法,采用质构仪测定;呼吸强度和乙烯释放量参考韩云云等[26]的方法测定。
1.3.3 PAL活力的测定
参考Christopoulos[27]、Hussain[28]、周晓婉[29]等的方法并做修改进行测定。
1.3.4 鸭梨果心总RNA的提取
采用ProbeGene MM032 RNA提取试剂盒进行提取。根据琼脂凝胶电泳以及NanoDrop2000超微量分光光度计测定结果,提取的总RNA完整、浓度高,且OD260nm/OD280nm均在1.9~2.1之间,说明提取的总RNA质量高,适合用作下一步实验。
1.3.5 引物设计与合成
根据GenBank中pPAL1和pbPAL2的cDNA序列信息(GU906268.1、GU906269.1)设计特异性引物。采用pbACT2(登录号:GU830958.1)作为内参基因[30]。引物设计由ProbeGene完成设计,并由生工生物工程(上海)股份有限公司合成。qRT-PCR特异性引物序列及扩增特性见表1。

表 1 qRT-PCR特异性引物序列及扩增特性Table 1 Specific primer sequences and amplification characteristics used for qRT-PCR
1.3.6 cDNA第一链的合成
反转录反应体系:5×RT Buffer 10 μL、RT Enzyme Mix 2.5 μL、dNTPs 2.5 μL、Oligo(dT)15或Random hexamers 1.25 μL、模板RNA 2~3 g,RNase free ddH2O补至50 μL。第一链合成反应程序:50 ℃、60 min逆转录,85 ℃、5 min逆转录酶热失活。将cDNA产物在-20 ℃下储存或立即用于PCR。
1.3.7 qRT-PCR体系及程序
qRT-PCR体系:2×SYBR Green qPCR Master Mix 5 μL和50 μmol/L 正、反向引物各0.1 μL,模板DNA(根据DNA和cDNA浓度调整)补齐至10 μL。
qRT-PCR程序:95 ℃预变性10 min;然后95 ℃变性15 s,60 ℃退火30 s,共40 个循环。每个基因设置3 个平行。反应结束后,取5 μL PCR产物进行2.0%琼脂糖凝胶电泳,采用溴化乙锭染色,由全能型凝胶成像分析系统扫描成像后确认是否与扩增曲线结果吻合。最后再采用2-ΔΔCt法[31]计算基因的相对表达量。
1.4 数据处理
数据采用Excel 2010软件进行统计分析。用SPSS17.0软件中的Duncan检验进行数据间的差异显著性分析。
2 结果与分析
2.1 降温方式对鸭梨果心褐变指数的影响

图 1 降温方式对果心褐变指数的影响Fig. 1 Effects of different cooling methods on browning index of the fruit core
果心褐变指数是显示褐变严重程度的一个指标,既可以反映出果实整体的褐变情况,也可以反映出单个果心的褐变程度。如图1所示,从贮藏60 d开始,两种处理的鸭梨果心褐变指数均出现了极显著差异(P<0.05)。在贮藏30 d时,两组均未出现褐变现象。在贮藏60 d时,缓慢降温处理的鸭梨不仅出现了较多数量的褐变果,而且单果出现了褐变程度为3 级的果实,其褐变指数达到0.32;而急速降温处理的鸭梨只出现了1 级褐变果,褐变指数仅为0.02。在贮藏60 d后,缓慢降温处理组鸭梨的褐变情况比急速降温组严重。说明采收成熟度较高的鸭梨可能不适合采用缓慢降温的方式处理。成熟度较高的果实,采摘后经过缓慢降温处理长达30 d,加速了鸭梨果实的衰老,从而导致褐变加重[32]。
2.2 降温方式对鸭梨质量损失率及硬度的影响
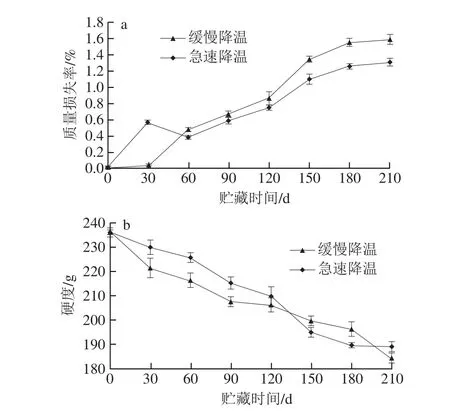
图 2 降温方式对鸭梨质量损失率(a)和硬度(b)的影响Fig. 2 Effects of different cooling methods on mass loss rate (a) and hardness (b) of ‘Yali’ pears
质量损失率和硬度均是反映鸭梨果实品质的重要指标,由图2a中可以看出,整个贮藏期间,果实质量损失率处于上升趋势。在贮藏前30 d,急速降温的果实质量损失速率明显高于缓慢降温的果实。贮藏30 d以后,缓慢降温果实的质量损失率均高于急速降温果实,尤其在贮藏120 d后质量损失率上升较快。说明缓慢降温一方面加速了果实水分的散失;另一方面在贮藏末期可能由于营养物质的损耗也导致了质量损失率的快速增加。由图2b可知,两种降温方式处理的果实硬度在贮藏期间均处于下降趋势,且急速降温果实的硬度基本上均高于缓慢降温的果实。说明急速降温处理既可以减缓鸭梨果实质量的下降,还可以保持果实的硬度。从这两个生理指标来看,缓慢降温不适合用于成熟度较高的晚采鸭梨,会加速缓慢降温过程中鸭梨果实的衰老和褐变[33],降低果实品质。
2.3 降温方式对鸭梨果实呼吸强度及乙烯释放量的影响
鸭梨属于典型的呼吸跃变型果实,在采后贮藏过程中出现明显的呼吸高峰和乙烯释放高峰是果实成熟、衰老的重要标志[34]。由图3可知,鸭梨在整个贮藏期间出现了呼吸高峰和乙烯释放高峰。由图3a可知,贮藏过程中鸭梨的呼吸高峰出现在第60天,在贮藏期缓慢降温果实的呼吸强度整体上高于急速降温果实。由图3b可知,整个贮藏期间,缓慢降温果实的乙烯释放量均明显高于急速降温果实,在贮藏90 d时均出现了比较明显的乙烯释放高峰,且二者差异显著(P<0.05)。果实的呼吸强度与乙烯释放量出现高峰的时间与果心褐变出现的时间相对较吻合,说明果实的呼吸强度和乙烯释放量可能与鸭梨果心褐变密切相关。
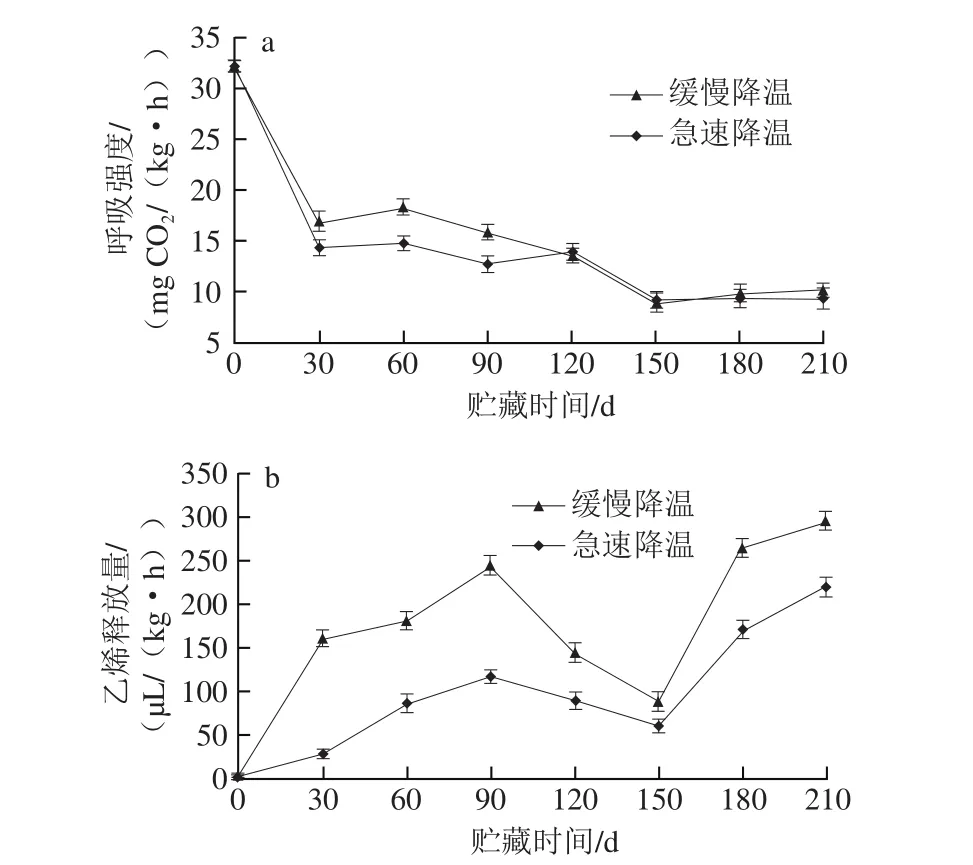
图 3 降温方式对鸭梨呼吸强度(a)和乙烯释放量(b)的影响Fig. 3 Effects of different cooling methods on respiratory intensity (a)and ethylene production rate (b) of ‘Yali’ pears
2.4 降温方式对鸭梨果心PAL活力的影响

图 4 降温方式对鸭梨果心PAL活力的影响Fig. 4 Effects of different cooling methods on PAL activity of the fruit core
PAL是苯丙氨酸途径中的关键酶,在植物生长、发育、抗逆性等方面起着关键作用[35]。PAL活力是植物抗逆性表现的一个生理指标[36-37]。由图4可知,两种处理的鸭梨果心PAL活力均为先上升后下降然后上升的变化趋势。其中缓慢降温果实PAL活力上升的程度比急速降温果实低,且很快再次处于上升趋势;而急速降温果实PAL活力上升到30 d时开始下降,直到贮藏末期(120 d);这可能是由于鸭梨从室温下进入冷库环境,受到冷害胁迫,激活了PAL的活力,使果实启动了冷害防御系统[23,38]。但是缓慢降温果实所处冷库温度为梯度降温模式,温度比较高,受到冷害胁迫不严重,使PAL活力在贮藏30 d时明显低于急速降温果实(P<0.05)。从贮藏60 d开始,缓慢降温果实的PAL活力持续上升,可能由于缓慢降温果实经过梯度降温,处于较高温度下长达1个月,使成熟度较高的果实内酚类物质不断消耗,进一步激活PAL活力[36]。而急速降温果实的PAL活力在30 d以后开始下降,说明鸭梨适应了低温环境,PAL的抗逆作用完成,这与欧阳光察等[39]的研究结果一致,都是遇到胁迫后PAL活力急剧上升达到高峰,然后急剧下降。在整个贮藏期间,缓慢降温处理果实的PAL活力在贮藏60 d以后一直高于急速降温果实,说明急速降温处理在一定程度上抑制了PAL活力。
根据PAL活力的变化趋势结合果心褐变指数变化分析,缓慢降温果实在贮藏60 d时褐变指数急剧升高,褐变严重,可能由于在贮藏60 d时PAL活力逐渐升高,促进了酚类物质的合成与积累,加速了鸭梨果心的褐变。而急速降温果实的褐变指数一直处于较低水平,这与急速降温果实的PAL活力处于下降趋势密切相关;120 d后急速降温果实的PAL活力又开始上升,而褐变指数上升不明显,这可能是由于贮藏后期果实衰老严重,刺激抗逆系统,提高了PAL活力,但其活力依然低于缓慢降温果实。
2.5 降温方式对鸭梨果心PAL基因相对表达的影响
2.5.1 总RNA提取及引物设计特异性检测
根据琼脂糖凝胶电泳及溶解曲线的结果可以检验扩增产物的特异性。选取的内参基因为pbACT2基因,该内参基因在鸭梨组织内部均稳定且高度表达,其表达水平与目标基因相似,则所选内参基因符合实验要求。使用表1中所示的引物对内参基因及晚采鸭梨的PAL1、PAL2基因做了反转录扩增,三者分别得到104、198、132 bp的扩增产物。扩增产物的溶解温度分别为84.4、88.2、86.9 ℃,它们的溶解曲线均呈现尖锐单峰,没有引物二聚体或者其他产物信号出现,说明引物特异性较好。采用LinRegPCR algorithm软件计算扩增产物的扩增效率,其PCR扩增效率在97%~100%之间,基于标准曲线得到的相关系数均高于0.999 5。没有添加模板的对照组中没有检测到荧光信号。
2.5.2 降温方式对鸭梨果心PAL基因相对表达的影响
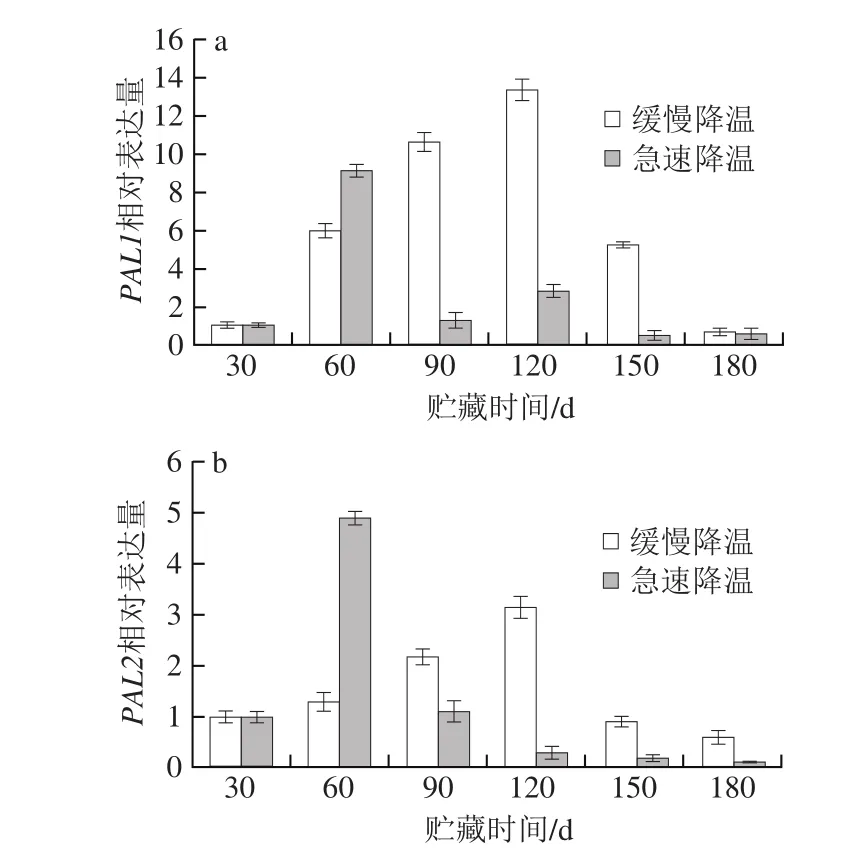
图 5 降温方式对鸭梨果心PAL1(a)和PAL2(b)基因相对表达量的影响Fig. 5 Effects of different cooling methods on the relative expression of PAL1 (a) and PAL2 (b) gene of the fruit core
目前鸭梨PAL基因有两个家族成员,分别为PbPAL1(GU906268.1)和PbPAL2(GU906269.1)[23]。本实验将贮藏30 d的PAL基因的相对表达量作为1进行比较。从图5a、b中都可以看出缓慢降温处理的鸭梨果心PAL基因相对表达量在贮藏前期随着时间的延长逐渐增加,直到贮藏后期(120 d),相对表达量开始下降;可能由于果实经过缓慢降温处理后,果实经过长达1个月的高温环境,酚类物质不断被消耗,使得PAL基因的表达逐渐升高,直到贮藏后期果实衰老严重,导致PAL基因表达量降低[18]。而经过急速降温处理的鸭梨果心PAL的相对表达量在贮藏30~60 d期间突然升高,可能是由于鸭梨从室温下突然进入(0±1)℃的冷库环境下,受到冷害胁迫,激活了PAL基因的表达,尤其是PAL1基因的表达,从而启动了防御机制,抑制了成熟度较高的晚采鸭梨果心褐变。在贮藏期间,缓慢降温果实的PAL基因相对表达量在贮藏60 d以后均明显高于急速降温果实。说明急速降温处理一定程度抑制了PAL基因的表达。
2.6 PAL基因相对表达量与鸭梨果实各生理指标的相关性分析
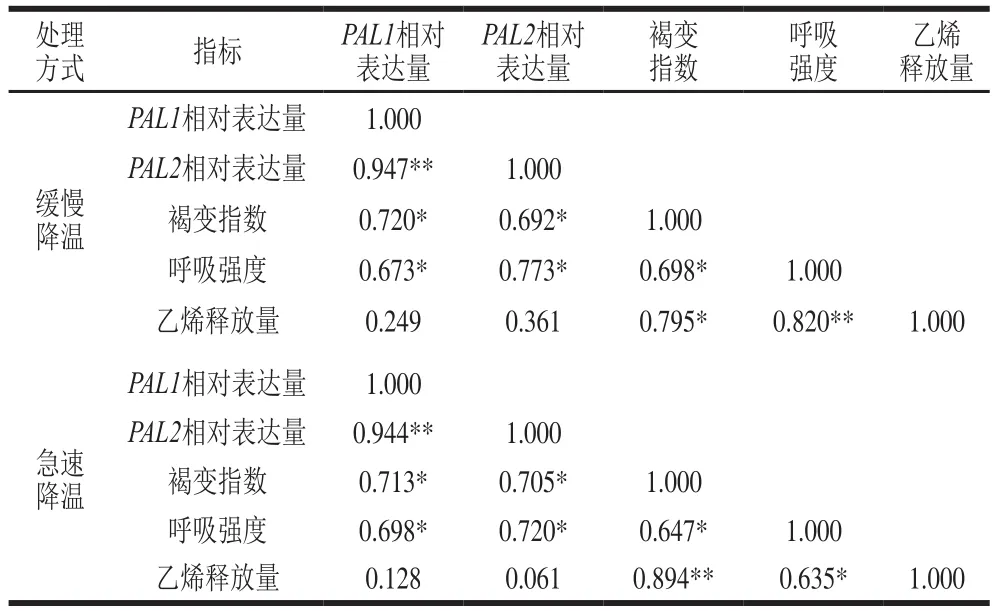
表 2 PAL基因相对表达量与生理指标的相关性分析Table 2 Correlation analysis between PAL gene relative expression and physiological indexes
如表2所示,两种降温方式下PAL1基因与PAL2基因的相对表达量极显著相关。PAL1与PAL2基因的相对表达量与果心褐变指数、呼吸强度均显著相关。而PAL基因与乙烯释放量相关性不显著,但是缓慢降温处理组的乙烯释放量在贮藏150 d之前与两个PAL基因的相对表达量变化趋势是一致的,只是乙烯高峰出现的时间比对应的PAL基因的表达量峰值提前了30 d,说明PAL不仅是合成酚类物质的关键酶,还与抗性信号物质乙烯的生物合成密切相关[40]。PAL基因的相对表达量与生理指标的相关性说明PAL基因相对表达量与鸭梨果心褐变密切相关。
3 讨 论
缓慢降温处理适时采收的鸭梨,可以有效抑制鸭梨果心褐变,延长鸭梨的贮藏期,提高鸭梨的贮藏品质[41];这是因为适时采收的鸭梨抗冷能力较差,急速降温处理会使果实发生冷害,导致果心褐变。而成熟度较高的鸭梨抗冷性好,不易发生冷害,采用缓慢降温处理会使晚采鸭梨进行后熟,更容易加快果实的衰老和褐变[42]。生产上采收期较晚的鸭梨可以直接入库进行贮藏,无需进行缓慢降温处理。
PAL是连接初级代谢和苯丙烷类代谢的第一步反应酶[43]。淀粉类物质经过莽草酸途径产生L-苯丙氨酸,L-苯丙氨酸经过PAL催化反应生成反式肉桂酸,进一步生成木质素、黄酮、绿原酸等碳化物。这些代谢产物在植物体内发挥着重要作用,而这些物质与PAL密切相关,因此PAL对植物的生理意义非常巨大[44]。一方面,PAL促进绿原酸等酚类物质合成,酚类物质又是PPO的前体物质,PPO是促进果实褐变的关键酶,PAL与PPO的协同作用,促进了鸭梨果实褐变[15,45];另一方面,PAL催化产生植保素、木质素等植物抗逆系统的主要物质,果实受到病害、冷害等胁迫时,就会激活PAL基因的表达,启动抗病、抗冷等抗逆系统,从而保护植物免受伤害[46]。植物所处的环境不同,PAL的作用可能不同。本实验中缓慢降温处理,PAL可能参与产生酚类物质合成途径,加速了果心的褐变;而急速降温处理可能使果实启动冷害防御系统产生抗逆反应,抑制了果实的褐变。鉴于PAL在植物体内的多重作用,还需要进一步研究PAL基因作用机理。
PbPAL1与PbPAL2基因分别为PAL基因的家族成员,也是目前在鸭梨果实内全长克隆的与褐变相关的仅有的两个成员。根据实验结果,当鸭梨果实受到冷害胁迫时,PAL1基因的相对表达量上升程度高于PAL2基因,说明PAL1在抗逆反应中比较敏感。这与闫洪波等[23]的实验结果相似,即PAL1基因在受到胁迫后1 h表达量开始上升,而PAL2的表达量在胁迫后12 h才开始上升。但这两种基因的功能基本相同,两者相对表达量极显著相关(P<0.01)。
本实验采用缓慢降温和急速降温两种降温方式专门针对采收期较晚、成熟度较高的鸭梨果实进行实验,通过测定晚采鸭梨的果心褐变指数、质量损失率、硬度、呼吸强度及乙烯释放量等生理指标,得知缓慢降温处理导致鸭梨果心褐变严重,仅贮藏60 d,褐变指数就高达0.32;而急速降温处理的鸭梨果心褐变指数仅为0.02。缓慢降温处理也导致果实硬度下降较快、质量损失率较高,果实呼吸强度及乙烯释放量也比急速降温处理的高。缓慢降温处理不仅没有起到抑制果心PAL活力及其基因表达的作用,反而加速了PAL基因的过量表达,导致鸭梨果心出现严重褐变现象。急速降温处理在贮藏前期激活了PAL基因的表达,启动了PAL基因参与的抗逆防御系统,抑制了鸭梨果心的褐变。在贮藏中后期PAL表达量均比较低,降低了PAL活力,从而对酚类物质的产生起到了抑制作用,进而降低了果实的褐变指数。这说明PAL活力及其基因的相对表达与鸭梨的褐变密切相关,同时也说明缓慢降温处理不适合用于成熟度较高的晚采鸭梨,采用急速降温有利于晚采鸭梨贮藏品质的保持。

